Farmakodynamik av progesteron - Pharmacodynamics of progesterone
Den farmakologi av progesteron , ett progestogen medicinering och naturligt förekommande steroidhormon , avser dess farmakodynamik , farmakokinetik , och olika administreringsvägar .
Progesteron är ett naturligt förekommande och bioidentiskt gestagen, eller en agonist för progesteronreceptorn , det biologiska målet för gestagener som endogent progesteron . Progesteron har också antimineralokortikoid och hämmande neurosteroidaktivitet , medan det verkar ha liten eller ingen glukokortikoid eller antiandrogen aktivitet och har ingen androgen aktivitet. På grund av sin progestogena aktivitet har progesteron vissa funktionella antiöstrogena effektervävnader som livmodern , livmoderhalsen och slidan . Dessutom har progesteron antigonadotropic effekter på grund av dess progestogen aktivitet och kan hämma fertilitet och undertrycka könshormonproduktion . Progesteron skiljer sig från progestiner ( syntetiska progestogener ) såsom medroxiprogesteronacetat och noretisteron , med implikationer för farmakodynamik och farmakokinetik samt effekt , tolerabilitet och säkerhet .
Progesteron kan tas genom munnen , in genom slidan och genom injektion i muskler eller fett , bland andra vägar. En progesteron vaginal ring och progesteron intrauterin enhet finns också som farmaceutiska produkter.
Handlingsmekanism
Progesteron är ett progestogen , eller en agonist av de nukleära progesteronreceptorer (PRS), den PR-A , PR-B , och PR-C . I en studie visade progesteron EC 50- värden på 7,7 nM för humant PR-A och 8,0 nM för humant PR-B. Förutom PR är progesteron en agonist för membranprogesteronreceptorerna (mPR), inklusive mPRα , mPRβ , mPRγ , mPRδ och mPRϵ . Det är också en potent antimineralokortikoid ( antagonist för mineralokortikoidreceptorn (MR)), liksom en mycket svag glukokortikoid (agonist för glukokortikoidreceptorn ). Progesteron interagerar inte signifikant med androgenreceptorn (AR) eller med östrogenreceptorn (ER). Förutom sin aktivitet som steroidhormon är progesteron en neurosteroid . Specifikt är det en antagonist av sigma σ 1 -receptorn , en negativ allosterisk modulator av nikotinacetylkolinreceptorer , och via dess aktiva metaboliter allopregnanolon och pregnanolon , en potent positiv allosterisk modulator för GABA A -receptorn , den huvudsakliga signalreceptorn för den hämmande signalsubstans γ-aminosmörsyra (GABA).
| Förening | PR | AR | ER | GR | HERR | SHBG | CBG |
|---|---|---|---|---|---|---|---|
| Progesteron | 50 | 0 | 0 | 10 | 100 | 0 | 36 |
| Anmärkningar: Värdena är procentsatser (%). Referensligander (100%) var promegeston för PR , metribolone för AR , E2 för ER , DEXA för GR , aldosteron för MR , DHT för SHBG , och kortisol för CBG . Källor: | |||||||
| Förening | Form | Dos för specifik användning (mg) | DOA | |||
|---|---|---|---|---|---|---|
| TFD | POICD | CICD | ||||
| Algestonacetofenid | Oljesol. | - | - | 75–150 | 14–32 d | |
| Gestonorone caproate | Oljesol. | 25–50 | - | - | 8–13 d | |
| Hydroxyprogest. acetat | Aq. misst. | 350 | - | - | 9–16 d | |
| Hydroxyprogest. caproate | Oljesol. | 250–500 | - | 250–500 | 5–21 d | |
| Medroxyprog. acetat | Aq. misst. | 50–100 | 150 | 25 | 14–50+ d | |
| Megestrolacetat | Aq. misst. | - | - | 25 | > 14 d | |
| Noretisteron enanthate | Oljesol. | 100–200 | 200 | 50 | 11–52 d | |
| Progesteron | Oljesol. | 200 | - | - | 2–6 d | |
| Aq. soln. | ? | - | - | 1–2 d | ||
| Aq. misst. | 50–200 | - | - | 7–14 d | ||
|
Anteckningar och källor:
|
||||||
Antimineralokortikoid aktivitet
Progesteron är en potent antimineralokortikoid. Den har 1000% av affiniteten för aldosteron , den viktigaste endogena agonisten, för human MR och 100% av affiniteten för aldosteron för råtta MR. Progesteron ger antimineralokortikoideffekter som natriures ( utsöndring av natrium i urinen ) vid normala fysiologiska koncentrationer. En 200 mg dos av oralt progesteron anses vara ungefär ekvivalent med antimineralokortikoideffekt till en dos på 25 till 50 mg av den potenta antimineralokortikoid spironolakton , som i sig är ett derivat av progesteron. Doser av 50 till 200 mg progesteron genom intramuskulär injektion , som liknar progesteronexponering under tredje trimestern av graviditeten , har också rapporterats ge antimineralokortikoidliknande effekter. De antimineralokortikoida effekterna av progesteron ligger till grund för dess förmåga att sänka blodtrycket och minska vatten- och saltretention och dess möjliga tillämpning vid behandling av högt blodtryck . En aktiv metabolit av progesteron, 11-deoxikortikosteron (21-hydroxiprogesteron), är en föregångare till aldosteron och har stark mineralokortikoidaktivitet (dvs är en stark agonist för MR). Det bildas emellertid i relativt små mängder, och alla sådana effekter som det produceras uppvägs vanligtvis av progesterons antimineralokortikoidaktivitet. Progesteron kan vara en relativt svag antimineralokortikoid in vivo .
Glukokortikoidaktivitet
Progesteron är en partiell agonist av glukokortikoidreceptorn (GR). Den har cirka 35% av affiniteten för dexametason , en kortikosteroid , för den mänskliga GR, och cirka 3 till 11% av affiniteten för dexametason för råttan GR. Dock verkar progesteron för att visa svag eller ingen glukokortikoid aktivitet och ingen antiglukokortikoid aktivitet in vitro och i djur. Icke desto mindre har progesteron visat sig uppreglera trombinreceptorn i vaskulära glattmuskelceller in vitro , en glukokortikoideffekt, och detta kan ha klinisk relevans i förhållande till risken för blodproppar.
| Steroid | Klass | TR ( ↑ ) a | GR (%) b |
|---|---|---|---|
| Dexametason | Kortikosteroid | ++ | 100 |
| Etinylöstradiol | Östrogen | - | 0 |
| Etonogestrel | Progestin | + | 14 |
| Gestodene | Progestin | + | 27 |
| Levonorgestrel | Progestin | - | 1 |
| Medroxyprogesteronacetat | Progestin | + | 29 |
| Noretisteron | Progestin | - | 0 |
| Norgestimat | Progestin | - | 1 |
| Progesteron | Progestogen | + | 10 |
| Fotnoter: a = Trombin receptor (TR) uppreglering (↑) i vaskulära glatta muskelceller (VSMC). b = RBA (%) för glukokortikoidreceptorn (GR). Styrka: - = Ingen effekt. + = Uttalad effekt. ++ = Stark effekt. Källor: | |||
Androgen och antiandrogen aktivitet
Bindningen och aktiviteten av progesteron vid AR, det biologiska målet för androgener som testosteron och dihydrotestosteron (DHT) i kroppen, är kontroversiell. Vissa studier har funnit att progesteron binder till AR, med agonistisk och antagonistisk aktivitet utövad, medan andra studier har funnit mycket låg eller ingen affinitet för AR alls. I djurstudier har inga androgena effekter observerats, men svaga antiandrogena effekter har rapporterats. Den svaga antiandrogena aktiviteten har inte tillskrivits antagonism av AR genom progesteron, utan snarare dess svaga 5α-reduktashämning och därmed hämning av omvandlingen av testosteron till det mer potenta DHT. Det finns inga kliniska bevis på AR-medierad androgen eller antiandrogen aktivitet med progesteron. Progesteron har inte förknippats med några klassiska androgena effekter i kliniska studier på kvinnor, inklusive inga förändringar i blodfetter profil eller könshormonbindande globulin nivåer, akne , fet hud , hirsutism eller djupare röst eller med virilisering av kvinnliga foster. Som sådan är den vetenskapliga konsensusen att progesteron kliniskt varken är androgen eller antiandrogen. Detta står i kontrast till många progestiner, såsom 19-nortestosteronderivat (t.ex. noretisteron , levonorgestrel , dienogest ) och 17α-hydroxiprogesteronderivat (t.ex. cyproteronacetat , medroxiprogesteronacetat ), som binder till AR och har associerats med signifikant androgena eller antiandrogena effekter beroende på progestinet i fråga. På grund av sin brist på androgen och antiandrogen aktivitet, och därmed brist på maskuliniserande och feminiserande effekter, är progesteron en av få progestogener som är lämpliga för användning under graviditet hos kvinnor som riskerar för tidig förlossning eller återkommande missfall .
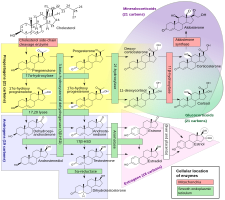
Även om progesteron inte har signifikant AR-medierad androgen eller antiandrogen aktivitet, är det en föregångare och intermediär , om än avlägsen, i biosyntesen av androgener från kolesterol . Av denna anledning har det funnits en del spekulationer om att exogent progesteron kan omvandlas till androgener av vissa vävnader som uttrycker erforderliga enzymer. Progesteron omvandlas med 17a-hydroxylas till 17a-hydroxiprogesteron ; 17a-hydroxiprogesteron omvandlas med 17,20-lyas till androstenedion ; och androstenedion omvandlas av 17p-hydroxisteroiddehydrogenaser till testosteron. CYP17A1 , cytokrom P450- genen som kodar för 17α-hydroxylas och 17,20-lyas, uttrycks huvudsakligen i könskörtlarna ( äggstockarna och testiklarna ) och binjurarna . Även om det är teoretiskt möjligt att progesteron kan omvandlas i kroppen till androgener, har inga androgena effekter observerats i djurstudier. Dessutom har kliniska studier, där kvinnor behandlades med 100 till 300 mg/dag oralt progesteron, inte funnit någon eller endast en liten ökning av halterna av 17α-hydroxiprogesteron, och ingen förändring av androgennivåer, inklusive dehydroepiandrosteron , androstenedion och testosteron. I dessa studier förändrades inte heller nivåerna av östradiol och kortisol , som progesteron är en föregångare till, även om halterna av 11-deoxikortikosteron ökade signifikant.
5α-reduktashämning
Progesteron är ett substrat för 5α-reduktas och har visat sig fungera som en konkurrerande hämmare av detta enzym in vitro i en mängd olika studier. I en studie, visade den IC 50 värden av 1375 nM och 88 nM (i närvaro av 50 nM androstendion som substrat ) för 5α-reduktas typ 1 och 2 , respektive. 5α-reduktas uttrycks starkt i hud , hårsäckar och prostatakörteln och ansvarar för omvandlingen av testosteron till det flerfaldiga mer kraftfulla androgen DHT i sådana vävnader. Som sådan har det föreslagits att progesteron kan ha någon antiandrogen effekt genom att fungera som en 5α-reduktashämmare . Emellertid beskrivs hämning av 5α-reduktas av progesteron som en svag effekt som endast har visats in vitro och vid sufrafysiologiska koncentrationer. I enlighet därmed har fysiologiska nivåer av cirkulerande progesteron inte visat sig betydande påverka cirkulerande DHT -koncentrationer.
Medfödd 5α-reduktas 2-brist är ett sällsynt intersextillstånd som är associerat med tvetydiga könsorgan hos manliga foster på grund av brist på DHT-produktion under genital differentiering . Experimentell prenatal exponering för etablerade 5α-reduktashämmare som finasterid har visat sig producera liknande feminiserade genitala defekter hos hanar inklusive gnagare och apor. Däremot har exogen administrering av progesteron till gravida gnagare och apor resulterat i minimal avvikelse hos valpar han- eller honungar. Dessutom ökar endogena progesteronnivåer naturligt till extremt höga koncentrationer under graviditeten, men könsdefekter uppstår inte. I enlighet med att de totala halterna av progesteron hos gravida kvinnor vid termin är cirka 150 ng/ml (~ 500 nM), är fria eller obundna och därmed bioaktiva koncentrationer av progesteron endast cirka 3 ng/ml (~ 10 nM) på grund av den höga plasmaproteinbindning av progesteron, och dessa koncentrationer är fortfarande väl under de tidigare nämnda IC 50 -värdena för inhibition av 5α-reduktas typ 1 och 2. Såsom med endogen progesteron under graviditeten, exogen har kompletterande progesteron under graviditeten befunnits inte öka risken för hypospadi hos spädbarn.
Även om systemiskt progesteron inte verkar vara en effektiv 5α-reduktashämmare, kan topiskt progesteron producera kraftig hämning av 5α-reduktas i huden på grund av de mycket höga lokala koncentrationer som uppstår. En studie visade att aktuellt progesteron som applicerades på skamområdet hos män inhiberade 5α-reduktas i huden i denna region med 75%. Förutom hämning av 5α-reduktas metaboliseras progesteron av 5α-reduktas till 5α-dihydroprogesteron (5α-DHP), en förening som rapporteras ha viss antagonistisk aktivitet vid AR. Denna förening verkar dock inte ha någon systemisk antiandrogen aktivitet. Trots sin uppenbara 5α-reduktashämning har effektiviteten av topiskt progesteron vid behandling av håravfall i mönster varit dålig.
Annan aktivitet
Vissa progestiner har befunnits stimulera proliferation av MCF-7- bröstcancerceller in vitro , en åtgärd som är oberoende av de klassiska PRs och i stället medieras via progesteronreceptormembrankomponenten-1 (PGRMC1). Progesteron, nomegestrolacetat och klormadinonacetat verkar neutralt och stimulerar inte proliferation, medan noretisteron , desogestrel , levonorgestrel och drospirenon starkt stimulerar spridning och medroxiprogesteronacetat , dienogest och dydrogesteron svagt stimulerar spridning. Som sådan skiljer sig progesteron från vissa men inte alla progestiner i aktiviteten som förmedlar denna PGRMC1-beroende effekt. Det är oklart om dessa fynd kan förklara de olika riskerna för bröstcancer som observerats med progesteron, dydrogesteron och andra progestiner som medroxiprogesteronacetat och noretisteron i kliniska studier .
Effekter i kroppen och hjärnan
PR uttrycks i stor utsträckning i hela kroppen, inklusive i livmodern , livmoderhalsen , slidan , äggledarna , bröst , fett , hud , hypofys , hypothalamus och på andra håll i hjärnan . Genom aktivering av PR (såväl som mPR) har progesteron många effekter, inklusive följande:
- Framkallar endometriell sekretorisk transformation under förberedelse för graviditet (> 5 ng/ml)
- Förhindrar östrogeninducerad endometrial hyperplasi och ökad risk för endometriecancer
- Bibehåller graviditeten via effekter i endometrium (med abstinens som resulterar i missfall )
- Minskar mängden och fibrositeten i livmoderhalsens slem och gör att livmoderhalsen blir fastare och tätare stängd
- Kontrollerar rörlighet och sammansättning av vätska i äggledarna
- Minskad cornification och mognad av slemhinnan
- Orsakar vätskeansamling i brösten som resulterar i tillfällig förstoring under menstruationscykeln
- Förmedlar lobuloalveolär utveckling av brösten som är nödvändig för amning
- Undertrycker laktationsinitiering och utlöser laktation vid uttag (som vid förlossning )
- Bibehåller hudens hälsa, integritet, utseende och återfuktning och saktar hudens åldrande
- Modulerar hjärnans funktion, med effekter på humör , känslomässighet och sexualitet , samt kognition och minne
- Utövar negativ feedback på hypotalamus-hypofys-gonad-axeln (HPG-axeln) genom att undertrycka sekretion av gonadotropiner FSH och LH från hypofysen (inklusive mitten av cykeln gonadotropin surge), och hämmar därigenom gonadal könshormonproduktion samt ägglossning och fertilitet (> 2 ng/ml)
- Ökar basal kroppstemperatur (med 0,3–0,6 ° C (0,5–1,0 ° F) i förhållande till preovulation ) via hypotalamus (> 4 ng/ml)
- Minskar värmevallningar via hypothalamus
- Stimulerar andningen via hypothalamus och/eller andningscentrum
- Påverkar risken och/eller utvecklingen av hormonkänsliga cancerformer inklusive bröstcancer och endometriecancer
Många av effekterna av progesteron kräver östrogen, eftersom östrogener vävnader för progesteron genom att inducera uttryck av PR. PRs induceras i brösten av östrogener, och av denna anledning antas det att gestagener inte kan förmedla bröstförändringar i frånvaro av östrogener.
Progesteron sänker också blodtrycket och minskar vatten- och saltretention bland andra effekter via dess antimineralokortikoidaktivitet.
Progesteron kan ge lugnande , hypnotiska , ångestdämpande , euforiska , kognitiva , minnes- och motorhämmande , antikonvulsiva och till och med anestetiska effekter genom bildning av tillräckligt höga koncentrationer av dess neurosteroidmetaboliter och följaktligen GABA A- receptorpotential i hjärnan.
Livmodereffekter
Under normala fysiologiska omständigheter producerar progesteron som utsöndras av corpus luteum under lutealfasen i menstruationscykeln endometriell transformation av den östrogenfärgade livmodern som förberedelse för implantation och graviditet . Normal progesteronproduktion under lutealfasen är i genomsnitt 25 mg/dag med ett intervall på 15 till 50 mg/dag. Progesteronnivåer under lutealfasen sträcker sig från 7 ng/ml till 22 ng/ml med hjälp av vätskekromatografi -tandem -masspektrometri (LC – MS/MS) per en källa. Hållbara progesteronnivåer på mer än 5 ng/ml krävs för fullständig endometriell transformation. Progesteronnivåer på mer än 10 ng/ml är sällan associerade med lutealfasdefekt på grundval av endometriebiopsi .
Lutealfashalter av progesteron sägs produceras med 25 mg/dag progesteron i oljelösning genom intramuskulär injektion eller med 100 mg/dag progesteron genom vaginal eller rektal administrering. Progesteron genom intramuskulär injektion i oljelösning har visat sig producera endometrial transformation vid en dos av 10 eller 20 mg/dag i 14 dagar (total dos per cykel på 200 mg), medan en enda intramuskulär injektion av 200 mg progesteron i mikrokristallin vattenhaltig suspension ger endometrial transformation efter 10 till 14 dagar. En studie fann fullständig och ekvivalent endometrial transformation med subkutan injektion av 25 mg/dag kontra 50 mg/dag progesteron i vattenlösning . På grund av en livmoder- first-pass-effekt och markant högre livmoderprogesteronnivåer än med andra vägar ger 45 mg/dag vaginal progesteron, en dos som uppnår cirkulerande progesteronnivåer på endast 1 till 5 ng/ml, fullständig endometriell transformation. Omvänt var intranasal administrering av progesteron som uppnådde progesteronnivåer på 2 till 5 ng/ml ineffektiv. Transdermalt progesteron uppnår mycket låga progesteronnivåer och anses vara ineffektiv för endometrialskydd.
Endometriell transformationsdos av oralt mikroniserat progesteron hos kvinnor har listats som 200 till 300 mg/dag eller totalt 4200 mg per cykel. En klinisk studie visade dock att 300 mg/dag oralt mikroniserat progesteron var otillräckligt för fullständig endometriell transformation. På samma sätt har 600 till 1000 mg/dag oralt mikroniserat progesteron rapporterats vara ineffektivt för att uppnå fullständig endometriell transformation. Trots otillräcklig endometriell transformation med oralt progesteron är kontinuerlig 100 mg/dag oral mikroniserad progesteron eller cyklisk 200 mg/dag oral mikroniserad progesteron effektiv för skydd av endometrium mot östrogeninducerad endometrial hyperplasi . Å andra sidan, och i motsats till gestagen, har typiska kliniska doser av oralt mikroniserat progesteron associerats med misslyckande med att förhindra ökad risk för endometriecancer orsakad av östrogenbehandling.
Antiestrogena effekter
Progesteron, liksom alla gestagener, har antiöstrogena effekter i vissa vävnader som livmodern , livmoderhalsen , slidan och brösten , och möjligen även hjärnan . Dessa effekter medieras genom aktivering av PR i dessa vävnader. Progesteron har inte antiestrogena effekter i den mer konventionella känslan av att binda till och motverka ER eller binda till och hämma enzymer som är involverade i östrogen biosyntesen . I stället, till exempel i endometrium , orsakar progesteron nedreglering av ER och uppreglering av de östrogeninaktiverande enzymerna 17β-hydroxysteroid dehydrogenas 2 (omvandlar östradiol till östron ) och östronsulfotransferas (omvandlar östron till estronsulfat ). De antiöstrogena effekterna av progesteron och andra gestagener utgör grunden för deras enda godkända indikation vid menopausal hormonbehandling: förebyggande av långvarig oöppnad östrogeninducerad endometrial hyperplasi och ökad risk för endometriecancer hos kvinnor med intakta livmoder.
I brösten nedreglerar progesteron och andra gestagener ER såväl som de östrogenaktiverande enzymerna steroid sulfatas (omvandlar estronsulfat till östron) och 17β-hydroxysteroid-dehydrogenas 1 (omvandlar östron till östradiol) och uppreglerar estronsulfotransferas. Andra studier tyder dock på att gestagener inte nedreglerar ER -uttryck i brösten. När det appliceras direkt på brösten hos kvinnor, kan progesteron blockera de proliferativa effekterna av östradiol. Koncentrationerna var emellertid sufrafysiologiska och detsamma kanske inte är fallet med fler fysiologiska koncentrationer. Cellproliferation i brösten är störst i lutealfasen i menstruationscykeln , när progesteronnivåerna är som högst.
Det har antagits att gestagener kan motverka olika effekter av östrogener i hjärnan, såsom stimulerande och excitatoriska effekter på neuronal aktivitet . Progesteron har dessutom en speciell ställning bland gestagener beträffande sådana åtgärder på grund av dess hämmande neurosteroidmetaboliter och deras centrala depressiva effekter. Det har föreslagits att dessa åtgärder av gestagener kan förklara ogynnsamma effekter på humör som har rapporterats med dessa mediciner hos vissa kvinnor. Emellertid är ömsesidiga interaktioner mellan östrogener och gestagener i hjärnan i allmänhet kontroversiella och kräver mer forskning.
Progesteron kan ge kroppsövergripande antiöstrogena effekter vid mycket höga doser hos både kvinnor och män via dess antigonadotropa effekter och därmed undertryckande av gonadal östrogenproduktion (se nedan ). Dessa antigonadotropa effekter medieras genom hyperaktivering av PR.
Effekter på HPG -axeln
Antigonadotropa effekter
Progestogener har antigonadotropa effekter vid tillräckligt höga doser via aktivering av PR och följaktligen negativ feedback på och därmed undertryckande av hypothalamus -hypofys -gonadalaxeln (HPG -axeln). Detta resulterar i undertryckande av gonadotropin sekre och i förlängningen störningar fertilitet och gonad könshormon produktion . Progesteron förhindrar ägglossning genom att undertrycka mittcykelökningen i gonadotropinsekretion under menstruationscykeln .
Den ägglossning inhiberande (dvs preventivmedel) dosering av oral kristallint (icke-mikroniserad) progesteron i kvinnor är 300 mg / dag eller högre. Denna siffra är dock baserad på begränsade kliniska data. I klinisk forskning på 1950-talet som bestäms denna dosering, inträffade ägglossning inhibering i 50 till 100% av kvinnorna när bedömas via åtgärder inklusive urin pregnandiol utsöndring , dagliga basala kroppstemperatur , endometriala biopsier och vaginala utstryk . En annan studie visade att ägglossningshämning med 300 mg/dag oralt icke-mikroniserat progesteron inträffade i en "andel av fallen" vid bedömning via laparotomi . En tredje studie visade att ägglossningen inhiberades hos endast 38% av kvinnorna som behandlades med 1000 mg/dag oralt, icke-mikroniserat progesteron. En fjärde publikation uppgav att även 750 till 1 000 mg/dag oralt icke-mikroniserat progesteron hade svaga effekter, vilket framgår av dålig termogen effekt, svag endometrial effekt och brist på produktion av abstinensblödning hos amenorrheiska kvinnor. Neumann och kollegor listade den ägglossningshämmande dosen av oralt icke-mikroniserat progesteron hos kvinnor som 300 till 500 mg/dag men gav inga andra detaljer.
I en studie av en progesteron vaginalring ensam eller i kombination med östradiol som släppte 1,5 till 3 mg/dag progesteron och uppnådde genomsnittliga progesteronnivåer som varierade mellan 0,7 och 1,6 ng/ml (medelvärde 0,9 ng/ml) under anovulatoriska cykler, inträffade ägglossning i 18 av 30 (60%) menstruationscykler. En studie av en vaginal progesteronring som frigjorde nästan 10 mg/dag progesteron och upprätthöll genomsnittliga progesteronnivåer på 4,4 ng/ml (intervall 2,4–6,5 ng/ml) fann att ägglossningen var inhiberad hos vissa men inte alla kvinnor. I en annan studie resulterade en progesteron vaginalring som släppte ut cirka 10 mg/dag progesteron och producerade progesteronnivåer på cirka 4 ng/ml (intervall 3–5,2 ng/ml) i att ägglossning inträffade hos 25% av de behandlade ammande kvinnorna jämfört med en frekvens av 56% i en kontrollgrupp av ammande kvinnor. En studie på rhesus apor fann att en vaginal ring som levererade 0,235 eller 1,77 mg/dag progesteron hämmade ägglossningen hos alla apor vid den högre dosen och i en andel apor vid den lägre dosen. En dos progesteron på 5 till 10 mg/dag genom intramuskulär injektion har visat sig förhindra ägglossning hos kvinnor och har ansetts vara effektivt som ett injicerbart preventivmedel endast för gestagen .
Korttidsbehandling med 300 mg/dag oralt progesteron hade ingen effekt på luteiniserande hormonpulsfrekvens hos kvinnor. Behandling med en hög dos av oralt progesteron på 100 mg fyra gånger per dag (eller 400 mg/dag totalt) hos män i 10 dagar orsakade ingen förändring av testosteronnivåerna , vilket tyder på att oralt progesteron har liten eller ingen antigonadotrop effekt hos män vid typiska kliniska doser. Dessutom har en studie fann att administrering av 1000 mg / dag oralt progesteron i 3 månader hade ingen signifikant effekt på urin gonadotropin utsöndring . Å andra sidan resulterade en enda 50 mg intramuskulär injektion av progesteron, vilket är förknippat med höga progesteronnivåer på cirka 50 ng/ml (eller tidigt till mitten av graviditeten), i betydande (50–60%) undertryckande av luteiniserande hormon , follikelstimulerande hormon och testosteronnivåer hos män. På samma sätt minskade kontinuerliga eller intermittenta intravenösa injektioner av 100 till 400 mg/dag progesteron i 10 dagar signifikant uringonadotropinutsöndring i urinen. Progestogener i allmänhet kan undertrycka gonadal testosteronproduktion hos män med högst cirka 70 till 80% eller till strax över kastratnivåer när de används vid tillräckligt höga doser.
En studie med 50 mg/dag progesteron genom intramuskulär injektion hos fem män fann att medicinen producerade azoospermi eller svår oligozoospermi inom alla 10 veckor, undertryckt libido , erektil funktion och ejakulatvolym till minimala nivåer, gav liten gynekomasti hos två av männen , minskade måttligt testikelstorlek , och nedsatt testikulär morfologi . Vid avbrott återvände spermierna till normala hos männen inom 14 till 17 veckor. I en annan studie resulterade 100 mg rektala suppositorier av progesteron givet fem gånger om dagen i 9 dagar i progesteronnivåer på 5,5 till 29 ng/ml och undertryckte cirkulerande testosteron- och tillväxthormonnivåer med cirka 50% hos män, men påverkade inte libido eller erektil styrka med denna korta behandlingstid.
Progonadotropa effekter
Progesteron kan ha progonadotropa effekter under vissa omständigheter.
Neurosteroideffekter
Progesteron, genom verkan av neurosteroidaktiva metaboliter, såsom allopregnanolon och pregnanolon , är en potent positiv allosterisk modulator för GABA A- receptorn , den huvudsakliga signalreceptorn för den hämmande signalsubstansen γ-aminosmörsyra (GABA). Det kan ge lugnande , hypnotiska , ångestdämpande , euforiska , kognitiva , minnes- och motorhämmande , antikonvulsiva och till och med anestetiska effekter med bildning av tillräckligt höga koncentrationer av dess neurosteroidmetaboliter och därmed GABA A- receptorpotential i hjärnan. Dessa åtgärder och effekter liknar karaktäristiskt de hos andra GABA A -receptor positiva allosteriska modulatorer som alkohol , barbiturater och bensodiazepiner .
På samma sätt som andra GABA A -receptor positiva allosteriska modulatorer som alkohol, barbiturater och bensodiazepiner har tolerans visat sig utvecklas med exponering för ökade nivåer av allopregnanolon och relaterade hämmande neurosteroider. Detta inkluderar nedreglering och desensibilisering av GABA A -receptorn, minskade effekter av allopregnanolon och andra GABA A -receptoraktivatorer (t.ex. GABA och bensodiazepiner), och rebound- eller abstinenseffekter vid fall i allopregnanolonnivåer. Dessutom har förändringar i allopregnanolonnivåer varit inblandade i negativa neuropsykiatriska effekter i samband med menstruationscykeln (t.ex. dysfori , depression , ångest , irritabilitet ) och postpartumperioden (t.ex. postpartumdepression ), liksom vid katamenial epilepsi ( anfall ). Låga och höga nivåer av allopregnanolon tycks ha en neutral effekt på humöret, medan måttliga nivåer har en negativ effekt, vilket kan ligga till grund för symptomen på premenstruellt syndrom och premenstruell dysforisk störning som observeras hos 30 till 40% av premenopausala kvinnor. Denna U-formade effekt på humör verkar vara en gemensam egenskap hos GABA A- receptor positiva allosteriska modulatorer.
Se även
Referenser
Vidare läsning
- Sitruk-Ware R, Bricaire C, De Lignieres B, Yaneva H, Mauvais-Jarvis P (oktober 1987). "Oralt mikroniserat progesteron. Biotillgänglighet farmakokinetik, farmakologiska och terapeutiska konsekvenser-en översyn". Preventivmedel . 36 (4): 373–402. doi : 10.1016/0010-7824 (87) 90088-6 . PMID 3327648 .
- Simon JA (december 1995). "Mikroniserat progesteron: vaginal och oral användning". Klinisk obstetrik och gynekologi . 38 (4): 902–14. doi : 10.1097/00003081-199538040-00024 . PMID 8616985 .
- Ruan X, Mueck AO (november 2014). "Systemisk progesteronbehandling-oral, vaginal, injektioner och till och med transdermal?". Maturitas . 79 (3): 248–55. doi : 10.1016/j.maturitas.2014.07.009 . PMID 25113944 .
