Biosyntes -Biosynthesis
Biosyntes är en flerstegs, enzymkatalyserad process där substrat omvandlas till mer komplexa produkter i levande organismer. I biosyntes modifieras enkla föreningar , omvandlas till andra föreningar eller förenas för att bilda makromolekyler . Denna process består ofta av metabola vägar . Några av dessa biosyntetiska vägar är belägna inom en enda cellulär organell , medan andra involverar enzymer som finns inom flera cellulära organeller. Exempel på dessa biosyntetiska vägar inkluderar produktionen av lipidmembrankomponenter och nukleotider. Biosyntes är vanligtvis synonymt med anabolism .
Förutsättningselementen för biosyntes inkluderar: prekursorföreningar , kemisk energi (t.ex. ATP ) och katalytiska enzymer som kan kräva koenzymer (t.ex. NADH , NADPH ). Dessa element skapar monomerer , byggstenarna för makromolekyler. Några viktiga biologiska makromolekyler inkluderar: proteiner , som är sammansatta av aminosyramonomerer sammanfogade via peptidbindningar , och DNA- molekyler, som är sammansatta av nukleotider förenade via fosfodiesterbindningar .
Egenskaper för kemiska reaktioner
Biosyntes uppstår på grund av en rad kemiska reaktioner. För att dessa reaktioner ska äga rum är följande element nödvändiga:
- Prekursorföreningar : dessa föreningar är startmolekylerna eller substraten i en reaktion. Dessa kan också ses som reaktanter i en given kemisk process.
- Kemisk energi : kemisk energi kan hittas i form av högenergimolekyler. Dessa molekyler krävs för energetiskt ogynnsamma reaktioner. Dessutom driver hydrolysen av dessa föreningar en reaktion framåt. Högenergimolekyler, såsom ATP , har tre fosfater . Ofta spjälkas det terminala fosfatet av under hydrolys och överförs till en annan molekyl.
- Katalytiska enzymer : dessa molekyler är speciella proteiner som katalyserar en reaktion genom att öka reaktionshastigheten och sänka aktiveringsenergin .
- Koenzymer eller kofaktorer : kofaktorer är molekyler som hjälper till i kemiska reaktioner. Dessa kan vara metalljoner , vitaminderivat såsom NADH och acetyl CoA , eller icke-vitaminderivat såsom ATP. När det gäller NADH överför molekylen ett väte, medan acetyl CoA överför en acetylgrupp och ATP överför ett fosfat.
I den enklaste meningen har reaktionerna som sker i biosyntes följande format:
Några varianter av denna grundläggande ekvation som kommer att diskuteras mer i detalj senare är:
- Enkla föreningar som omvandlas till andra föreningar, vanligtvis som en del av en reaktionsväg i flera steg. Två exempel på denna typ av reaktion inträffar under bildandet av nukleinsyror och laddningen av tRNA före translation . För några av dessa steg krävs kemisk energi:
- Enkla föreningar som omvandlas till andra föreningar med hjälp av kofaktorer. Till exempel kräver syntesen av fosfolipider acetyl CoA, medan syntesen av en annan membrankomponent, sfingolipider , kräver NADH och FADH för att bilda sfingosinryggraden . Den allmänna ekvationen för dessa exempel är:
- Enkla föreningar som går samman för att skapa en makromolekyl. Till exempel går fettsyror samman för att bilda fosfolipider. I sin tur interagerar fosfolipider och kolesterol icke-kovalent för att bilda lipiddubbelskiktet . Denna reaktion kan avbildas enligt följande:
Lipid
Många invecklade makromolekyler syntetiseras i ett mönster av enkla, upprepade strukturer. Till exempel är de enklaste strukturerna av lipider fettsyror . Fettsyror är kolvätederivat ; de innehåller en karboxylgrupp "huvud" och en kolvätekedja "svans". Dessa fettsyror skapar större komponenter, som i sin tur innehåller icke-kovalenta interaktioner för att bilda lipiddubbelskiktet. Fettsyrakedjor finns i två huvudkomponenter av membranlipider: fosfolipider och sfingolipider . En tredje större membrankomponent, kolesterol , innehåller inte dessa fettsyraenheter.
Fosfolipider
Grunden för alla biomembran består av en dubbelskiktsstruktur av fosfolipider. Fosfolipidmolekylen är amfipatisk ; den innehåller ett hydrofilt polärt huvud och en hydrofob opolär svans. Fosfolipidhuvudena interagerar med varandra och med vattenhaltiga medier, medan kolvätesvansarna orienterar sig i mitten, bort från vatten. Dessa senare interaktioner driver dubbelskiktsstrukturen som fungerar som en barriär för joner och molekyler.
Det finns olika typer av fosfolipider; följaktligen skiljer sig deras syntesvägar. Det första steget i fosfolipidsyntes involverar emellertid bildandet av fosfatidat eller diacylglycerol-3-fosfat vid det endoplasmatiska retikulumet och det yttre mitokondriella membranet . Syntesvägen finns nedan:
Vägen börjar med glycerol 3-fosfat, som omvandlas till lysofosfatidat genom tillsats av en fettsyrakedja som tillhandahålls av acylkoenzym A . Sedan omvandlas lysofosfatidat till fosfatidat via tillsats av en annan fettsyrakedja som bidrar med en andra acyl-CoA; alla dessa steg katalyseras av enzymet glycerolfosfatacyltransferas . Fosfolipidsyntes fortsätter i det endoplasmatiska retikulumet, och biosyntesvägen divergerar beroende på komponenterna i den speciella fosfolipiden.
Sfingolipider
Liksom fosfolipider har dessa fettsyraderivat ett polärt huvud och opolära svansar. Till skillnad från fosfolipider har sfingolipider en sfingosinryggrad . Sfingolipider finns i eukaryota celler och är särskilt rikligt förekommande i det centrala nervsystemet . Till exempel är sfingomyelin en del av myelinskidan hos nervfibrer.
Sfingolipider bildas av ceramider som består av en fettsyrakedja fäst vid aminogruppen i en sfingosinryggrad. Dessa ceramider syntetiseras från acylering av sfingosin. Den biosyntetiska vägen för sfingosin finns nedan:
Som bilden anger, under sfingosinsyntes, genomgår palmitoyl CoA och serin en kondensationsreaktion som resulterar i bildandet av dehydrosfingosin. Denna produkt reduceras sedan för att bilda dihydrospingosin, som omvandlas till sfingosin via oxidationsreaktionen av FAD .
Kolesterol
Denna lipid tillhör en klass av molekyler som kallas steroler . Steroler har fyra sammansmälta ringar och en hydroxylgrupp . Kolesterol är en särskilt viktig molekyl. Det fungerar inte bara som en komponent i lipidmembran, det är också en föregångare till flera steroidhormoner , inklusive kortisol , testosteron och östrogen .
Kolesterol syntetiseras från acetyl CoA . Vägen visas nedan:
Mer generellt sker denna syntes i tre steg, där det första steget äger rum i cytoplasman och det andra och tredje steget sker i det endoplasmatiska retikulumet. Etapperna är som följer:
- 1. Syntesen av isopentenylpyrofosfat , "byggstenen" av kolesterol
- 2. Bildandet av skvalen genom kondensation av sex molekyler isopentenylfosfat
- 3. Omvandlingen av skvalen till kolesterol via flera enzymatiska reaktioner
Nukleotider
Biosyntesen av nukleotider involverar enzymkatalyserade reaktioner som omvandlar substrat till mer komplexa produkter. Nukleotider är byggstenarna i DNA och RNA . Nukleotider är sammansatta av en femledad ring bildad av ribossocker i RNA och deoxiribossocker i DNA; dessa sockerarter är kopplade till en purin- eller pyrimidinbas med en glykosidbindning och en fosfatgrupp vid sockrets 5'-position .
Purin nukleotider
DNA-nukleotiderna adenosin och guanosin består av en purinbas fäst till ett ribossocker med en glykosidbindning. När det gäller RNA-nukleotider deoxyadenosin och deoxyguanosin , är purinbaserna fästa till ett deoxiribossocker med en glykosidbindning. Purinbaserna på DNA- och RNA-nukleotider syntetiseras i en tolvstegsreaktionsmekanism som finns i de flesta encelliga organismer. Högre eukaryoter använder en liknande reaktionsmekanism i tio reaktionssteg. Purinbaser syntetiseras genom att omvandla fosforibosylpyrofosfat (PRPP) till inosinmonofosfat (IMP), som är den första nyckelmellanprodukten i purinbasbiosyntesen. Ytterligare enzymatisk modifiering av IMP producerar nukleotidernas adenosin- och guanosinbaser.
- Det första steget i purinbiosyntes är en kondensationsreaktion , utförd av glutamin-PRPP amidotransferas . Detta enzym överför aminogruppen från glutamin till PRPP och bildar 5-fosforibosylamin . Följande steg kräver aktivering av glycin genom tillsats av en fosfatgrupp från ATP .
- GAR-syntetas utför kondensationen av aktiverat glycin till PRPP och bildar glycinamidribonukleotid (GAR).
- GAR-transformylas lägger till en formylgrupp till aminogruppen i GAR och bildar formylglycinamidribonukleotid (FGAR).
- FGAR-amidotransferas katalyserar tillägget av en kvävegrupp till FGAR och bildar formylglycinamidinribonukleotid (FGAM).
- FGAM-cyklas katalyserar ringslutning, vilket involverar avlägsnande av en vattenmolekyl, vilket bildar den 5-ledade imidazolringen 5-aminoimidazolribonukleotid ( AIR).
- N5-CAIR-syntetas överför en karboxylgrupp och bildar den mellanliggande N5-karboxiaminoimidazolribonukleotiden (N5-CAIR).
- N5-CAIR-mutas omarrangerar den funktionella karboxylgruppen och överför den till imidazolringen och bildar karboxiamino-imidazolribonukleotid (CAIR). Tvåstegsmekanismen för CAIR-bildning från AIR finns mestadels i encelliga organismer. Högre eukaryoter innehåller enzymet AIR-karboxylas, som överför en karboxylgrupp direkt till AIR-imidazolringen och bildar CAIR.
- SAICAR-syntetas bildar en peptidbindning mellan aspartat och den tillsatta karboxylgruppen i imidazolringen och bildar N-succinyl-5-aminoimidazol-4-karboxamidribonukleotid (SAICAR).
- SAICAR-lyas tar bort kolskelettet från det tillsatta aspartatet, lämnar aminogruppen och bildar 5-aminoimidazol-4-karboxamidribonukleotid (AICAR).
- AICAR-transformylas överför en karbonylgrupp till AICAR och bildar N-formylaminoimidazol-4-karboxamidribonukleotid (FAICAR).
- Det sista steget involverar enzymet IMP-syntas , som utför purinringen och bildar inosinmonofosfatmellanprodukten.
Pyrimidinnukleotider
Andra DNA- och RNA-nukleotidbaser som är kopplade till ribossockret via en glykosidbindning är tymin , cytosin och uracil (som bara finns i RNA). Uridinmonofosfatbiosyntes involverar ett enzym som finns i mitokondriernas inre membran och multifunktionella enzymer som finns i cytosolen .
- Det första steget involverar enzymet karbamoylfosfatsyntas som kombinerar glutamin med CO 2 i en ATP-beroende reaktion för att bilda karbamoylfosfat .
- Aspartatkarbamoyltransferas kondenserar karbamoylfosfat med aspartat för att bilda uridosuccinat.
- Dihydroorotas utför ringslutning , en reaktion som förlorar vatten, för att bilda dihydroorotat .
- Dihydroorotatdehydrogenas , beläget inom mitokondriernas inre membran, oxiderar dihydroorotat till orotat .
- Orotat-fosforibosylhydrolas (OMP-pyrofosforylas) kondenserar orotat med PRPP för att bilda orotidin-5'-fosfat .
- OMP-dekarboxylas katalyserar omvandlingen av orotidin-5'-fosfat till UMP .
Efter att uridinnukleotidbasen syntetiseras, syntetiseras de andra baserna, cytosin och tymin. Cytosinbiosyntes är en tvåstegsreaktion som involverar omvandling av UMP till UTP . Fosfattillsats till UMP katalyseras av ett kinasenzym . Enzymet CTP-syntas katalyserar nästa reaktionssteg: omvandlingen av UTP till CTP genom att överföra en aminogrupp från glutamin till uridin; detta bildar cytosinbasen i CTP. Mekanismen, som skildrar reaktionen UTP + ATP + glutamin ⇔ CTP + ADP + glutamat, är nedan:
Cytosin är en nukleotid som finns i både DNA och RNA. Uracil finns dock bara i RNA. Därför, efter att UTP har syntetiserats, måste det omvandlas till en deoxiform för att inkorporeras i DNA. Denna omvandling involverar enzymet ribonukleosidtrifosfatreduktas . Denna reaktion som tar bort 2'-OH från ribossockret för att generera deoxiribos påverkas inte av baserna fästa vid sockret. Denna icke-specificitet tillåter ribonukleosidtrifosfatreduktas att omvandla alla nukleotidtrifosfater till deoxiribonukleotider med en liknande mekanism.
Till skillnad från uracil finns tyminbaser mestadels i DNA, inte RNA. Celler innehåller normalt inte tyminbaser som är kopplade till ribossocker i RNA, vilket indikerar att celler endast syntetiserar deoxiribos-kopplad tymin. Enzymet tymidylatsyntetas är ansvarigt för att syntetisera tyminrester från dUMP till dTMP . Denna reaktion överför en metylgrupp till uracilbasen av dUMP för att generera dTMP. Tymidylatsyntasreaktionen, dUMP + 5,10-metylentetrahydrofolat ⇔ dTMP + dihydrofolat, visas till höger.
DNA
Även om det finns skillnader mellan eukaryot och prokaryotisk DNA-syntes, betecknar följande avsnitt nyckelegenskaper för DNA-replikation som delas av båda organismerna.
DNA består av nukleotider som är sammanfogade av fosfodiesterbindningar . DNA-syntes , som äger rum i kärnan , är en semikonservativ process, vilket innebär att den resulterande DNA-molekylen innehåller en ursprunglig sträng från moderstrukturen och en ny sträng. DNA-syntes katalyseras av en familj av DNA-polymeraser som kräver fyra deoxinukleosidtrifosfater, en mallsträng och en primer med en fri 3'OH för att införliva nukleotider.
För att DNA-replikation ska ske skapas en replikationsgaffel av enzymer som kallas helikaser som lindar upp DNA-helixen. Topoisomeraser vid replikationsgaffeln tar bort supercoils orsakade av DNA-avveckling, och enkelsträngade DNA-bindande proteiner bibehåller de två enkelsträngade DNA-mallarna stabiliserade före replikering.
DNA-syntes initieras av RNA-polymeras primas , som gör en RNA-primer med en fri 3'OH. Denna primer är fäst vid den enkelsträngade DNA-mallen och DNA-polymeras förlänger kedjan genom att införliva nukleotider; DNA-polymeras korrekturläser också den nysyntetiserade DNA-strängen.
Under polymerisationsreaktionen katalyserad av DNA-polymeras inträffar en nukleofil attack av 3'OH i den växande kedjan på den innersta fosforatomen i ett deoxinukleosidtrifosfat; detta ger bildandet av en fosfodiesterbrygga som fäster en ny nukleotid och frigör pyrofosfat .
Två typer av strängar skapas samtidigt under replikering: den ledande strängen , som syntetiseras kontinuerligt och växer mot replikationsgaffeln, och den eftersläpande strängen , som görs diskontinuerligt i Okazaki-fragment och växer bort från replikationsgaffeln. Okazaki-fragment är kovalent sammanfogade av DNA-ligas för att bilda en kontinuerlig sträng. Sedan, för att fullborda DNA-replikationen, avlägsnas RNA-primrar, och de resulterande luckorna ersätts med DNA och sammanfogas via DNA-ligas.
Aminosyror
Ett protein är en polymer som är sammansatt av aminosyror som är sammanlänkade med peptidbindningar . Det finns mer än 300 aminosyror i naturen, varav endast tjugo, kända som standardaminosyrorna , är byggstenarna för protein. Endast gröna växter och de flesta mikrober kan syntetisera alla de 20 standardaminosyrorna som behövs av alla levande arter. Däggdjur kan bara syntetisera tio av de tjugo standardaminosyrorna. De andra aminosyrorna, valin , metionin , leucin , isoleucin , fenylalanin , lysin , treonin och tryptofan för vuxna och histidin och arginin för spädbarn erhålls genom kosten.
Aminosyras grundstruktur
Den allmänna strukturen för standardaminosyrorna inkluderar en primär aminogrupp , en karboxylgrupp och den funktionella gruppen bunden till a-kolet . De olika aminosyrorna identifieras av den funktionella gruppen. Som ett resultat av de tre olika grupperna kopplade till α-kolet är aminosyror asymmetriska molekyler . För alla standardaminosyror, utom glycin , är α-kolet ett kiralt centrum . När det gäller glycin har α-kolet två väteatomer, vilket tillför symmetri till denna molekyl. Med undantag för prolin har alla aminosyror som finns i livet L-isoform- konformationen. Prolin har en funktionell grupp på α-kolet som bildar en ring med aminogruppen.
Kvävekälla
Ett stort steg i aminosyrabiosyntesen involverar inkorporering av en kvävegrupp på a-kolet. I celler finns det två huvudvägar för inkorporering av kvävegrupper. En väg involverar enzymet glutaminoxoglutarataminotransferas (GOGAT) som tar bort amidaminogruppen av glutamin och överför den till 2-oxoglutarat , vilket producerar två glutamatmolekyler . I denna katalysreaktion fungerar glutamin som kvävekälla. En bild som illustrerar denna reaktion finns till höger.
Den andra vägen för att införliva kväve på aminosyrornas a-kol involverar enzymet glutamatdehydrogenas (GDH). GDH kan överföra ammoniak till 2-oxoglutarat och bilda glutamat. Dessutom kan enzymet glutaminsyntetas (GS) överföra ammoniak till glutamat och syntetisera glutamin, vilket fyller på glutamin.
Glutamatfamiljen av aminosyror
Glutamatfamiljen av aminosyror inkluderar de aminosyror som härrör från aminosyran glutamat . Denna familj inkluderar: glutamat, glutamin , prolin och arginin . Denna familj inkluderar även aminosyran lysin , som härrör från α-ketoglutarat .
Biosyntesen av glutamat och glutamin är ett nyckelsteg i kväveassimileringen som diskuterats ovan. Enzymerna GOGAT och GDH katalyserar kväveassimileringsreaktionerna .
Hos bakterier initierar enzymet glutamat 5-kinas biosyntesen av prolin genom att överföra en fosfatgrupp från ATP till glutamat. Nästa reaktion katalyseras av enzymet pyrrolin-5-karboxylatsyntas (P5CS), som katalyserar reduktionen av ϒ-karboxylgruppen i L-glutamat-5-fosfat. Detta resulterar i bildandet av glutamatsemialdehyd, som spontant cykliserar till pyrrolin-5-karboxylat. Pyrrolin-5-karboxylat reduceras ytterligare av enzymet pyrrolin-5-karboxylatreduktas (P5CR) för att ge en prolinaminosyra.
I det första steget av argininbiosyntes i bakterier acetyleras glutamat genom att överföra acetylgruppen från acetyl-CoA i N-a-positionen; detta förhindrar spontan cyklisering. Enzymet N-acetylglutamatsyntas (glutamat N-acetyltransferas) är ansvarigt för att katalysera acetyleringssteget. Efterföljande steg katalyseras av enzymerna N-acetylglutamatkinas , N-acetyl-gamma-glutamyl-fosfatreduktas och acetylornitin/succinyldiaminopimelataminotransferas och ger N-acetyl-L-ornitin. Acetylgruppen i acetylornitin avlägsnas av enzymet acetylornitinas (AO) eller ornitinacetyltransferas (OAT), och detta ger ornitin . Sedan omvandlar enzymerna citrullin och argininosuccinat ornitin till arginin.
Det finns två distinkta lysinbiosyntesvägar: diaminopimelinsyravägen och α-aminoadipatvägen . Den vanligaste av de två syntetiska vägarna är diaminopimelinsyravägen; den består av flera enzymatiska reaktioner som lägger till kolgrupper till aspartat för att ge lysin:
- Aspartatkinas initierar diaminopimelinsyravägen genom att fosforylera aspartat och producera aspartylfosfat.
- Aspartat semialdehyddehydrogenas katalyserar den NADPH -beroende reduktionen av aspartylfosfat för att ge aspartat semialdehyd.
- 4-hydroxi-tetrahydrodipicolinatsyntas lägger till en pyruvatgrupp till β-aspartyl-4-semialdehyden och en vattenmolekyl avlägsnas. Detta orsakar cyklisering och ger upphov till (2S,4S)-4-hydroxi-2,3,4,5-tetrahydrodipicolinat.
- 4-hydroxi-tetrahydrodipicolinate reduktas katalyserar reduktionen av (2S,4S)-4-hydroxi-2,3,4,5-tetrahydrodipicolinate av NADPH för att ge Δ'-piperidein-2,6-dikarboxylat (2,3,4, 5-tetrahydrodipicolinat) och H2O .
- Tetrahydrodipicolinate acyltransferas katalyserar acetyleringsreaktionen som resulterar i ringöppning och ger N-acetyl α-amino-ε-ketopimelat.
- N-succinyl-a-amino-e-ketopimelat-glutamat-aminotransaminas katalyserar transamineringsreaktionen som tar bort ketogruppen av N-acetyl-a-amino-e-ketopimelat och ersätter den med en aminogrupp för att ge N-succinyl-L-diaminopimelat .
- N-acyldiaminopimelatdeacylas katalyserar deacyleringen av N-succinyl-L-diaminopimelat för att ge L,L-diaminopimelat.
- DAP-epimeras katalyserar omvandlingen av L,L-diaminopimelat till mesoformen av L,L-diaminopimelat.
- DAP-dekarboxylas katalyserar avlägsnandet av karboxylgruppen, vilket ger L-lysin.
Serinfamiljen av aminosyror
Aminosyrafamiljen serin inkluderar: serin, cystein och glycin . De flesta mikroorganismer och växter får svavel för att syntetisera metionin från aminosyran cystein. Vidare ger omvandlingen av serin till glycin de kol som behövs för biosyntesen av metionin och histidin .
Under serinbiosyntesen katalyserar enzymet fosfoglyceratdehydrogenas den initiala reaktionen som oxiderar 3-fosfo-D-glycerat för att ge 3-fosfonooxipyruvat . Följande reaktion katalyseras av enzymet fosfoserinaminotransferas , som överför en aminogrupp från glutamat till 3-fosfonooxipyruvat för att ge L-fosfoserin . Det sista steget katalyseras av enzymet fosfoserinfosfatas , som defosforylerar L-fosfoserin för att ge L-serin .
Det finns två kända vägar för biosyntesen av glycin. Organismer som använder etanol och acetat som den huvudsakliga kolkällan använder den glykonogena vägen för att syntetisera glycin . Den andra vägen för glycinbiosyntes är känd som den glykolytiska vägen. Denna väg omvandlar serin syntetiserat från mellanprodukterna av glykolys till glycin. I den glykolytiska vägen katalyserar enzymet serinhydroximetyltransferas klyvningen av serin för att ge glycin och överför den klyvda kolgruppen i serin till tetrahydrofolat och bildar 5,10-metylentetrahydrofolat .
Cysteinbiosyntes är en tvåstegsreaktion som involverar inkorporering av oorganiskt svavel . I mikroorganismer och växter katalyserar enzymet serinacetyltransferas överföringen av acetylgrupp från acetyl-CoA till L-serin för att ge O-acetyl-L-serin . Följande reaktionssteg, katalyserat av enzymet O-acetylserin(tiol)lyas , ersätter acetylgruppen i O-acetyl-L-serin med sulfid för att ge cystein.
Aspartatfamiljen av aminosyror
Aspartatfamiljen av aminosyror inkluderar: treonin , lysin , metionin , isoleucin och aspartat . Lysin och isoleucin anses vara en del av aspartatfamiljen även om en del av deras kolskelett härrör från pyruvat . När det gäller metionin kommer metylkolet från serin och svavelgruppen, men i de flesta organismer är det härlett från cystein.
Biosyntesen av aspartat är en enstegsreaktion som katalyseras av ett enda enzym. Enzymet aspartataminotransferas katalyserar överföringen av en aminogrupp från aspartat till α-ketoglutarat för att ge glutamat och oxaloacetat . Asparagin syntetiseras genom en ATP-beroende addition av en aminogrupp på aspartat; asparaginsyntetas katalyserar tillsatsen av kväve från glutamin eller löslig ammoniak till aspartat för att ge asparagin.
Den diaminopimelinsyrabiosyntetiska vägen för lysin tillhör aspartatfamiljen av aminosyror. Denna väg involverar nio enzymkatalyserade reaktioner som omvandlar aspartat till lysin.
- Aspartatkinas katalyserar det initiala steget i diaminopimelinsyravägen genom att överföra en fosforyl från ATP till karboxylatgruppen av aspartat, vilket ger aspartyl-β-fosfat.
- Aspartat-semialdehyddehydrogenas katalyserar reduktionsreaktionen genom defosforylering av aspartyl-β-fosfat för att ge aspartat-β-semialdehyd.
- Dihydrodipicolinate syntas katalyserar kondensationsreaktionen av aspartat-β-semialdehyd med pyruvat för att ge dihydrodipicolinic syra.
- 4-hydroxi-tetrahydrodipicolinate reduktas katalyserar reduktionen av dihydrodipicolinic syra för att ge tetrahydrodipicolinic syra.
- Tetrahydrodipicolinate N-succinyltransferas katalyserar överföringen av en succinylgrupp från succinyl-CoA till tetrahydrodipicolinic syra för att ge N-succinyl-L-2,6-diaminoheptandioat.
- N-succinyldiaminopimelataminotransferas katalyserar överföringen av en aminogrupp från glutamat till N-succinyl-L-2,6-diaminoheptandioat för att ge N-succinyl-L,L-diaminopimelinsyra.
- Succinyl-diaminopimelat desuccinylas katalyserar avlägsnandet av acylgruppen från N-succinyl-L,L-diaminopimelinsyra för att ge L,L-diaminopimelinsyra.
- Diaminopimelat-epimeras katalyserar inversionen av α-kolet i L,L-diaminopimelinsyra för att ge meso-diaminopimelinsyra .
- Siaminopimelatdekarboxylas katalyserar det sista steget i lysinbiosyntesen som tar bort koldioxidgruppen från meso-diaminopimelinsyra för att ge L-lysin.
Proteiner
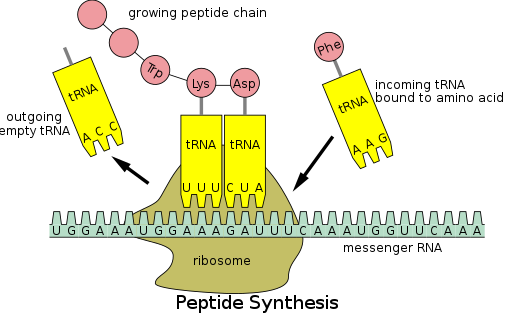
Proteinsyntes sker via en process som kallas translation . Under translation läses genetiskt material som kallas mRNA av ribosomer för att generera en proteinpolypeptidkedja . Denna process kräver överförings-RNA (tRNA) som fungerar som en adapter genom att binda aminosyror i ena änden och interagera med mRNA i den andra änden; den senare parningen mellan tRNA och mRNA säkerställer att rätt aminosyra läggs till kedjan. Proteinsyntes sker i tre faser: initiering, förlängning och avslutning. Prokaryot ( arkeal och bakteriell ) translation skiljer sig från eukaryot translation ; detta avsnitt kommer dock mestadels att fokusera på gemensamma drag mellan de två organismerna.
Ytterligare bakgrund
Innan translation kan påbörjas måste processen att binda en specifik aminosyra till dess motsvarande tRNA inträffa. Denna reaktion, som kallas tRNA-laddning, katalyseras av aminoacyl-tRNA-syntetas . Ett specifikt tRNA-syntetas är ansvarigt för att känna igen och ladda en viss aminosyra. Dessutom har detta enzym speciella diskriminatorregioner för att säkerställa korrekt bindning mellan tRNA och dess besläktade aminosyra. Det första steget för att förena en aminosyra till dess motsvarande tRNA är bildandet av aminoacyl-AMP:
Detta följs av överföringen av aminoacylgruppen från aminoacyl-AMP till en tRNA-molekyl. Den resulterande molekylen är aminoacyl-tRNA :
Kombinationen av dessa två steg, som båda katalyseras av aminoacyl-tRNA-syntetas, producerar ett laddat tRNA som är redo att lägga till aminosyror till den växande polypeptidkedjan.
Förutom att binda en aminosyra har tRNA en tre nukleotiderenhet som kallas ett antikodon som baspar med specifika nukleotidtripletter på det mRNA som kallas kodon ; kodon kodar för en specifik aminosyra. Denna interaktion är möjlig tack vare ribosomen, som fungerar som platsen för proteinsyntes. Ribosomen har tre tRNA-bindningsställen: aminoacylstället (A-stället), peptidylstället (P-stället) och utgångsstället (E-stället).
Det finns många kodon i ett mRNA-transkript, och det är mycket vanligt att en aminosyra specificeras av mer än ett kodon; detta fenomen kallas degeneration . Totalt finns det 64 kodon, 61 av varje kodar för en av de 20 aminosyrorna, medan de återstående kodonen anger kedjeavslutning.
Översättning i steg
Som tidigare nämnts sker translation i tre faser: initiering, förlängning och avslutning.
Steg 1: Initiering
Slutförandet av initieringsfasen är beroende av följande tre händelser:
1. Rekryteringen av ribosomen till mRNA
2. Bindningen av ett laddat initiator-tRNA till P-stället i ribosomen
3. Rätt inriktning av ribosomen med mRNA:s startkodon
Steg 2: Förlängning
Efter initiering förlängs polypeptidkedjan via antikodon:kodon-interaktioner, där ribosomen lägger till aminosyror till polypeptidkedjan en i taget. Följande steg måste utföras för att säkerställa korrekt tillsats av aminosyror:
1. Bindningen av rätt tRNA till A-stället i ribosomen
2. Bildandet av en peptidbindning mellan tRNA:t i A-stället och polypeptidkedjan fäst till tRNA:t i P-stället
3. Translokation eller avancemang av tRNA-mRNA-komplexet med tre nukleotider
Translokation "startar" tRNA vid E-stället och flyttar tRNA från A-stället till P-stället, vilket lämnar A-stället fritt för ett inkommande tRNA för att lägga till ytterligare en aminosyra.
Steg 3: Uppsägning
Det sista steget av translation inträffar när ett stoppkodon kommer in i A-stället. Sedan sker följande steg:
1. Igenkännandet av kodoner genom frisättningsfaktorer , vilket orsakar hydrolys av polypeptidkedjan från tRNA:t i P-stället
2. Frisättningen av polypeptidkedjan
3. Dissociationen och "återvinningen" av ribosomen för framtida översättningsprocesser
En sammanfattningstabell över nyckelaktörerna inom översättning finns nedan:
| Nyckelspelare inom översättning | Översättningsstadiet | Ändamål |
|---|---|---|
| tRNA-syntetas | före initiering | Ansvarig för tRNA-laddning |
| mRNA | initiering, förlängning, avslutning | Mall för proteinsyntes; innehåller regioner med namnet kodon som kodar för aminosyror |
| tRNA | initiering, förlängning, avslutning | Binder ribosomställen A, P, E; antikodonbaspar med mRNA-kodon för att säkerställa att rätt aminosyra införlivas i den växande polypeptidkedjan |
| ribosom | initiering, förlängning, avslutning | Styr proteinsyntesen och katalyserar bildningen av peptidbindningen |
Sjukdomar associerade med makromolekylbrist
Fel i biosyntesvägar kan ha skadliga konsekvenser inklusive missbildning av makromolekyler eller underproduktion av funktionella molekyler. Nedan finns exempel som illustrerar de störningar som uppstår på grund av dessa ineffektiviteter.
- Familjär hyperkolesterolemi : denna störning kännetecknas av frånvaron av funktionella receptorer för LDL . Brister i bildandet av LDL-receptorer kan orsaka felaktiga receptorer som stör den endocytiska vägen, vilket hämmar inträdet av LDL i levern och andra celler. Detta orsakar en uppbyggnad av LDL i blodplasman, vilket resulterar i aterosklerotiska plack som smalnar av artärerna och ökar risken för hjärtinfarkt.
- Lesch-Nyhans syndrom : denna genetiska sjukdom kännetecknas av självstympning , mental brist och gikt . Det orsakas av frånvaron av hypoxantin-guanin-fosforibosyltransferas , som är ett nödvändigt enzym för bildning av purinnukleotid. Bristen på enzym minskar nivån av nödvändiga nukleotider och orsakar ackumulering av biosyntesintermediärer , vilket resulterar i det ovannämnda ovanliga beteendet.
- Svår kombinerad immunbrist (SCID) : SCID kännetecknas av förlust av T-celler . Brist på dessa immunsystemkomponenter ökar känsligheten för smittämnen eftersom de drabbade individerna inte kan utveckla immunologiskt minne . Denna immunologiska störning beror på en brist i adenosindeanimasaktivitet , vilket orsakar en uppbyggnad av dATP . Dessa dATP-molekyler hämmar sedan ribonukleotidreduktas, vilket förhindrar DNA-syntes.
- Huntingtons sjukdom : denna neurologiska sjukdom orsakas av fel som uppstår under DNA-syntes. Dessa fel eller mutationer leder till uttrycket av ett mutant huntingtinprotein , som innehåller repetitiva glutaminrester som kodas av expanderande CAG-trinukleotidupprepningar i genen. Huntingtons sjukdom kännetecknas av neuronal förlust och glios . Symtom på sjukdomen inkluderar: rörelsestörning, kognitiv försämring och beteendestörning.
Se även
- Lipider
- Fosfolipid tvåskiktsmembran
- Nukleotider
- DNA
- DNA-replikation
- Proteinogen aminosyra
- Kodonbord
- Prostaglandin
- Porfyriner
- Klorofyller och bakterioklorofyller
- Vitamin B 12

![{\displaystyle {\ce {Reaktant ->[][enzym] Produkt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d97fbef58f64fb0b7d05d90fa0a73b05f5919fc8)

![{\displaystyle {\ce {{Prekursor~molekyl}+Kofaktor->[][enzym]makromolekyl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b192f25eec9ceebed179bfeb43ae27795f3a91be)