Neurotoxin -Neurotoxin

Neurotoxiner är toxiner som är destruktiva för nervvävnad (orsakar neurotoxicitet ). Neurotoxiner är en omfattande klass av exogena kemiska neurologiska förolämpningar som negativt kan påverka funktionen i både utvecklande och mogen nervvävnad. Termen kan också användas för att klassificera endogena föreningar, som vid onormal kontakt kan visa sig neurologiskt toxiska. Även om neurotoxiner ofta är neurologiskt destruktiva, är deras förmåga att specifikt rikta in sig på neurala komponenter viktig i studiet av nervsystem. Vanliga exempel på neurotoxiner inkluderar bly , etanol (dricker alkohol), glutamat , kväveoxid , botulinumtoxin (t.ex. Botox), stelkrampstoxin och tetrodotoxin . Vissa ämnen som kväveoxid och glutamat är i själva verket nödvändiga för att kroppen ska fungera korrekt och utövar endast neurotoxiska effekter vid för höga koncentrationer.
Neurotoxiner hämmar neuronkontroll över jonkoncentrationer över cellmembranet , eller kommunikation mellan neuroner över en synaps . Lokal patologi för neurotoxinexponering inkluderar ofta neuronexcitotoxikitet eller apoptos men kan också inkludera gliacellskada . Makroskopiska manifestationer av neurotoxinexponering kan inkludera utbredda skador på centrala nervsystemet såsom intellektuell funktionsnedsättning , ihållande minnesstörningar , epilepsi och demens . Dessutom är neurotoxin-medierad skada på det perifera nervsystemet såsom neuropati eller myopati vanligt. Stöd har visats för ett antal behandlingar som syftar till att dämpa neurotoxinförmedlad skada, såsom administrering av antioxidanter och antitoxin .
Bakgrund
Exponering för neurotoxiner i samhället är inte ny, eftersom civilisationer har varit utsatta för neurologiskt destruktiva föreningar i tusentals år. Ett anmärkningsvärt exempel är den möjliga betydande blyexponeringen under det romerska imperiet till följd av utvecklingen av omfattande VVS-nätverk och vanan att koka vin med vin i blypannor för att söta det, processen som genererar blyacetat, känt som "blysocker". Delvis har neurotoxiner varit en del av mänsklighetens historia på grund av nervsystemets bräckliga och mottagliga natur, vilket gör det mycket benäget att störas.
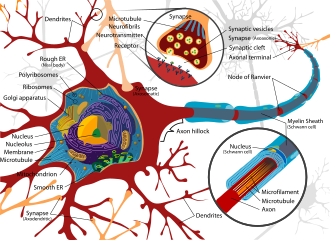
Den nervvävnad som finns i hjärnan , ryggmärgen och periferin består av ett utomordentligt komplext biologiskt system som till stor del definierar många av de unika egenskaperna hos individer. Som med alla mycket komplexa system kan dock även små störningar i dess omgivning leda till betydande funktionsstörningar. Egenskaper som leder till mottaglighet för nervvävnad inkluderar en stor yta av neuroner, ett högt lipidinnehåll som håller kvar lipofila toxiner, högt blodflöde till hjärnan som inducerar ökad effektiv exponering för toxiner och nervcellers persistens under en individs livstid, vilket leder till kompoundering av skadestånd. Som ett resultat har nervsystemet ett antal mekanismer utformade för att skydda det från inre och yttre angrepp, inklusive blod-hjärnbarriären.
Blod -hjärnbarriären (BBB) är ett kritiskt exempel på skydd som förhindrar toxiner och andra skadliga föreningar från att nå hjärnan. Eftersom hjärnan kräver näringstillförsel och avlägsnande av avfall, genomsyras den av blodflödet. Blod kan emellertid bära ett antal intagna toxiner, vilket skulle inducera betydande neurondöd om de når nervvävnad. Således omger skyddsceller som kallas astrocyter kapillärerna i hjärnan och absorberar näringsämnen från blodet och transporterar dem sedan till neuronerna, vilket effektivt isolerar hjärnan från ett antal potentiella kemiska förolämpningar.
Denna barriär skapar ett tätt hydrofobt lager runt kapillärerna i hjärnan, vilket hämmar transporten av stora eller hydrofila föreningar. Förutom BBB, ger plexus åderhinna ett lager av skydd mot toxinabsorption i hjärnan. Årehinneplexus är vaskulariserade lager av vävnad som finns i hjärnans tredje, fjärde och laterala ventriklar , som genom funktionen av sina ependymala celler är ansvariga för syntesen av cerebrospinalvätska (CSF). Viktigt, genom selektiv passage av joner och näringsämnen och fånga tungmetaller som bly, upprätthåller åderhinnaplexusen en strikt reglerad miljö som innehåller hjärnan och ryggmärgen.
Genom att vara hydrofob och liten, eller hämma astrocytfunktionen, kan vissa föreningar inklusive vissa neurotoxiner tränga in i hjärnan och orsaka betydande skada. I modern tid har forskare och läkare ställts inför utmaningen att identifiera och behandla neurotoxiner, vilket har resulterat i ett växande intresse för både neurotoxikologisk forskning och kliniska studier. Även om klinisk neurotoxikologi till stor del är ett växande område, har omfattande inbrytningar gjorts i identifieringen av många neurotoxiner i miljön, vilket leder till klassificeringen av 750 till 1000 kända potentiellt neurotoxiska föreningar. På grund av den kritiska vikten av att hitta neurotoxiner i vanliga miljöer har specifika protokoll utvecklats av United States Environmental Protection Agency (EPA) för att testa och bestämma neurotoxiska effekter av föreningar (USEPA 1998). Dessutom har in vitro- system ökat i användning eftersom de ger betydande förbättringar jämfört med tidigare vanligare in vivo- system. Exempel på förbättringar inkluderar hanteringsbara, enhetliga miljöer och eliminering av kontaminerande effekter av systemisk metabolism. In vitro-system har emellertid presenterat problem eftersom det har varit svårt att korrekt replikera nervsystemets komplexitet, såsom interaktionerna mellan stödjande astrocyter och neuroner för att skapa BBB. För att ytterligare komplicera processen att bestämma neurotoxiner vid testning in vitro, kan neurotoxicitet och cytotoxicitet vara svåra att särskilja eftersom att exponera neuroner direkt för föreningar kanske inte är möjligt in vivo, eftersom det är in vitro. Dessutom kan det hända att cellers svar på kemikalier inte exakt förmedlar en distinktion mellan neurotoxiner och cytotoxiner, eftersom symtom som oxidativ stress eller skelettförändringar kan uppstå som svar på båda.
I ett försök att ta itu med denna komplikation har neuritutväxter (antingen axonala eller dendritiska) som svar på applicerade föreningar nyligen föreslagits som en mer exakt distinktion mellan verkliga neurotoxiner och cytotoxiner i en in vitro-testmiljö. På grund av de betydande felaktigheter som är förknippade med denna process har det dock gått långsamt att få ett brett stöd. Dessutom har biokemiska mekanismer blivit mer allmänt använda i neurotoxintestning, så att föreningar kan screenas för tillräcklighet för att inducera cellmekanisminterferens, såsom hämning av acetylkolinesteraskapacitet hos organofosfater ( inkluderar DDT och saringas ). Även om metoder för att bestämma neurotoxicitet fortfarande kräver betydande utveckling, har identifieringen av skadliga föreningar och toxinexponeringssymptom genomgått betydande förbättringar.
Tillämpningar inom neurovetenskap
Även om de är olika i kemiska egenskaper och funktioner, delar neurotoxiner den gemensamma egenskapen att de verkar genom någon mekanism som leder till antingen störning eller förstörelse av nödvändiga komponenter i nervsystemet . Neurotoxiner kan dock genom själva designen vara mycket användbara inom området neurovetenskap . Eftersom nervsystemet i de flesta organismer är både mycket komplext och nödvändigt för att överleva, har det naturligt blivit ett mål för attacker av både rovdjur och bytesdjur. Eftersom giftiga organismer ofta använder sina neurotoxiner för att underkuva ett rovdjur eller ett byte mycket snabbt, har toxiner utvecklats till att bli mycket specifika för sina målkanaler så att toxinet inte lätt binder andra mål (se Jonkanaltoxiner ) . Som sådana ger neurotoxiner ett effektivt sätt genom vilket vissa delar av nervsystemet kan målinriktas exakt och effektivt. Ett tidigt exempel på neurotoxinbaserad målsökning använde radiomärkt tetrodotoxin för att analysera natriumkanaler och få exakta mätningar av deras koncentration längs nervmembran . På samma sätt genom isolering av vissa kanalaktiviteter har neurotoxiner gett förmågan att förbättra den ursprungliga Hodgkin-Huxley-modellen av neuronen där det var teoretiskt att enskilda generiska natrium- och kaliumkanaler kunde stå för de flesta nervvävnadsfunktioner. Från denna grundläggande förståelse har användningen av vanliga föreningar som tetrodotoxin, tetraetylammonium och bungarotoxiner lett till en mycket djupare förståelse av de distinkta sätten på vilka individuella neuroner kan bete sig.
Mekanismer för aktivitet
Eftersom neurotoxiner är föreningar som negativt påverkar nervsystemet, är ett antal mekanismer genom vilka de fungerar genom hämning av neuroncellulära processer. Dessa hämmade processer kan sträcka sig från membrandepolarisationsmekanismer till inter-neuronkommunikation . Genom att hämma neuronernas förmåga att utföra sina förväntade intracellulära funktioner, eller skicka en signal till en angränsande cell, kan neurotoxiner inducera systemisk nervsystemstopp som i fallet med botulinumtoxin , eller till och med nervvävnadsdöd. Den tid som krävs för uppkomsten av symtom vid neurotoxinexponering kan variera mellan olika toxiner, i storleksordningen timmar för botulinumtoxin och år för bly.
| Neurotoxinklassificering | Neurotoxiner |
|---|---|
| Na-kanalhämmare | Tetrodotoxin |
| K-kanalhämmare | Tetraetylammonium |
| Cl-kanalhämmare | Klorotoxin , |
| Ca-kanalhämmare | Conotoxin |
| Inhibitorer av synaptisk vesikelfrisättning | Botulinumtoxin , |
| Blod-hjärnbarriärhämmare | aluminium , |
| Receptorhämmare/antagonister | Bungarotoxin , |
| Receptoragonister |
Anatoxin-a ,
JWH-018 , |
| Cytoskelettinterferens | Ammoniak , |
| Ca-medierad cytotoxicitet | Leda |
| Flera effekter |
Etanol ,
N-hexan , |
| Receptorselektiva neurotoxiner | MPP + |
| Endogena neurotoxinkällor |
kväveoxid ,
Glutamat , |
Inhibitorer
Natriumkanal
Tetrodotoxin

Tetrodotoxin (TTX) är ett gift som produceras av organismer som tillhör Tetraodontiformes-ordningen , som inkluderar blåsfisken , havssolfisken och piggsvinsfisken . Inom pufferfisken finns TTX i levern , könskörtlarna , tarmarna och huden . TTX kan vara dödligt om det konsumeras och har blivit en vanlig form av förgiftning i många länder. Vanliga symtom på TTX-konsumtion inkluderar parestesi (ofta begränsad till mun och armar och ben ), muskelsvaghet, illamående och kräkningar och manifesteras ofta inom 30 minuter efter intag . Den primära mekanismen genom vilken TTX är giftigt är genom hämning av natriumkanalfunktionen, vilket minskar den funktionella kapaciteten hos neuronkommunikation. Denna hämning påverkar till stor del en känslig undergrupp av natriumkanaler som kallas TTX-känsliga (TTX-s), som också råkar vara till stor del ansvarig för natriumströmmen som driver depolariseringsfasen av neurons aktionspotentialer .
TTX-resistent (TTX-r) är en annan form av natriumkanal som har begränsad känslighet för TTX, och som till stor del finns i axoner med liten diameter, såsom de som finns i nociceptionsneuroner . När en betydande nivå av TTX intas, kommer det att binda natriumkanaler på neuroner och minska deras membranpermeabilitet för natrium. Detta resulterar i en ökad effektiv tröskel för nödvändiga excitatoriska signaler för att inducera en aktionspotential i en postsynaptisk neuron. Effekten av denna ökade signaltröskel är en minskad excitabilitet av postsynaptiska neuroner , och efterföljande förlust av motorisk och sensorisk funktion som kan resultera i förlamning och död. Även om assisterad ventilation kan öka chansen att överleva efter exponering för TTX, finns det för närvarande inget antitoxin. Användning av acetylkolinesterashämmaren Neostigmin eller den muskarina acetylkolinantagonisten atropin (som kommer att hämma parasympatisk aktivitet) kan dock öka den sympatiska nervaktiviteten tillräckligt för att förbättra chansen att överleva efter exponering för TTX.
Kaliumkanal
Tetraetylammonium
Tetraetylammonium (TEA) är en förening som, liksom ett antal neurotoxiner, först identifierades genom sina skadliga effekter på nervsystemet och visade sig ha förmågan att hämma funktionen hos motoriska nerver och därmed sammandragningen av muskulaturen på liknande sätt till curares. Dessutom, genom kronisk TEA-administrering, skulle muskelatrofi induceras. Det fastställdes senare att TEA fungerar in vivo främst genom dess förmåga att hämma både kaliumkanalerna som är ansvariga för den fördröjda likriktaren som ses i en aktionspotential och en viss population av kalciumberoende kaliumkanaler. Det är denna förmåga att hämma kaliumflödet i neuroner som har gjort TEA till ett av de viktigaste verktygen inom neurovetenskap. Det har antagits att förmågan för TEA att hämma kaliumkanaler härrör från dess liknande rymdfyllande struktur som kaliumjoner. Det som gör TEA mycket användbart för neuroforskare är dess specifika förmåga att eliminera kaliumkanalaktivitet, vilket gör det möjligt att studera neuronresponsbidrag från andra jonkanaler såsom spänningsstyrda natriumkanaler. Utöver dess många användningsområden inom neurovetenskaplig forskning har TEA visat sig fungera som en effektiv behandling av Parkinsons sjukdom genom sin förmåga att begränsa sjukdomens fortskridande.
Kloridkanal
Klorotoxin
Klorotoxin (Cltx) är den aktiva föreningen som finns i skorpiongift och är främst giftig på grund av dess förmåga att hämma konduktansen av kloridkanaler . Förtäring av dödliga volymer av Cltx resulterar i förlamning genom denna jonkanalstörning. I likhet med botulinumtoxin har Cltx visat sig ha ett betydande terapeutiskt värde. Bevis har visat att Cltx kan hämma förmågan för gliom att infiltrera frisk nervvävnad i hjärnan, vilket avsevärt minskar den potentiella invasiva skadan orsakad av tumörer.
Kalciumkanal
Conotoxin
Konotoxiner representerar en kategori av gifter som produceras av den marina konsnigeln och kan hämma aktiviteten hos ett antal jonkanaler såsom kalcium-, natrium- eller kaliumkanaler. I många fall inkluderar de toxiner som frigörs av de olika typerna av konsniglar en rad olika typer av konotoxiner, som kan vara specifika för olika jonkanaler, vilket skapar ett gift som kan avbryta nervfunktionen i många fall. En av de unika formerna av konotoxiner, ω-konotoxin ( ω-CgTx ) är mycket specifik för Ca-kanaler och har visat sig vara användbar för att isolera dem från ett system. Eftersom kalciumflöde är nödvändigt för korrekt excitabilitet hos en cell, kan varje signifikant hämning förhindra en stor mängd funktionalitet. Signifikant är att ω-CgTx kan binda till och hämma spänningsberoende kalciumkanaler i neuronernas membran men inte muskelcellerna.
Synaptisk vesikelfrisättning
Botulinumtoxin
Botulinumtoxin (BTX) är en grupp neurotoxiner som består av åtta distinkta föreningar, kallade BTX-A,B,C,D,E,F,G,H, som produceras av bakterien Clostridium botulinum och leder till muskelförlamning . En särskilt unik egenskap hos BTX är dess relativt vanliga terapeutiska användning vid behandling av dystoni och spasticitetsstörningar , samt för att inducera muskelatrofi trots att det är det mest giftiga ämnet som är känt. BTX fungerar perifert för att hämma frisättning av acetylkolin (ACh) vid den neuromuskulära förbindelsen genom nedbrytning av SNARE-proteinerna som krävs för ACh- vesikel-membranfusion . Eftersom toxinet är mycket biologiskt aktivt är en uppskattad dos på 1 μg/kg kroppsvikt tillräcklig för att inducera en otillräcklig tidalvolym och resulterande död genom kvävning . På grund av dess höga toxicitet har BTX-antitoxiner varit ett aktivt forskningsområde. Det har visats att capsaicin (aktiv förening ansvarig för värme i chilipeppar ) kan binda TRPV1-receptorn uttryckt på kolinerga neuroner och hämma de toxiska effekterna av BTX.
Tetanustoxin
Stelkrampsneurotoxin (TeNT) är en förening som funktionellt minskar hämmande överföringar i nervsystemet vilket resulterar i muskelstelkhet. TeNT liknar BTX och är i själva verket mycket lika i struktur och ursprung; båda tillhör samma kategori av klostridiala neurotoxiner . Liksom BTX hämmar TeNT kommunikationen mellan neuronerna genom frisättning av vesikulär neurotransmittor (NT). En anmärkningsvärd skillnad mellan de två föreningarna är att medan BTX hämmar muskelsammandragningar , inducerar TeNT dem. Även om båda toxinerna hämmar vesikelfrisättning vid neuronsynapser, är anledningen till denna olika manifestation att BTX huvudsakligen fungerar i det perifera nervsystemet (PNS) medan TeNT till stor del är aktivt i det centrala nervsystemet (CNS ) . Detta är ett resultat av TeNT-migrering genom motorneuroner till de hämmande neuronerna i ryggmärgen efter att ha kommit in genom endocytos . Detta resulterar i en förlust av funktion i hämmande neuroner i CNS vilket resulterar i systemiska muskelsammandragningar . I likhet med prognosen för en dödlig dos av BTX, leder TeNT till förlamning och efterföljande kvävning .
Blod-hjärnbarriär
Aluminium
Neurotoxiskt beteende hos aluminium är känt för att uppträda när det kommer in i cirkulationssystemet , där det kan migrera till hjärnan och hämma några av de avgörande funktionerna i blod-hjärnbarriären (BBB). En förlust av funktion i BBB kan orsaka betydande skador på nervcellerna i CNS, eftersom barriären som skyddar hjärnan från andra toxiner som finns i blodet inte längre kommer att kunna utföra sådan verkan. Även om metallen är känd för att vara neurotoxisk, är effekterna vanligtvis begränsade till patienter som inte kan ta bort överskott av joner från blodet, såsom de som lider av njursvikt . Patienter som upplever aluminiumtoxicitet kan uppvisa symtom som försämrad inlärning och nedsatt motorisk koordination . Dessutom är systemiska aluminiumnivåer kända för att öka med åldern och har visat sig korrelera med Alzheimers sjukdom , vilket innebär att det är en neurotoxisk orsakande förening av sjukdomen. Trots dess kända toxicitet i sin jonform, är studier uppdelade på den potentiella toxiciteten av att använda aluminium i förpackningar och matlagningsapparater.
Merkurius
Kvicksilver kan inducera CNS-skador genom att migrera in i hjärnan genom att korsa BBB. Kvicksilver finns i ett antal olika föreningar, även om metylkvicksilver (MeHg + ), dimetylkvicksilver och dietylkvicksilver är de enda signifikant neurotoxiska formerna. Dietylkvicksilver och dimetylkvicksilver anses vara några av de mest potenta neurotoxiner som någonsin upptäckts. MeHg + förvärvas vanligtvis genom konsumtion av skaldjur , eftersom det tenderar att koncentreras till organismer högt upp i näringskedjan. Det är känt att kvicksilverjonen hämmar aminosyra (AA) och glutamat (Glu) transport, vilket potentiellt leder till excitotoxiska effekter.
Receptoragonister och -antagonister
Anatoxin-a
| Extern video | |
|---|---|
|
University of Nottingham |
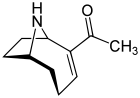
Undersökningar av anatoxin- a , även känd som "Very Fast Death Factor", började 1961 efter döden av kor som drack ur en sjö som innehöll en algblomning i Saskatchewan, Kanada. Det är ett cyanotoxin som produceras av minst fyra olika släkten av cyanobakterier och har rapporterats i Nordamerika, Europa, Afrika, Asien och Nya Zeeland.
Toxiska effekter från anatoxin- en utveckling mycket snabbt eftersom det verkar direkt på nervcellerna ( neuroner ). De progressiva symtomen på anatoxinexponering är förlust av koordination, ryckningar , kramper och snabb död genom andningsförlamning . De nervvävnader som kommunicerar med muskler innehåller en receptor som kallas nikotinacetylkolinreceptorn . Stimulering av dessa receptorer orsakar muskelsammandragning . Anatoxin- en molekyl är formad så att den passar denna receptor, och på så sätt efterliknar den den naturliga signalsubstansen som normalt används av receptorn, acetylkolin . När det väl har utlöst en sammandragning tillåter anatoxin- a inte neuronerna att återgå till sitt vilotillstånd, eftersom det inte bryts ned av kolinesteras som normalt utför denna funktion. Som ett resultat drar muskelcellerna ihop sig permanent, kommunikationen mellan hjärnan och musklerna störs och andningen upphör.
När det först upptäcktes kallades toxinet Very Fast Death Factor (VFDF) eftersom det när det injicerades i kroppshålan på möss inducerade skakningar, förlamning och död inom några minuter. 1977 bestämdes strukturen för VFDF som en sekundär, bicyklisk aminalkaloid , och den döptes om till anatoxin- a . Strukturellt liknar det kokain. Det finns ett fortsatt intresse för anatoxin på grund av de faror det utgör för rekreations- och dricksvatten, och för att det är en särskilt användbar molekyl för att undersöka acetylkolinreceptorer i nervsystemet. Giftighetens deadliness gör att det har en hög militär potential som toxinvapen.
Bungarotoxin
Bungarotoxin är en förening med känd interaktion med nikotinacetylkolinreceptorer (nAChRs), som utgör en familj av jonkanaler vars aktivitet utlöses av neurotransmittorbindning. Bungarotoxin produceras i ett antal olika former, även om en av de vanligaste formerna är den långkedjiga alfaformen, α-bungarotoxin , som isoleras från den bandade kraitormen . Även om det är extremt giftigt vid intag, har α-bungarotoxin visat omfattande användbarhet inom neurovetenskap eftersom det är särskilt skickligt på att isolera nAChRs på grund av dess höga affinitet till receptorerna. Eftersom det finns flera former av bungarotoxin, finns det olika former av nAChR som de kommer att binda till, och a-bungarotoxin är särskilt specifikt för α7-nAChR . Denna α7-nAChR fungerar för att tillåta kalciumjoninflöde in i cellerna, och när den blockeras av intaget bungarotoxin kommer den att ge skadliga effekter, eftersom ACh-signalering kommer att hämmas. Likaså kan användningen av α-bungarotoxin vara mycket användbar inom neurovetenskap om det är önskvärt att blockera kalciumflödet för att isolera effekter av andra kanaler. Dessutom kan olika former av bungarotoxin vara användbara för att studera hämmade nAChRs och deras resulterande kalciumjonflöde i olika system i kroppen. Till exempel är α-bungarotoxin specifikt för nAChRs som finns i muskulaturen och κ-bungarotoxin är specifikt för nAChRs som finns i neuroner.
Caramboxin
Caramboxin (CBX) är ett toxin som finns i stjärnfrukt ( Averrhoa carambola) . Individer med vissa typer av njursjukdom är mottagliga för negativa neurologiska effekter inklusive berusning, kramper och till och med död efter att ha ätit stjärnfrukt eller druckit juice gjord av denna frukt. Caramboxin är ett nytt icke-peptid aminosyratoxin som stimulerar glutamatreceptorerna i neuroner. Caramboxin är en agonist av både NMDA och AMPA glutamaterga jonotropa receptorer med potenta excitatoriska, konvulsiva och neurodegenerativa egenskaper.
Kurare
Termen " curare " är tvetydig eftersom den har använts för att beskriva ett antal gifter som vid tidpunkten för namngivningen förstods annorlunda än dagens uppfattningar. Tidigare har karaktäriseringen inneburit gifter som används av sydamerikanska stammar på pilar eller pilar , även om den har mognat för att specificera en specifik kategorisering av gifter som verkar på den neuromuskulära förbindelsen för att hämma signalering och därmed inducera muskelavslappning. Neurotoxinkategorin innehåller ett antal distinkta gifter, även om alla ursprungligen renades från växter med ursprung i Sydamerika. Den effekt som injicerat curaregift vanligtvis förknippas med är muskelförlamning och resulterande död. Curare fungerar särskilt för att hämma nikotinacetylkolinreceptorer vid den neuromuskulära korsningen . Normalt tillåter dessa receptorkanaler natriumjoner in i muskelcellerna för att initiera en aktionspotential som leder till muskelkontraktion. Genom att blockera receptorerna kan neurotoxinet avsevärt reducera signalering av neuromuskulära korsningar, en effekt som har resulterat i att det har använts av anestesiologer för att skapa muskelavslappning.
Cytoskelettinterferens
Ammoniak
Ammoniaktoxicitet ses ofta genom två administreringsvägar, antingen genom konsumtion eller genom endogena åkommor såsom leversvikt . Ett anmärkningsvärt fall där ammoniaktoxicitet är vanligt är som svar på levercirros som resulterar i leverencefalopati och kan resultera i cerebralt ödem (Haussinger 2006 ) . Detta hjärnödem kan vara resultatet av ombyggnad av nervceller. Som en konsekvens av ökade koncentrationer har ammoniakaktivitet in vivo visat sig inducera svullnad av astrocyter i hjärnan genom ökad produktion av cGMP (cykliskt guanosinmonofosfat) i cellerna vilket leder till proteinkinas G-medierade (PKG) cytoskelettmodifieringar. Den resulterande effekten av denna toxicitet kan vara minskad hjärnenergimetabolism och funktion. Viktigt är att de toxiska effekterna av ammoniak på ombyggnad av astrocyter kan minskas genom administrering av L-karnitin . Denna astrocytombyggnad verkar förmedlas genom ammoniakinducerad mitokondriell permeabilitetsövergång. Denna mitokondriella övergång är ett direkt resultat av glutaminaktivitet, en förening som bildas från ammoniak in vivo. Administrering av antioxidanter eller glutaminashämmare kan minska denna mitokondriella övergång och potentiellt även ombyggnad av astrocyter.
Arsenik
Arsenik är ett neurotoxin som vanligtvis finns koncentrerat i områden som är utsatta för avrinning från jordbruket , gruvdrift och smältplatser (Martinez-Finley 2011). En av effekterna av arsenikintag under utvecklingen av nervsystemet är hämningen av neurittillväxt som kan förekomma både i PNS och CNS. Denna neurittillväxthämning kan ofta leda till defekter i neural migration , och signifikanta morfologiska förändringar av neuroner under utveckling ), vilket ofta leder till neuralrörsdefekter hos nyfödda . Som en metabolit av arsenik bildas arsenit efter intag av arsenik och har visat signifikant toxicitet för neuroner inom cirka 24 timmar efter exponering. Mekanismen för denna cytotoxicitet fungerar genom arsenit-inducerade ökningar av intracellulära kalciumjonnivåer i neuroner, vilket därefter kan minska mitokondriell transmembranpotential som aktiverar kaspaser , vilket utlöser celldöd. En annan känd funktion hos arsenit är dess destruktiva natur mot cytoskelettet genom hämning av neurofilamenttransport . Detta är särskilt destruktivt eftersom neurofilament används i grundläggande cellstruktur och stöd. Litiumadministrering har dock visat sig lovande när det gäller att återställa en del av den förlorade neurofilamentmotiliteten. Dessutom, i likhet med andra neurotoxinbehandlingar, har administreringen av vissa antioxidanter visat något lovande när det gäller att minska neurotoxiciteten hos intagen arsenik.
Kalciummedierad cytotoxicitet
Leda
Bly är ett potent neurotoxin vars toxicitet har erkänts i minst tusentals år. Även om neurotoxiska effekter för bly finns hos både vuxna och små barn , är den utvecklande hjärnan särskilt känslig för blyinducerade skador, effekter som kan inkludera apoptos och excitotoxicitet. En underliggande mekanism genom vilken bly kan orsaka skada är dess förmåga att transporteras av kalcium-ATPas-pumpar över BBB, vilket möjliggör direkt kontakt med de ömtåliga cellerna i det centrala nervsystemet. Neurotoxicitet beror på blyets förmåga att agera på ett liknande sätt som kalciumjoner, eftersom koncentrerat bly leder till cellulärt upptag av kalcium vilket stör cellulär homeostas och inducerar apoptos. Det är denna intracellulära kalciumökning som aktiverar proteinkinas C (PKC), vilket visar sig som inlärningsbrist hos barn som ett resultat av tidig blyexponering. Förutom att inducera apoptos, hämmar bly interneuronsignalering genom störningen av kalciummedierad frisättning av neurotransmittorer.
Neurotoxiner med flera effekter
Etanol

Som ett nervgift har etanol visat sig inducera skador på nervsystemet och påverka kroppen på en mängd olika sätt. Bland de kända effekterna av etanolexponering finns både övergående och bestående konsekvenser. Några av de bestående effekterna inkluderar långvarig minskad neurogenes i hippocampus , utbredd hjärnatrofi och inducerad inflammation i hjärnan. Att notera har kroniskt etanolintag dessutom visat sig inducera omorganisation av cellulära membranbeståndsdelar, vilket leder till ett lipiddubbelskikt som kännetecknas av ökade membrankoncentrationer av kolesterol och mättat fett . Detta är viktigt eftersom transport av signalsubstanser kan försämras genom hämning av vesikulär transport, vilket resulterar i minskad neurala nätverksfunktion. Ett signifikant exempel på minskad kommunikation mellan neuroner är förmågan för etanol att hämma NMDA-receptorer i hippocampus, vilket resulterar i minskad långsiktig potentiering ( LTP) och minnesförvärv. NMDA har visat sig spela en viktig roll i LTP och följaktligen minnesbildning. Med kroniskt etanolintag ökar emellertid känsligheten hos dessa NMDA-receptorer för att inducera LTP i de mesolimbiska dopaminneuronerna på ett inositol 1,4,5-trifosfat (IP3)-beroende sätt. Denna omorganisation kan leda till neuronal cytotoxicitet både genom hyperaktivering av postsynaptiska neuroner och genom inducerad beroende av kontinuerlig etanolkonsumtion. Det har dessutom visat sig att etanol direkt minskar intracellulär kalciumjonackumulering genom hämmad NMDA-receptoraktivitet och därmed minskar kapaciteten för uppkomsten av LTP.
Förutom de neurotoxiska effekterna av etanol i mogna organismer, kan kroniskt intag framkalla allvarliga utvecklingsdefekter. Bevis visades första gången 1973 på ett samband mellan kroniskt etanolintag hos mödrar och defekter hos deras avkomma. Detta arbete var ansvarigt för att skapa klassificeringen av fetalt alkoholsyndrom , en sjukdom som kännetecknas av vanliga morfogenesavvikelser såsom defekter i kraniofacial bildning, utveckling av extremiteter och kardiovaskulär bildning. Omfattningen av etanolneurotoxicitet hos foster som leder till fetalt alkoholsyndrom har visat sig vara beroende av antioxidantnivåer i hjärnan såsom vitamin E. Eftersom fostrets hjärna är relativt ömtålig och mottaglig för inducerad stress, kan allvarliga skadliga effekter av alkoholexponering ses i viktiga områden som hippocampus och lillhjärnan . Allvarligheten av dessa effekter är direkt beroende av mängden och frekvensen av etanolkonsumtion av modern, och utvecklingsstadiet hos fostret. Det är känt att etanolexponering resulterar i minskade antioxidantnivåer, mitokondriell dysfunktion (Chu 2007) och efterföljande neuronal död, till synes som ett resultat av ökad generering av reaktiva oxidativa arter (ROS). Detta är en rimlig mekanism, eftersom det finns en minskad förekomst i fostrets hjärna av antioxidantenzymer som katalas och peroxidas . Till stöd för denna mekanism resulterar administrering av höga nivåer av vitamin E i kosten i minskade eller eliminerade etanol-inducerade neurotoxiska effekter hos foster.
n-hexan
n- Hexan är ett nervgift som har varit ansvarigt för förgiftningen av flera arbetare i kinesiska elektronikfabriker de senaste åren.
Receptorselektiva neurotoxiner
MPP +
MPP + , den toxiska metaboliten av MPTP , är ett selektivt neurotoxin som interfererar med oxidativ fosforylering i mitokondrier genom att hämma komplex I , vilket leder till utarmning av ATP och efterföljande celldöd. Detta inträffar nästan uteslutande i dopaminerga neuroner av substantia nigra , vilket resulterar i presentationen av permanent parkinsonism hos exponerade försökspersoner 2–3 dagar efter administrering.
Endogena neurotoxinkällor
Till skillnad från de vanligaste källorna till neurotoxiner som förvärvas av kroppen genom intag, kommer endogena neurotoxiner både från och utövar sina effekter in vivo . Dessutom, även om de flesta gifter och exogena neurotoxiner sällan kommer att ha användbara in vivo-egenskaper, används endogena neurotoxiner vanligtvis av kroppen på användbara och hälsosamma sätt, såsom kväveoxid som används i cellkommunikation. Det är ofta först när dessa endogena föreningar blir högkoncentrerade som de leder till farliga effekter.
Kväveoxid
Även om kväveoxid (NO) vanligtvis används av nervsystemet i inter-neuronkommunikation och signalering, kan den vara aktiv i mekanismer som leder till ischemi i storhjärnan (Iadecola 1998). Neurotoxiciteten hos NO är baserad på dess betydelse för glutamatexitotoxicitet, eftersom NO genereras på ett kalciumberoende sätt som svar på glutamatmedierad NMDA-aktivering, som inträffar med en förhöjd hastighet i glutamatexitotoxicitet. Även om NO underlättar ökat blodflöde till potentiellt ischemiska regioner i hjärnan, är det också kapabelt att öka oxidativ stress , inducera DNA-skador och apoptos. Således kan en ökad närvaro av NO i ett ischemiskt område av CNS ge signifikant toxiska effekter.
Glutamat
Glutamat , liksom kväveoxid, är en endogent framställd förening som används av neuroner för att fungera normalt, och är närvarande i små koncentrationer i hela den grå substansen i CNS. En av de mest anmärkningsvärda användningarna av endogent glutamat är dess funktion som en excitatorisk neurotransmittor. När det koncentreras blir glutamat giftigt för omgivande nervceller. Denna toxicitet kan vara både ett resultat av direkt dödlighet av glutamat på neuroner och ett resultat av inducerat kalciumflöde in i neuroner som leder till svullnad och nekros. Stöd har visats för att dessa mekanismer spelar en betydande roll vid sjukdomar och komplikationer som Huntingtons sjukdom , epilepsi och stroke .
Se även
Anteckningar
Referenser
- Adams, Michael E.; Olivera, Baldomero M. (1994). "Neurotoxiner: Översikt över en framväxande forskningsteknik". Trender inom neurovetenskap . 17 (4): 151–55. doi : 10.1016/0166-2236(94)90092-2 . PMID 7517594 . S2CID 3984106 .
- Arnon, Stephen S.; Schechter, Robert; Inglesby, Thomas V.; Henderson, Donald A.; Bartlett, John G.; Ascher, Michael S.; Eitzen, Edward; Fine, Anne D.; Hauer, Jerome; Layton, Marcelle; Lillibridge, Scott; Österholm, Michael T.; O'Toole, Tara; Parker, Gerald; Perl, Trish M.; Russell, Philip K.; Swerdlow, David L.; Tonat, Kevin (2001). "Botulinumtoxin som ett biologiskt vapen". Journal of the American Medical Association . 285 (8): 1059–069. doi : 10.1001/jama.285.8.1059 . PMID 11209178 .
- Aschner, M.; Aschner, J. (1990). "Mercury Neurotoxicity: Mekanismer för blod-hjärnbarriärtransport". Neurovetenskap och biobeteenderecensioner . 14 (2): 169–76. doi : 10.1016/s0149-7634(05)80217-9 . PMID 2190116 . S2CID 8777931 .
- Banks, William A.; Kastin, Abba J. (1989). "Aluminium-inducerad neurotoxicitet: förändringar i membranfunktionen vid blod-hjärnbarriären". Neurovetenskap och biobeteenderecensioner . 13 (1): 47–53. doi : 10.1016/s0149-7634(89)80051-x . PMID 2671833 . S2CID 46507895 .
- Baum-Baicker, Cynthia (1985). "Hälsofördelarna med måttlig alkoholkonsumtion: en recension av litteraturen". Narkotika- och alkoholberoende . 15 (3): 207–27. doi : 10.1016/0376-8716(85)90001-8 . PMID 4028954 .
- Beckman, JS (1990). "Senbar hydroxylradikalproduktion av peroxinitrit: konsekvenser för endotelskada från kväveoxid och superoxid" . Proceedings of the National Academy of Sciences . 87 (4): 1620–624. Bibcode : 1990PNAS...87.1620B . doi : 10.1073/pnas.87.4.1620 . PMC 53527 . PMID 2154753 .
- Bergamini, Carlo M.; Gambetti, Stefani; Dondi, Alessia; Cervellati, Carlo (2004). "Syre, reaktiva syrearter och vävnadsskador". Nuvarande läkemedelsdesign . 10 (14): 1611–626. doi : 10.2174/1381612043384664 . PMID 15134560 .
-
Bernier Brian E., Whitaker Leslie R., Morikawa Hitoshi (2011). "Tidigare erfarenhet av etanol förbättrar den synaptiska plasticiteten hos NMDA-receptorer i det ventrala tegmentala området" . Journal of Neuroscience . 31 (14): 5305–212. doi : 10.1523/JNEUROSCI.5282-10.2011 . PMC 3086894 . PMID 21471355 .
{{cite journal}}: CS1 underhåll: flera namn: lista över författare ( länk ) - Bisset, Norman G (1992). "Den nya världens krig och jaktgifter. Del 1. Anteckningar om Curares tidiga historia". Journal of Ethnopharmacology . 36 (1): 1–26. doi : 10.1016/0378-8741(92)90056-w . PMID 1501489 .
- Blanco, Ana M.; Valles, Soraya L.; Pascual, Maria; Guerri, Consuelo (2005). "Involvering av TLR4/Typ I IL-1-receptorsignalering i induktionen av inflammatoriska mediatorer och celldöd inducerad av etanol i odlade astrocyter" . Journal of Immunology . 175 (10): 6893–899. doi : 10.4049/jimmunol.175.10.6893 . PMID 16272348 .
- Bleich, S (2003). "Hyperhomocysteinemi som en ny riskfaktor för hjärnkrympning hos patienter med alkoholism". Neurovetenskapsbrev . 335 (3): 179–82. doi : 10.1016/s0304-3940(02)01194-1 . PMID 12531462 . S2CID 33032529 .
- Bonfoco E (1995). "Apoptos och nekros: två distinkta händelser inducerade, respektive, av milda och intensiva förolämpningar med N-metyl-D-aspartat eller kväveoxid/superoxid i kortikala cellkulturer" . Proceedings of the National Academy of Sciences . 92 (16): 7162–166. Bibcode : 1995PNAS...92.7162B . doi : 10.1073/pnas.92.16.7162 . PMC 41299 . PMID 7638161 .
- Bradbury, MW; Deane, R (1993). "Permeabilitet av blod±hjärnbarriären för bly. [Review]". Neurotoxikologi . 14 (2–3): 131–6. PMID 8247388 .
- Brender, J.; Suarez, L.; Felkner, M.; Gilani, Z.; Stinchcomb, D.; Moody, K.; Henry, J.; Hendricks, K. (2006). "Moderns exponering för arsenik, kadmium, bly och kvicksilver och neuralrörsdefekter hos avkomma". Miljöforskning . 101 (1): 132–39. Bibcode : 2006ER....101..132B . doi : 10.1016/j.envres.2005.08.003 . PMID 16171797 .
- Bressler, J; Kim, KA; Chakraborti, T; Goldstein, G (1999). "Molekylära mekanismer för blyneurotoxicitet. [Review]". Neurochem Res . 24 (4): 595–600. doi : 10.1023/A:1022596115897 . PMID 10227691 . S2CID 3017703 .
- Brocardo, Patricia S.; Gil-Mohapel, Joana; Christie, Brian R. (2011). "Rollen av oxidativ stress i fetala alkoholspektrumstörningar". Hjärnforskningsrecensioner . 67 (1–2): 209–25. doi : 10.1016/j.brainresrev.2011.02.001 . PMID 21315761 . S2CID 1213492 .
- Brookes, N (1988). "Specificitet och reversibilitet av hämningen av HgCl av glutamattransport i astrocytkulturer". Journal of Neurochemistry . 50 (4): 1117–122. doi : 10.1111/j.1471-4159.1988.tb10581.x . PMID 2894409 . S2CID 27522735 .
- Buzanska, L.; Zablocka, B.; Dybel, A.; Domanska-Janik, K.; Albrecht, J. (2000). "Försenad induktion av apoptos av ammoniak i C6-gliomceller". Neurochemistry International . 37 (2–3): 287–97. doi : 10.1016/s0197-0186(00)00030-9 . PMID 10812214 . S2CID 33351533 .
- Carmichael WW, Biggs DF, Gorham PR (1975). "Toxikologi och farmakologisk verkan av Anabaena flos-aquae toxin". Vetenskap . 187 (4176): 542–544. Bibcode : 1975Sci...187..542C . doi : 10.1126/science.803708 . PMID 803708 .
- Carmichael WW, Gorham PR (1978). "Anatoxiner från kloner av Anabaena flos-aquae isolerade från sjöar i västra Kanada". Mitt. Infernalisk. Verein. Limnol . 21 : 285-295.
- Chan, HM (2011) "Mercury in Fish: Human Health Risks." Encyclopedia of Environmental Health : 697–704.
- Choi, D (1988). "Kalciummedierad neurotoxicitet: samband med specifika kanaltyper och roll i ischemisk skada". Trender inom neurovetenskap . 11 (10): 465–69. doi : 10.1016/0166-2236(88)90200-7 . PMID 2469166 . S2CID 36909560 .
- Choi, DW; Rothman, SM (1990). "Rollen av glutamat neurotoxicitet i hypoxisk-ischemisk neuronal död". Årlig översyn av neurovetenskap . 13 (1): 171–82. doi : 10.1146/annurev.neuro.13.1.171 . PMID 1970230 .
- Choi, Dennis W (1987). "Joniskt beroende av glutamatneurotoxicitet" . Journal of Neuroscience . 7 (2): 369–79. doi : 10.1523/JNEUROSCI.07-02-00369.1987 . PMC 6568907 . PMID 2880938 .
- Choi, Dennis W.; Maulucci-Gedde, Margaret; Kriegstein, Arnold R. (1987). "Glutamatneurotoxicitet i kortikal cellkultur" . Journal of Neuroscience . 7 (2): 357–68. doi : 10.1523/JNEUROSCI.07-02-00357.1987 . PMC 6568898 . PMID 2880937 .
- Chu, Jennifer; Tong, Ming; Monte, Suzanne M. (2007). "Kronisk etanolexponering orsakar mitokondriell dysfunktion och oxidativ stress i omogna neuroner i centrala nervsystemet". Acta Neuropathologica . 113 (6): 659–73. doi : 10.1007/s00401-007-0199-4 . PMID 17431646 . S2CID 25418731 .
- Clancy, Barbara; Finlay, Barbara L.; Darlington, Richard B.; Anand, KJS (2007). "Extrapolera hjärnutveckling från experimentella arter till människor" . Neurotoxikologi . 28 (5): 931–37. doi : 10.1016/j.neuro.2007.01.014 . PMC 2077812 . PMID 17368774 .
- Costa, Lucio G., Gennaro Giordano och Marina Guizzetti (2011) In Vitro Neurotoxicology: Methods and Protocols. New York: Humana.
- Coyle, Joseph T.; Schwarcz, Robert (1976). "Lesion av striatala neuroner med Kainic Acid ger en modell för Huntingtons Chorea". Naturen . 246 (5574): 244–46. Bibcode : 1976 Natur.263..244C . doi : 10.1038/263244a0 . PMID 8731 . S2CID 4271762 .
- Cruz, Lourdes J.; Olivera, Baldomero M. (1987). "Kalciumkanalantagonister ω-konotoxin definierar en ny högaffinitetsplats". Journal of Biological Chemistry . 14 (261): 6230–233.
- Davis, S.; Butcher, SP; Morris, R. (1992). "NMDA-receptorantagonisten D-2-amino-5fosfonpentanoat (D-AP5) försämrar rumslig inlärning och LTP in vivo vid intracerebrala koncentrationer jämförbara med de som blockerar LTP in vitro" . Journal of Neuroscience . 12 (1): 21–34. doi : 10.1523/JNEUROSCI.12-01-00021.1992 . PMC 6575679 . PMID 1345945 .
- Dawson, VL (1991). "Kväveoxid förmedlar glutamat neurotoxicitet i primära kortikala kulturer" . Proceedings of the National Academy of Sciences . 88 (14): 6368–371. Bibcode : 1991PNAS...88.6368D . doi : 10.1073/pnas.88.14.6368 . PMC 52084 . PMID 1648740 .
- Debin, John A., John E. Maggio och Gary R. Strichartz (1993) "Rening och karakterisering av klorotoxin, en kloridkanalligand från skorpionens gift." American Physiological Society , s. 361–69.
- DeFuria, Jason; Shea, Thomas B. (2007). "Arsenik hämmar neurofilamenttransport och inducerar perikaryal ackumulering av fosforylerade neurofilament: roller för JNK och GSK-3β". Hjärnforskning . 1181 : 74–82. doi : 10.1016/j.brainres.2007.04.019 . PMID 17961518 . S2CID 37068398 .
- Defuria, Jason (2006) "The Environmental Neurotoxin Arsenic Impairs Neurofilament Dynamics by Overactivation of C-JUN Terminal Kinase: Potentiell roll for Amyotrophic Lateral Sclerosis." UMI , s. 1–16.
- Deng Wenbin, Poretz Ronald D (2003). "Oligodendroglia i utvecklingsneurotoxicitet". Neurotoxikologi . 24 (2): 161–78. doi : 10.1016/s0161-813x(02)00196-1 . PMID 12606289 .
- Deshane, Jessy; Garner, Craig C.; Sontheimer, Harald (2003). "Klorotoxin hämmar gliomcellinvasion via matrismetalloproteinas-2" . Journal of Biological Chemistry . 278 (6): 4135–144. doi : 10.1074/jbc.m205662200 . PMID 12454020 .
- Devlin JP, Edwards OE, Gorham PR, Hunter NR, Pike RK, Stavric B (1977). "Anatoxin-a, en giftig alkaloid från Anabaena flos-aquae NRC-44h" . Burk. J. Chem . 55 (8): 1367–1371. doi : 10.1139/v77-189 . Arkiverad från originalet 2012-07-09.
- Dikranian, K (2001). "Apoptos i in vivo däggdjurs framhjärna" . Sjukdomens neurobiologi . 8 (3): 359–79. doi : 10.1006/nbdi.2001.0411 . PMID 11447994 . S2CID 21965033 .
- Dixit A, Dhaked RK, Alam SI, Singh L (2005). "Militär potential för biologiska neurotoxiner". Toxin recensioner . 24 (2): 175–207. doi : 10.1081/TXR-200057850 . S2CID 85651107 .
- Dobbs, Michael R (2009) Klinisk neurotoxicologi. Philadelphia: Saunders-Elsevier.
- Dutertre, S.; Lewis, R. (2006). "Toxin Insights in Nicotinic Acetylcholine Receptors". Biokemisk farmakologi . 72 (6): 661–70. doi : 10.1016/j.bcp.2006.03.027 . PMID 16716265 .
- Garcia-Rodriguez, C.; Geren, IN; Lou, J.; Conrad, F.; Forsyth, C.; Wen, W.; Chakraborti, S.; Zao, H.; Manzanarez, G.; Smith, TJ; Brown, J.; Tepp, WH; Liu, N.; Wijesuriya, S.; Tomic, MT; Johnson, EA; Smith, LA; Marks, JD (2011). "Svar Re: 'Neutraliserande humana monoklonala antikroppar som binder flera serotyper av botulinumneurotoxin' av Garcia-Rodriguez et al., PEDS, 2011;24:321–331" . Protein Engineering Design och urval . 24 (9): 633–34. doi : 10.1093/protein/gzr012 .
- Garthwaite, John; Charles, Sarah L.; Chess-Williams, Russel (1988). "Endotel-härledd frisättning av avslappnande faktor vid aktivering av NMDA-receptorer föreslår roll som intercellulär budbärare i hjärnan". Naturen . 336 (24): 385–88. Bibcode : 1988Natur.336..385G . doi : 10.1038/336385a0 . PMID 2904125 . S2CID 4361381 .
- Gartlon, J.; Kinsner, A.; Balprice, A.; Coecke, S.; Clothier, R. (2006). "Utvärdering av en föreslagen in vitro-teststrategi med användning av neuronala och icke-neuronala cellsystem för att upptäcka neurotoxicitet". Toxikologi in vitro . 20 (8): 1569–581. doi : 10.1016/j.tiv.2006.07.009 . PMID 16959468 .
- Gil-Mohapel, Joana; Boehme, Fanny; Kainer, Leah; Christie, Brian R. (2010). "Hippocampal cellförlust och neurogenes efter fetal alkoholexponering: Insikter från olika gnagarmodeller". Hjärnforskningsrecensioner . 64 (2): 283–303. doi : 10.1016/j.brainresrev.2010.04.011 . PMID 20471420 . S2CID 10159395 .
- Haghdoost-Yazdi, Hashem; Faraji, Ayda; Fraidouni, Negin; Movahedi, Mohadeseh; Hadibeygi, Elham; Vaezi, Fatemeh (2011). "Betydande effekter av 4-aminopyridin och tetraetylammonium vid behandling av 6-hydroxidopamin-inducerad Parkinsons sjukdom". Beteendehjärnforskning . 223 (1): 70–74. doi : 10.1016/j.bbr.2011.04.021 . PMID 21540059 . S2CID 7100177 .
- Harry, GJ; Billingsley, Melvin; Bruinink, Arendd; Campbell, Iain L.; Classen, Werner; Dorman, David C.; Galli, Corrado; Ray, David; Smith, Robert A.; Tilson, Hugh A. (1998). "In vitro-tekniker för bedömning av neurotoxicitet" . Miljöhälsoperspektiv . 106 (Suppl 1): 131–58. doi : 10.2307/3433917 . JSTOR 3433917 . PMC 1533280 . PMID 9539010 .
- Häussinger, Dieter (2006). "Låggradigt cerebralt ödem och patogenesen av hepatisk encefalopati vid cirros" . Hepatologi . 43 (6): 1187–190. doi : 10.1002/hep.21235 . PMID 16729329 .
- Hensley, K (1994). "En modell för β-amyloidaggregation och neurotoxicitet baserad på generering av fria radikaler av peptiden: relevans för Alzheimers sjukdom" . Proceedings of the National Academy of Sciences . 91 (8): 3270–274. Bibcode : 1994PNAS...91.3270H . doi : 10.1073/pnas.91.8.3270 . PMC 43558 . PMID 8159737 .
- Herbert, MR (2006) "Autism och miljögenomik." NeuroToxicology , s. 671–84. Webb.
- Hodge, A. Trevor (2002) Romerska akvedukter och vattenförsörjning . London: Duckworth.
- How, C (2003). "Tetrodotoxinförgiftning". American Journal of Emergency Medicine . 21 (1): 51–54. doi : 10.1053/ajem.2003.50008 . PMID 12563582 .
- Hue, Bernard; Buckingham, Steven D.; Buckingham, David; Sattelle, David B. (2007). "Aktioner av ormneurotoxiner på en insekts nikotinisk kolinerg synaps". Ryggradslösa neurovetenskap . 7 (3): 173–78. doi : 10.1007/s10158-007-0053-3 . PMID 17710455 . S2CID 31599093 .
- Iadecola Constantino (1997). "Ljusa och mörka sidor av kväveoxid vid ischemisk hjärnskada". Trender inom neurovetenskap . 20 (3): 132–39. doi : 10.1016/s0166-2236(96)10074-6 . PMID 9061868 . S2CID 45011034 .
- Jacob, Reed B.; McDougal, Owen M. (2010). "M-superfamiljen av Conotoxins: en recension" . Cellulära och molekylära livsvetenskaper . 67 (1): 17–27. doi : 10.1007/s00018-009-0125-0 . PMC 3741454 . PMID 19705062 .
- Jevtovic-Todorovic, Vesna; Hartman, Richard E.; Izumi, Yukitoshi; Benshoff, Nicholas D.; Dikranian, Krikor; Zorumski, Charles F.; Olney, John W.; Wozniak, David F. (2003). "Tidig exponering för vanliga anestesimedel orsakar utbredd neurodegeneration i den utvecklande råtthjärnan och ihållande inlärningsbrist" . Journal of Neuroscience . 23 (3): 876–82. doi : 10.1523/JNEUROSCI.23-03-00876.2003 . PMC 6741934 . PMID 12574416 .
- Jones, K (1973). "Mönster av missbildning hos avkommor till kroniska alkoholiserade mödrar". The Lancet . 301 (7815): 1267–271. doi : 10.1016/s0140-6736(73)91291-9 . PMID 4126070 .
- Kiernan, Matthew C.; Isbister, Geoffrey K.; Cindy; Lin, S.-Y.; Burke, David; Bostock, Hugh (2005). "Akut tetrodotoxin-inducerad neurotoxicitet efter intag av pufferfisk". Annals of Neurology . 57 (3): 339–48. doi : 10.1002/ana.20395 . PMID 15732107 . S2CID 40455149 .
- King, Steven W.; Savory, John; Wills, Michael R.; Gitelman, HJ (1981). "Aluminiums kliniska biokemi". Kritiska recensioner i klinisk laboratorievetenskap . 14 (1): 1–20. doi : 10.3109/10408368109105861 . PMID 7016437 .
- Konopacka, Agnieszka; Konopacki, Filip A.; Albrecht, Jan (2009). "Protein Kinas G är involverat i ammoniak-inducerad svullnad av astrocyter". Journal of Neurochemistry . 109 : 246–51. doi : 10.1111/j.1471-4159.2009.05802.x . PMID 19393034 . S2CID 42719321 .
- Lafon-Cazal, Mireille; Pietri, Sylvia; Culcasi, Marcel; Bockaert, Joel (1993). "NMDA-beroende superoxidproduktion och neurotoxicitet". Naturen . 364 (6437): 535–37. Bibcode : 1993Natur.364..535L . doi : 10.1038/364535a0 . PMID 7687749 . S2CID 4246917 .
- Lasley, SM; Green, MC; Gilbert, ME (1999). "Inflytande av exponeringsperioden på in vivo hippocampus glutamat och GABA-frisättning hos råttor som är kroniskt exponerade för bly". Neurotoxikologi . 20 (4): 619–29. PMID 10499360 .
- Lau, FL; Wong, CK; Japp, SH (1995). "Blusfiskförgiftning" . Emergency Medicine Journal . 12 (3): 214–15. doi : 10.1136/emj.12.3.214 . PMC 1342486 . PMID 8581253 .
- Lewendon, G.; Kinra, S.; Nelder, R.; Cronin, T. (2001). "Bör barn med utvecklings- och beteendeproblem rutinmässigt undersökas för bly?" . Arkiv över sjukdomar i barndomen . 85 (4): 286–88. doi : 10.1136/adc.85.4.286 . PMC 1718950 . PMID 11567935 .
- Lidsky Theodore I (2003). "Blyneurotoxicitet hos barn: grundläggande mekanismer och kliniska korrelat" . Hjärna . 126 (1): 5–19. doi : 10.1093/brain/awg014 . PMID 12477693 .
- Liu, Kuang-Kai; Chen, Mei-Fang; Chen, Po-Yi; Lee, Tony J F.; Cheng, Chia-Liang; Chang, Chia-Ching; Ho, Yen-Peng; Jui-I, Chao (2008). "Alfa-bungarotoxin binder till målcell i ett utvecklande visuellt system av karboxylerad nanodiamant" . Nanoteknik . 19 (20): 205102. Bibcode : 2008Nanot..19t5102L . doi : 10.1088/0957-4484/19/20/205102 . PMID 21825732 . S2CID 1260143 .
- Liu, Yuan; McDermott, Suzanne; Lawson, Andrew; Aelion, C. Marjorie (2010). "Släktskapet mellan mental retardation och utvecklingsförseningar hos barn och nivåerna av arsenik, kvicksilver och bly i jordprover tagna nära deras mors bostad under graviditeten" . International Journal of Hygiene and Environmental Health . 213 (2): 116–23. doi : 10.1016/j.ijheh.2009.12.004 . PMC 2836425 . PMID 20045663 .
- Lorenzo, A (1994). "β-Amyloid neurotoxicitet kräver fibrilbildning och hämmas av Kongorött" . Proceedings of the National Academy of Sciences . 91 (25): 12243–2247. Bibcode : 1994PNAS...9112243L . doi : 10.1073/pnas.91.25.12243 . PMC 45413 . PMID 7991613 .
- Lotti, Marcello och Angelo Moretto (1989) "Organofosfat-inducerad fördröjd polyneuropati." Toxicological Reviews, 24 (1) (2005): 37–49.
- Martinez-Finley, Ebany J.; Goggin, Samantha L.; Labrecque, Matthew T.; Allan, Andrea M. (2011). "Reducerat uttryck av MAPK/ERK-gener i perinatal arsenikexponerad avkomma inducerad av glukokortikoidreceptorbrist" . Neurotoxikologi och teratologi . 33 (5): 530–37. doi : 10.1016/j.ntt.2011.07.003 . PMC 3183307 . PMID 21784148 .
- Martini, Frederic, Michael J. Timmons och Robert B. Tallitsch (2009) Human Anatomy. San Francisco: Pearson/Benjamin Cummings.
- Matsuoka, Masato; Igisu, Hideki; Kohriyama, Kazuaki; Inoue, Naohide (1991). "Undertryckning av neurotoxicitet av ammoniak med L-karnitin". Hjärnforskning . 567 (2): 328–31. doi : 10.1016/0006-8993(91)90814-c . PMID 1817738 . S2CID 10250413 .
- McCleskey, EW (1987). "Omega-conotoxin: Direkt och ihållande blockad av specifika typer av kalciumkanaler i nervceller men inte muskler" . Proceedings of the National Academy of Sciences . 84 (12): 4327–331. Bibcode : 1987PNAS...84.4327M . doi : 10.1073/pnas.84.12.4327 . PMC 305078 . PMID 2438698 .
- Meldrum, B.; Garthwaite, J. (1990). "Excitatorisk aminosyraneurotoxicitet och neurodegenerativ sjukdom". Trender inom farmakologiska vetenskaper . 11 (9): 379–87. doi : 10.1016/0165-6147(90)90184-a . PMID 2238094 .
- Metcalf, James S.; Codd, Geoffrey A. (2009). "Cyanobakterier, neurotoxiner och vattenresurser: Finns det konsekvenser för mänsklig neurodegenerativ sjukdom?". Amyotrofisk lateralskleros . 10 : 74–78. doi : 10.3109/17482960903272942 . PMID 19929737 . S2CID 41880444 .
- Mitchell, J. Jean; Paiva, Michael; Barrow Heaton, Marieta (1999). "Antioxidanterna vitamin E och β-karoten skyddar mot etanolinducerad neurotoxicitet i embryonala råtthippocampuskulturer". Alkohol . 17 (2): 163–68. doi : 10.1016/s0741-8329(98)00051-2 . PMID 10064385 .
- Moore RE (1977). "Toxiner från blågröna alger". Biovetenskap . 27 (12): 797–802. doi : 10.2307/1297756 . JSTOR 1297756 .
- Montecucco C (1986). "Hur binder stelkramp och botulinumtoxiner till neuronala membran?". Trender inom biokemiska vetenskaper . 11 (8): 314–17. doi : 10.1016/0968-0004(86)90282-3 .
- Morris, Stephanie A., David W. Eaves, Aleksander R. Smith och Kimberly Nixon (2009) "Alcohol Inhibition of Neurogenesis: A Mechanism of Hippocampal Neurodegeneration in an Adolescent Alcohol Abuse Model." Hippocampus: NA.
- Nadler; Victor, J.; Perry, Bruce W.; Cotman, Carl W. (1978). "Intraventrikulär Kainic Acid förstör företrädesvis hippocampus pyramidala celler". Naturen . 271 (5646): 676–77. Bibcode : 1978Natur.271..676N . doi : 10.1038/271676a0 . PMID 625338 . S2CID 4267990 .
- National Centre for Environmental Assessment (2006) "Toxicological Reviews of Cyanobacterial Toxins: Anatoxin-a" NCEA-C-1743
- Norenberg, MD; Rao, KV Rama; Jayakumar, AR (2004). "Ammoniakneurotoxicitet och den mitokondriella permeabilitetsövergången". Journal of Bioenergetics and Biomembranes . 36 (4): 303–07. doi : 10.1023/b:jobb.0000041758.20071.19 . PMID 15377862 . S2CID 39221153 .
- Olivera, Baldomero M.; Cruz, Lourdes J.; De Santos, Victoria; LeCheminant, Garth; Griffin, David; Zeikus, Regina; McIntosh, J. Michael; Galyan, Robert; Varga, Janos (1987). "Neuronala kalciumkanalantagonister. Diskriminering mellan kalciumkanalsubtyper med användning av .omega.-conotoxin från Conus Magus Venom". Biokemi . 26 (8): 2086–090. doi : 10.1021/bi00382a004 . PMID 2441741 .
- Olney, John W (2002). "Nya insikter och nya frågor inom utvecklingsneurotoxicologi". Neurotoxikologi . 23 (6): 659–68. doi : 10.1016/s0161-813x(01)00092-4 . PMID 12520755 .
- Pirazzini, Marco, Ornella Rossetto, Paolo Bolognese, Clifford C. Shone och Cesare Montecucco (2011) "Dubbel förankring till membranet och intakt interkedjedisulfidbindning krävs för det låga pH-inducerade inträdet av stelkramp och botulinumneurotoxiner i neuroner. " Cellulär mikrobiologi: Nej. Skriv ut.
- Rabe, Ausma; Han Lee, Moon; Shek, Judy; Wisniewski, Henryk M. (1982). "Inlärningsunderskott hos omogna kaniner med aluminiuminducerade neurofibrillära förändringar". Experimentell neurologi . 76 (2): 441–46. doi : 10.1016/0014-4886(82)90220-5 . PMID 6896495 . S2CID 7495252 .
- Rocha, RA; Gimeno-Alcaniz, JV; Martín-Ibanez, Raymond; Canals, JM; Vélez, D.; Devesa, V. (2011). "Arsenik och fluor inducerar neural stamcellsapoptos". Toxikologibrev . 203 (3): 237–44. doi : 10.1016/j.toxlet.2011.03.023 . PMID 21439358 .
- Roed, A (1989). "Effekterna av tetraetylammonium under ryckningar och tetanisk stimulering av phrenic nerve diafragma förberedelse i råttan". Neurofarmakologi . 28 (6): 585–92. doi : 10.1016/0028-3908(89)90137-8 . PMID 2547180 . S2CID 1916154 .
- Rothman, S.; Thurston, J.; Hauhart, R. (1987). "Försenad neurotoxicitet av excitatoriska aminosyror in vitro". Neurovetenskap . 22 (2): 471–80. doi : 10.1016/0306-4522(87)90347-2 . PMID 3670595 . S2CID 6038419 .
- Schlesinger, Edward B (1946). "Curare en recension av dess terapeutiska effekter och deras fysiologiska grund". American Journal of Medicine . 1 (5): 518–30. doi : 10.1016/0002-9343(46)90073-3 . PMID 21001466 .
- Siebler, M.; Koller, H.; Schmalenbach, C.; Muller, H. (1988). "GABA-aktiverade kloridströmmar i odlade hippocampus- och septalregionneuroner från råtta kan hämmas av Curare och Atropin". Neurovetenskapsbrev . 93 (2–3): 220–24. doi : 10.1016/0304-3940(88)90085-7 . PMID 2468110 . S2CID 10645685 .
- Simpson, LL (1986). "Molekylär farmakologi av botulinumtoxin och stelkrampstoxin". Årlig översyn av farmakologi och toxikologi . 26 (1): 427–53. doi : 10.1146/annurev.pharmtox.26.1.427 . PMID 3521461 .
- Soroceanu, Liliana; Gillespie, Yancey; Khazaeli, MB; Sontheimer, Harold (1998). "Användning av klorotoxin för inriktning av primära hjärntumörer". Cancerforskning . 58 (21): 4871–879. PMID 9809993 .
- Spencer PS, Schaumburg HH, Ludolph AC (Eds) (2000) Experimentell och klinisk neurotoxicologi. Oxford University Press, Oxford, s. 1310.
- Stanfield, Peter R (1983). "Tetraetylammoniumjoner och kaliumpermeabiliteten hos exciterbara celler". Recensioner av fysiologi, biokemi och farmakologi . 97 : 1–49. doi : 10.1007/bfb0035345 . ISBN 978-3-540-11701-8. PMID 6306751 .
- Stewart I, Seawright AA, Shaw GR (2008). "Cyanobakteriell förgiftning hos boskap, vilda däggdjur och fåglar – en översikt" ( PDF) . Cyanobakteriella skadliga algblomningar: vetenskapens och forskningsbehoven . Framsteg inom experimentell medicin och biologi. 619 : 613-637. doi : 10.1007/978-0-387-75865-7_28 . ISBN 978-0-387-75864-0. PMID 18461786 .
- Taffe, MA; Kotzebue, RW; Crean, RD; Crawford, EF; Edwards, S.; Mandyam, CD (2010). "Från omslaget: Långvarig minskning av hippocampus neurogenes genom alkoholkonsumtion hos unga icke-mänskliga primater" . Proceedings of the National Academy of Sciences . 107 (24): 11104–1109. Bibcode : 2010PNAS..10711104T . doi : 10.1073/pnas.0912810107 . PMC 2890755 . PMID 20534463 .
- Takadera, Tsuneo; Suzuki, Risa; Mohri, Tetsuro (1990). "Skydd av etanol av kortikala neuroner från N-metyl-d-aspartat-inducerad neurotoxicitet är associerat med att blockera kalciuminflöde". Hjärnforskning . 537 (1–2): 109–14. doi : 10.1016/0006-8993(90)90346-d . PMID 1982237 . S2CID 22160700 .
- Thyagarajan, B.; Krivitskaya, N.; Potian, JG; Hognason, K.; Garcia, CC; McArdle, JJ (2009). "Capsaicin skyddar mus neuromuskulära knutpunkter från de neuroralytiska effekterna av botulinum neurotoxin A." Journal of Pharmacology and Experimental Therapeutics . 331 (2): 361–71. doi : 10.1124/jpet.109.156901 . PMC 2775269 . PMID 19654265 .
- Tymianski, Michael; Charlton, Milton P.; Carlen, Peter L.; Tator, Charles H. (2003). "Källspecificitet för tidig kalciumneurotoxicitet i odlade embryonala spinalneuroner" . Journal of Neuroscience . 13 (5): 2095–104. doi : 10.1523/JNEUROSCI.13-05-02085.1993 . PMC 6576557 . PMID 8097530 .
- Tsetlin, VI; Hucho, F. (2004). "Toxiner för orm och snigel som verkar på nikotinacetylkolinreceptorer: grundläggande aspekter och medicinska tillämpningar" . FEBS Bokstäver . 557 (1–3): 9–13. doi : 10.1016/s0014-5793(03)01454-6 . PMID 14741333 .
- USEPA (United States Environmental Protection Agency) (1998) riktlinjer för test av hälsoeffekter. OPPTS 870.6200. Batteri för screening av neurotoxicitet. Washington DC, USEPA.
- Vahidnia, A., GB Van Der Voet och FA De Wolff (2007) "Arsenic Neurotoxicity A Review." Human & Experimental Toxicology, 26 (10) : 823–32.
- Walton, J (2006). "Aluminium i hippocampus neuroner från människor med Alzheimers sjukdom". Neurotoxikologi . 27 (3): 385–94. doi : 10.1016/j.neuro.2005.11.007 . PMID 16458972 .
- Widmaier, Eric P., Hershel Raff, Kevin T. Strang och Arthur J. Vander (2008) Vanders Human Physiology: The Mechanisms of Body Function. Boston: McGraw-Hill Higher Education.
- Williamson, Lura C.; Halpern, Jane L.; Montecucco, Cesare; Brown, JE; Neale, Elaine A. (1996). "Clostridial neurotoxiner och substratproteolys i intakta neuroner" . Journal of Biological Chemistry . 271 (13): 7694–699. doi : 10.1074/jbc.271.13.7694 . PMID 8631808 .
- Wood SA; Rasmussen JP; Holland PT; Campbell R.; Crowe ALM (2007). "Första rapporten om Cyanotoxin Anatoxin-A från Aphanizomenon issatschenkoi (cyanobakterier)". Journal of Physology . 43 (2): 356–365. doi : 10.1111/j.1529-8817.2007.00318.x . S2CID 84284928 .
- Yamada, Kiyofumi; Tanaka, Tomoko; Han, Daiken; Senzaki, Kouji; Kameyama, Tsutomu; Nabeshima, Toshitaka (1999). "Skyddande effekter av Idebenone och α-tokoferol på β-amyloid-(1-42)-inducerad inlärnings- och minnesbrist hos råttor: Implikation av oxidativ stress i β-amyloid-inducerad neurotoxicitet in vivo". European Journal of Neuroscience . 11 (1): 83–90. doi : 10.1046/j.1460-9568.1999.00408.x . PMID 9987013 . S2CID 84408095 .
- Yan; Du, Shi; Chen, Xi; Fu, Jin; Chen, Ming; Zhu, Huaijie; Roher, Alex; Slattery, Timothy; Zhao, Lei; Nagashima, Mariko; Morser, John; Migheli, Antonio; Nawroth, Peter; Stern, David; Marie Schmidt, Ann (1996). "RAGE och amyloid-β-peptidneurotoxicitet vid Alzheimers sjukdom". Naturen . 382 (6593): 685–91. Bibcode : 1996Natur.382..685Y . doi : 10.1038/382685a0 . PMID 8751438 . S2CID 4372023 .
- Yang, X (2007) Förekomst av det cyanobakteriella neurotoxinet, anatoxin-a, i New York State vatten ProQuest. ISBN 978-0-549-35451-2 .
- Zhang, J.; Dawson, V.; Dawson, T.; Snyder, S. (1994). "Kväveoxidaktivering av poly(ADP-ribos) syntetas i neurotoxicitet". Vetenskap . 263 (5147): 687–89. Bibcode : 1994Sci...263..687Z . doi : 10.1126/science.8080500 . PMID 8080500 .
Vidare läsning
- Brain Facts Book på The Society for Neuroscience
- Neurovetenskapstexter vid University of Texas Medical School
- In Vitro Neurotoxicology: An Introduction at Springerlink
- Biologi av NMDA-receptorn vid NCBI
- Advances in the Neuroscience of Addiction, 2: a upplagan vid NCBI
externa länkar
- Environmental Protection Agency vid United States Environmental Protection Agency
- Alkohol och alkoholism vid Oxford Medical Journals
- Neurotoxikologi vid Elsevier Journals
- Neurotoxininstitutet vid Neurotoxininstitutet
- [1] Neurotoxiner] på Toxipedia