Agerande potential - Action potential

Inom fysiologin inträffar en åtgärdspotential ( AP ) när membranpotentialen hos en specifik cellplats snabbt stiger och faller: denna depolarisering får sedan intilliggande platser att depolarisera på samma sätt. Handlingspotentialer förekommer i flera typer av djurceller , så kallade exciterbara celler, som inkluderar neuroner , muskelceller , endokrina celler och i vissa växtceller .
I neuroner spelar aktionspotentialer en central roll i cell-till-cell-kommunikation genom att tillhandahålla-eller med avseende på saltatorisk ledning , hjälpa till-spridning av signaler längs neuronets axon mot synaptiska boutoner belägna vid ändarna av ett axon; dessa signaler kan sedan ansluta till andra neuroner vid synapser eller till motorceller eller körtlar. I andra typer av celler är deras huvudsakliga funktion att aktivera intracellulära processer. I muskelceller är till exempel en åtgärdspotential det första steget i händelsekedjan som leder till sammandragning. I betaceller i de bukspottkörteln , de provocera frisättning av insulin . Handlingspotentialer i neuroner är också kända som " nervimpulser " eller " spikar ", och den tidsmässiga sekvensen av åtgärdspotentialer som genereras av en neuron kallas dess " spiktåg ". En neuron som avger en åtgärdspotential, eller nervimpuls, sägs ofta "elda".
Handlingspotentialer genereras av speciella typer av spänningsstyrda jonkanaler inbäddade i cellens plasmamembran . Dessa kanaler stängs när membranpotentialen är nära cellens (negativa) vilopotential , men de börjar snabbt öppna sig om membranpotentialen ökar till en exakt definierad tröskelspänning, vilket depolariserar transmembranpotentialen. När kanalerna öppnas tillåter de ett inåtflöde av natriumjoner , vilket förändrar den elektrokemiska gradienten, vilket i sin tur ger en ytterligare ökning av membranpotentialen mot noll. Detta gör att fler kanaler öppnas, vilket ger en större elektrisk ström över cellmembranet och så vidare. Processen fortsätter explosivt tills alla tillgängliga jonkanaler är öppna, vilket resulterar i ett stort uppsving i membranpotentialen. Den snabba tillströmningen av natriumjoner får plasmamembranets polaritet att vända och jonkanalerna inaktiveras sedan snabbt. När natriumkanalerna stängs kan natriumjoner inte längre komma in i neuron, och de transporteras sedan aktivt tillbaka ur plasmamembranet. Kaliumkanaler aktiveras sedan och det finns en ström utåt av kaliumjoner som återför den elektrokemiska gradienten till viloläge. Efter att en åtgärdspotential har inträffat sker ett övergående negativt skifte, kallat efterhyperpolarisering .
I djurceller finns det två primära typer av åtgärdspotentialer. Den ena typen genereras av spänningsstyrda natriumkanaler , den andra av spänningsstyrda kalciumkanaler . Natriumbaserade åtgärdspotentialer håller vanligtvis under en millisekund, men kalciumbaserade åtgärdspotentialer kan vara i 100 millisekunder eller längre. I vissa typer av neuroner ger långsamma kalciumspikar drivkraften för ett långt utbrott av snabbt utsända natriumspikar. I hjärtmuskelceller , å andra sidan, ger en initial snabb natriumspik en "primer" för att provocera den snabba starten av en kalciumspik, som sedan producerar muskelsammandragning.
Översikt
Nästan alla cellmembran hos djur, växter och svampar upprätthåller en spänningsskillnad mellan utsidan och insidan av cellen, kallad membranpotential . En typisk spänning över ett djurcellmembran är −70 mV. Det betyder att det inre av cellen har en negativ spänning i förhållande till utsidan. I de flesta typer av celler förblir membranpotentialen vanligtvis ganska konstant. Vissa typer av celler är emellertid elektriskt aktiva i den meningen att deras spänningar fluktuerar över tiden. I vissa typer av elektriskt aktiva celler, inklusive neuroner och muskelceller, har spänningsfluktuationerna ofta formen av en snabb uppåtsteg följt av ett snabbt fall. Dessa upp-och-ned-cykler är kända som åtgärdspotentialer . I vissa typer av neuroner sker hela upp-och-ned-cykeln på några tusendels sekunder. I muskelceller varar en typisk åtgärdspotential ungefär en femtedel av en sekund. I vissa andra typer av celler och växter kan en åtgärdspotential vara tre sekunder eller mer.
En cells elektriska egenskaper bestäms av strukturen i membranet som omger den. Ett cellmembran består av ett lipid tvåskikt av molekyler i vilka större proteinmolekyler är inbäddade. Lipid -tvåskiktet är mycket motståndskraftigt mot rörelse av elektriskt laddade joner, så det fungerar som en isolator. De stora membraninbäddade proteinerna ger däremot kanaler genom vilka joner kan passera över membranet. Handlingspotentialer drivs av kanalproteiner vars konfiguration växlar mellan stängda och öppna tillstånd som en funktion av spänningsskillnaden mellan cellens inre och yttre. Dessa spänningskänsliga proteiner är kända som spänningsstyrda jonkanaler .
Process i en typisk neuron

Alla celler i djurkroppsvävnader är elektriskt polariserade - med andra ord, de bibehåller en spänningsskillnad över cellens plasmamembran , känd som membranpotentialen . Denna elektriska polarisering är resultatet av ett komplext samspel mellan proteinstrukturer inbäddade i membranet som kallas jonpumpar och jonkanaler . I neuroner varierar typerna av jonkanaler i membranet vanligtvis över olika delar av cellen, vilket ger dendriter , axon och cellkropp olika elektriska egenskaper. Som ett resultat kan vissa delar av ett neurons membran vara upphetsade (kan generera aktionspotentialer), medan andra inte är det. Nyligen genomförda studier har visat att den mest exciterande delen av ett neuron är delen efter axonbacken (punkten där axon lämnar cellkroppen), som kallas det initiala segmentet, men axon och cellkropp är också exciterande i de flesta fall .
Varje exciterande membranplåster har två viktiga nivåer av membranpotential: vilopotentialen , vilket är det värde membranpotentialen upprätthåller så länge ingenting stör cellen, och ett högre värde som kallas tröskelpotentialen . Vid axonbacken i en typisk neuron är vilopotentialen cirka –70 millivolt (mV) och tröskelpotentialen är cirka –55 mV. Synaptiska ingångar till en neuron gör att membranet depolariseras eller hyperpolariseras ; det vill säga de får membranpotentialen att stiga eller falla. Handlingspotentialer utlöses när tillräckligt med depolarisering ackumuleras för att föra membranpotentialen upp till tröskeln. När en åtgärdspotential utlöses, skjuter membranpotentialen plötsligt uppåt och skjuter sedan lika plötsligt tillbaka nedåt, ofta slutande under vilonivån, där den kvarstår under en viss tid. Handlingspotentialens form är stereotyp; detta innebär att stigningen och fallet vanligtvis har ungefär samma amplitud och tidsförlopp för alla aktionspotentialer i en given cell. (Undantag diskuteras senare i artikeln). I de flesta neuroner sker hela processen på ungefär en tusendels sekund. Många typer av neuroner avger ständigt potentialer med en hastighet på upp till 10–100 per sekund. Vissa typer är dock mycket tystare och kan ta några minuter eller längre utan att ge några åtgärdspotentialer.
Biofysisk grund
Handlingspotentialer beror på närvaron i cellens membran av speciella typer av spänningsstyrda jonkanaler . En spänningsstyrd jonkanal är ett transmembranprotein som har tre nyckelegenskaper:
- Det kan anta mer än en konformation.
- Minst en av konformationerna skapar en kanal genom membranet som är genomsläpplig för specifika jontyper.
- Övergången mellan konformationer påverkas av membranpotentialen.
Således tenderar en spänningsstyrd jonkanal att vara öppen för vissa värden av membranpotentialen och stängd för andra. I de flesta fall är emellertid förhållandet mellan membranpotential och kanaltillstånd sannolikt och innebär en tidsfördröjning. Jonkanaler växlar mellan konformationer vid oförutsägbara tider: Membranpotentialen bestämmer övergångshastigheten och sannolikheten per tidsenhet för varje typ av övergång.
Spänningsstyrda jonkanaler kan producera aktionspotentialer eftersom de kan ge upphov till positiva återkopplingsslingor : Membranpotentialen styr jonkanalernas tillstånd, men jonkanalernas tillstånd styr membranpotentialen. Således kan en ökning av membranpotentialen i vissa situationer orsaka att jonkanaler öppnas och därigenom orsaka en ytterligare ökning av membranpotentialen. En åtgärdspotential uppstår när denna positiva återkopplingscykel ( Hodgkin -cykeln ) fortskrider explosivt. Aktionspotentialens tid och amplitudbana bestäms av de biofysiska egenskaperna hos de spänningsstyrda jonkanalerna som producerar den. Det finns flera typer av kanaler som kan producera den positiva feedback som krävs för att generera en åtgärdspotential. Spänningsstyrda natriumkanaler är ansvariga för de snabba åtgärdspotentialerna som är involverade i nervledning. Långsammare åtgärdspotentialer i muskelceller och vissa typer av neuroner genereras av spänningsstyrda kalciumkanaler. Var och en av dessa typer finns i flera varianter, med olika spänningskänslighet och olika tidsdynamik.
Den mest intensivt studerade typen av spänningsberoende jonkanaler innefattar natriumkanalerna som är involverade i snabb nervledning. Dessa är ibland kända som Hodgkin-Huxley-natriumkanaler eftersom de först kännetecknades av Alan Hodgkin och Andrew Huxley i deras Nobelprisvinnande studier av biofysiken i åtgärdspotentialen, men kan mer bekvämt kallas Na V- kanaler. ("V" står för "spänning".) En Na V -kanal har tre möjliga tillstånd, kända som inaktiverade , aktiverade och inaktiverade . Kanalen är endast permeabel för natriumjoner när den är i aktiverat tillstånd. När membranpotentialen är låg, tillbringar kanalen större delen av sin tid i inaktiverat (stängt) tillstånd. Om membranpotentialen höjs över en viss nivå, visar kanalen ökad sannolikhet att övergå till det aktiverade (öppna) tillståndet. Ju högre membranpotentialen är desto större är sannolikheten för aktivering. När en kanal väl har aktiverats kommer den så småningom att övergå till det inaktiverade (stängda) tillståndet. Den tenderar då att förbli inaktiverad under en tid, men om membranpotentialen blir låg igen kommer kanalen så småningom att gå tillbaka till det inaktiverade tillståndet. Under en åtgärdspotential går de flesta kanaler av denna typ genom en cykel inaktiverad → aktiverad → inaktiverad → inaktiverad . Detta är dock bara befolkningens genomsnittliga beteende - en enskild kanal kan i princip göra en övergång när som helst. Sannolikheten för att en kanal övergår från det inaktiverade tillståndet direkt till det aktiverade tillståndet är dock mycket låg: En kanal i det inaktiverade tillståndet är eldfast tills den har övergått tillbaka till det deaktiverade tillståndet.
Resultatet av allt detta är att kinetiken för Na V- kanalerna styrs av en övergångsmatris vars hastigheter är spänningsberoende på ett komplicerat sätt. Eftersom dessa kanaler själva spelar en viktig roll för att bestämma spänningen, kan systemets globala dynamik vara ganska svår att räkna ut. Hodgkin och Huxley närmade sig problemet genom att utveckla en uppsättning differentialekvationer för parametrarna som styr jonkanaltillstånden, kända som Hodgkin-Huxley-ekvationerna . Dessa ekvationer har omfattande modifierats av senare forskning, men utgör utgångspunkten för de flesta teoretiska studier av potentiell biofysik.
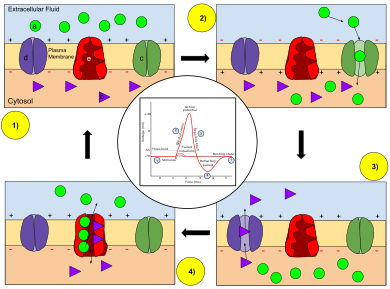
Nyckel: a) Natrium (Na + ) jon. b) Kalium (K + ) jon. c) Natriumkanal. d) Kaliumkanal. e) Natrium-kaliumpump.
I stadierna av en åtgärdspotential förändras permeabiliteten hos neuronets membran. Vid viloläge (1) har natrium- och kaliumjoner begränsad förmåga att passera genom membranet, och neuronet har en negativ negativ laddning inuti. När åtgärdspotentialen väl har aktiverats aktiverar depolariseringen (2) av neuronet natriumkanaler, så att natriumjoner kan passera genom cellmembranet in i cellen, vilket resulterar i en positiv nettoladdning i neuron i förhållande till den extracellulära vätskan. Efter att åtgärdspotentialtoppen nåtts börjar neuronen repolarisering (3), där natriumkanalerna stängs och kaliumkanaler öppnas, vilket gör att kaliumjoner kan passera membranet till den extracellulära vätskan och återföra membranpotentialen till ett negativt värde. Slutligen finns det en eldfast period (4), under vilken de spänningsberoende jonkanalerna inaktiveras medan Na + och K + joner återgår till sina viloläge fördelningar över membranet (1), och neuronen är redo att upprepa process för nästa åtgärdspotential.
När membranpotentialen ökar öppnas natriumjonkanaler , vilket gör att natriumjoner kan komma in i cellen. Detta följs av öppnandet av kaliumjonkanaler som tillåter utträde av kaliumjoner från cellen. Inåtflödet av natriumjoner ökar koncentrationen av positivt laddade katjoner i cellen och orsakar depolarisering, där cellens potential är högre än cellens vilopotential . Natriumkanalerna stängs vid toppen av åtgärdspotentialen, medan kalium fortsätter att lämna cellen. Utflödet av kaliumjoner minskar membranpotentialen eller hyperpolariserar cellen. För små spänningsökningar från vila överstiger kaliumströmmen natriumströmmen och spänningen återgår till sitt normala vilovärde, vanligtvis −70 mV. Men om spänningen ökar förbi en kritisk tröskel, vanligtvis 15 mV högre än vilovärdet, dominerar natriumströmmen. Detta resulterar i ett springande tillstånd där den positiva återkopplingen från natriumströmmen aktiverar ännu fler natriumkanaler. Således avfyras cellen och producerar en åtgärdspotential. Frekvensen vid vilken en neuron framkallar åtgärdspotentialer kallas ofta för en avfyringshastighet eller neural avfyrningshastighet .
Strömmar som alstras av öppnandet av spänningsstyrda kanaler under en åtgärdspotential är vanligtvis betydligt större än den initiala stimulerande strömmen. Således bestäms amplituden, varaktigheten och formen av åtgärdspotentialen till stor del av egenskaperna hos det exciterbara membranet och inte amplituden eller stimulans varaktighet. Denna allt-eller-ingenting- egenskap hos åtgärdspotentialen skiljer den från graderade potentialer såsom receptorpotentialer , elektrotoniska potentialer , subtröskelmembranpotentialoscillationer och synaptiska potentialer , som skala med stimulans storlek. Det finns många olika typer av åtgärdspotentialer i många celltyper och cellfack som bestäms av typerna av spänningskanaler, läckekanaler , kanalfördelningar, jonkoncentrationer, membrankapacitans, temperatur och andra faktorer.
De huvudsakliga jonerna som är involverade i en åtgärdspotential är natrium- och kaliumkatjoner; natriumjoner kommer in i cellen och kaliumjoner lämnar och återställer jämvikten. Relativt få joner behöver korsa membranet för att membranspänningen ska förändras drastiskt. De joner som byts ut under en åtgärdspotential gör därför en försumbar förändring av de inre och yttre jonkoncentrationerna. De få joner som korsas pumpas ut igen genom den kontinuerliga verkan av natrium -kaliumpumpen , som med andra jontransportörer upprätthåller det normala förhållandet mellan jonkoncentrationer över membranet. Kalcium- katjoner och klorid anjoner är involverade i några typer av aktionspotentialer, såsom hjärtats aktionspotential och verkningspotentialen i den encelliga algen najadbägare , respektive.
Även om åtgärdspotentialer genereras lokalt på fläckar av exciterbart membran, kan de resulterande strömmarna utlösa åtgärdspotentialer på angränsande membransträckor, vilket utfäller en domino-liknande förökning. I motsats till passiv spridning av elektriska potentialer ( elektrotonisk potential ) genereras åtgärdspotentialer på nytt längs upphetsbara membransträckor och sprider sig utan sönderfall. Myeliniserade sektioner av axoner är inte exciterbara och producerar inte åtgärdspotentialer och signalen sprids passivt som elektrotonisk potential . Omyeliniserade fläckar med jämna mellanrum, kallade Ranviers noder , genererar åtgärdspotentialer för att öka signalen. Denna typ av signalutbredning, känd som saltatorisk ledning , ger en gynnsam avvägning av signalhastighet och axondiameter. Depolarisering av axonterminaler utlöser i allmänhet frisläppandet av signalsubstans i den synaptiska klyftan . Dessutom har bakpropagerande åtgärdspotentialer registrerats i dendritterna av pyramidala neuroner , som är allestädes närvarande i neocortex. Dessa anses ha en roll i spik-timingberoende plasticitet .
I Hodgkin -Huxley -membrankapacitansmodellen var överföringshastigheten för en åtgärdspotential odefinierad och man antog att intilliggande områden depolariserades på grund av frigjord jonstörning med närliggande kanaler. Mätningar av jondiffusion och radier har sedan visat att detta inte är möjligt. Dessutom motsatte motsägelsefulla mätningar av entropiförändringar och tidpunkter kapacitansmodellen som att den agerade ensam. Alternativt ger Gilbert Lings adsorptionshypotes att membranpotentialen och åtgärdspotentialen för en levande cell beror på adsorptionen av mobiljoner till adsorptionsställen för celler.
Mognad av de elektriska egenskaperna hos åtgärdspotentialen
En neurons förmåga att generera och sprida en åtgärdspotential förändras under utvecklingen . Hur mycket membranpotentialen hos en neuron ändras som ett resultat av en strömimpuls är en funktion av membranets ingångsmotståndet . När en cell växer läggs fler kanaler till membranet, vilket orsakar en minskning av inmatningsmotståndet. En mogen neuron genomgår också kortare förändringar i membranpotential som svar på synaptiska strömmar. Neuroner från en iller lateral geniculate kärna har en längre tidskonstant och större spänningsböjning vid P0 än de gör vid P30. En konsekvens av den minskande aktionspotentialtiden är att signalens trohet kan bevaras som svar på högfrekvent stimulering. Omogna neuroner är mer benägna att synaptisk depression än potentiering efter högfrekvent stimulering.
I den tidiga utvecklingen av många organismer bärs faktiskt verkningspotentialen initialt av kalciumström snarare än natriumström . Den ingående och utgående kinetik av kalciumkanaler under utveckling är långsammare än de för de spänningskänsliga natriumkanaler som kommer att bära aktionspotentialen i de mogna neuroner. De längre öppettiderna för kalciumkanalerna kan leda till åtgärdspotentialer som är betydligt långsammare än de hos mogna neuroner. Xenopus -neuroner har initialt åtgärdspotentialer som tar 60–90 ms. Under utvecklingen minskar denna tid till 1 ms. Det finns två orsaker till denna drastiska minskning. Först transporteras den inåtgående strömmen främst av natriumkanaler. För det andra, den fördröjda likriktaren , en kaliumkanalström , ökar till 3,5 gånger sin initiala styrka.
För att övergången från en kalciumberoende åtgärdspotential till en natriumberoende åtgärdspotential ska kunna fortsätta måste nya kanaler läggas till membranet. Om Xenopus -neuroner odlas i en miljö med RNA -syntes eller proteinsynteshämmare förhindras denna övergång. Även cellens elektriska aktivitet kan spela en roll för kanaluttryck. Om åtgärdspotentialer i Xenopus -myocyter blockeras, förhindras eller fördröjs den typiska ökningen av natrium- och kaliumströmtäthet.
Denna mognad av elektriska egenskaper ses över alla arter. Xenopus -natrium- och kaliumströmmar ökar drastiskt efter att en neuron har gått igenom sin sista mitosfas . Natriumströmtätheten hos råtta kortikala neuroner ökar med 600% inom de två första postnatala veckorna.
Neurotransmission
En neurons anatomi
| Nervcell |
|---|
Flera typer av celler stöder en åtgärdspotential, till exempel växtceller, muskelceller och de specialiserade cellerna i hjärtat (där hjärtaktionspotentialen uppstår ). Den främsta exciterbara cellen är dock neuronen , som också har den enklaste mekanismen för åtgärdspotentialen.
Neuroner är elektriskt exciterbara celler som i allmänhet består av en eller flera dendriter, en enda soma , en enda axon och en eller flera axonterminaler . Dendriter är cellulära projektioner vars primära funktion är att ta emot synaptiska signaler. Deras utskott, kända som dendritiska ryggar , är utformade för att fånga neurotransmittorerna som släpps ut av den presynaptiska neuronen. De har en hög koncentration av ligand-gated jon kanaler . Dessa taggar har en tunn hals som förbinder ett lökformigt utsprång med dendriten. Detta säkerställer att förändringar som inträffar inuti ryggraden är mindre benägna att påverka de närliggande ryggraden. Den dendritiska ryggraden kan, med sällsynta undantag (se LTP ), fungera som en oberoende enhet. Dendriterna sträcker sig från soman, som rymmer kärnan , och många av de "normala" eukaryota organellerna. Till skillnad från ryggraden är ytan på soman befolkad av spänningsaktiverade jonkanaler. Dessa kanaler hjälper till att överföra signalerna som genereras av dendriterna. Axon Hillock kommer ut från soman . Denna region kännetecknas av att den har en mycket hög koncentration av spänningsaktiverade natriumkanaler. I allmänhet anses det vara spikinitieringszonen för åtgärdspotentialer, det vill säga utlösningszonen . Flera signaler som genereras vid ryggraden och som överförs av soman konvergerar alla hit. Omedelbart efter axonbacken är axonen. Detta är ett tunt rörformat utsprång som reser bort från soman. Axonet är isolerad av en myelinhölje. Myelin består av antingen Schwann -celler (i det perifera nervsystemet) eller oligodendrocyter (i centrala nervsystemet), som båda är typer av glialceller . Även om gliaceller inte är involverade i överföringen av elektriska signaler, kommunicerar de och ger viktigt biokemiskt stöd till neuroner. För att vara specifik, sveper myelin flera gånger runt det axonala segmentet och bildar ett tjockt fettskikt som hindrar joner från att komma in eller fly från axonet. Denna isolering förhindrar betydande signalförfall samt säkerställer snabbare signalhastighet. Denna isolering har emellertid begränsningen att inga kanaler kan finnas på axonets yta. Det finns därför regelbundet åtskilda membranfläckar som inte har någon isolering. Dessa noder i Ranvier kan anses vara "mini axon hillocks", eftersom deras syfte är att öka signalen för att förhindra signifikant signalförfall. I den längsta änden förlorar axonen sin isolering och börjar förgrena sig till flera axonterminaler . Dessa presynaptiska terminaler, eller synaptiska boutoner, är ett specialiserat område inom axonen i den presynaptiska cellen som innehåller neurotransmittorer inneslutna i små membranbundna sfärer som kallas synaptiska vesiklar .
Initiering
Innan man överväger utbredning av åtgärdspotentialer längs axoner och deras avslutning vid de synaptiska knopparna är det bra att överväga de metoder med vilka åtgärdspotentialer kan initieras vid axonbacken . Grundkravet är att membranspänningen vid backen höjs över tröskeln för avfyrning. Det finns flera sätt på vilka denna depolarisering kan ske.

Dynamik
Handlingspotentialer initieras oftast av excitatoriska postsynaptiska potentialer från en presynaptisk neuron. Normalt frigörs signalsubstansmolekyler av den presynaptiska neuronen . Dessa signalsubstanser binder sedan till receptorer på den postsynaptiska cellen. Denna bindning öppnar olika typer av jonkanaler . Denna öppning har den ytterligare effekten att förändra cellmembranets lokala permeabilitet och därmed membranpotentialen. Om bindningen ökar spänningen (depolariserar membranet) är synapsen excitatorisk. Om bindningen dock minskar spänningen (hyperpolariserar membranet) är det hämmande. Oavsett om spänningen ökas eller minskas, sprids förändringen passivt till närliggande delar av membranet (som beskrivs av kabelekvationen och dess förbättringar). Typiskt avtar spänningsstimulansen exponentiellt med avståndet från synapsen och med tiden från bindningen av signalsubstansen. En del av en excitatorisk spänning kan nå axonbacken och kan (i sällsynta fall) depolarisera membranet tillräckligt för att framkalla en ny åtgärdspotential. Mer typiskt måste excitatoriska potentialer från flera synapser arbeta tillsammans på nästan samma gång att provocera fram en ny åtgärd potential. Deras gemensamma ansträngningar kan dock motarbetas av de motverkande hämmande postsynaptiska potentialerna .
Neurotransmission kan också ske genom elektriska synapser . På grund av den direkta kopplingen mellan exciterbara celler i form av gap -övergångar kan en åtgärdspotential överföras direkt från en cell till nästa i båda riktningarna. Det fria flödet av joner mellan celler möjliggör snabb icke-kemiskt förmedlad överföring. Åtgärdande kanaler säkerställer att åtgärdspotentialer bara rör sig i en riktning genom en elektrisk synaps. Elektriska synapser finns i alla nervsystem, inklusive den mänskliga hjärnan, även om de är en distinkt minoritet.
"Allt-eller-ingen" -princip
Den amplitud av en aktionspotential är oberoende av den mängd ström som producerade den. Med andra ord skapar större strömmar inte större aktionspotentialer. Därför sägs att åtgärdspotentialer är alla-eller-inga signaler, eftersom antingen de inträffar helt eller så inträffar de inte alls. Detta står i kontrast till receptorpotentialer , vars amplituder är beroende av intensiteten hos en stimulans. I båda fallen är frekvensen av åtgärdspotentialer korrelerad med intensiteten hos en stimulans.
Sensoriska neuroner
I sensoriska neuroner kopplas en yttre signal såsom tryck, temperatur, ljus eller ljud till öppning och stängning av jonkanaler , vilket i sin tur förändrar membranets joniska permeabilitet och dess spänning. Dessa spänningsförändringar kan återigen vara excitatoriska (depolariserande) eller hämmande (hyperpolariserande) och i vissa sensoriska neuroner kan deras kombinerade effekter depolarisera axonbacken tillräckligt för att provocera aktionspotentialer. Några exempel på människor inkluderar luktreceptorn neuron och Meissners corpuscle , som är kritiska för luktsinne respektive beröring . Emellertid omvandlar inte alla sensoriska neuroner sina yttre signaler till åtgärdspotentialer; vissa har inte ens ett axon. Istället kan de omvandla signalen till frisläppandet av en signalsubstans , eller till kontinuerliga graderade potentialer , var och en av dem kan stimulera efterföljande neuron (er) till att avfyra en aktionspotential. För illustration, i det mänskliga örat , omvandlar hårceller det inkommande ljudet till öppning och stängning av mekaniskt gateda jonkanaler , vilket kan orsaka att neurotransmittormolekyler frigörs. På liknande sätt, i den mänskliga näthinnan , producerar de initiala fotoreceptorcellerna och nästa cellskikt (innefattande bipolära celler och horisontella celler ) inte åtgärdspotentialer; bara några amakrinceller och det tredje lagret, ganglioncellerna , ger aktionspotentialer, som sedan färdas upp i synnerven .
Pacemakerpotentialer
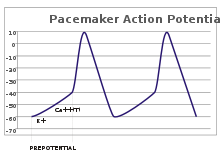
I sensoriska neuroner uppstår åtgärdspotentialer från en yttre stimulans. Vissa upphetsbara celler kräver emellertid ingen sådan stimulans till eld: De depolariserar spontant deras axonbacka och avfyrar potentialer med en regelbunden hastighet, som en intern klocka. Spänningsspåren för sådana celler är kända som pacemakerpotentialer . De hjärtpacemakercellerna i sinusknutan i hjärtat ger ett bra exempel. Även om sådana pacemakerpotentialer har en naturlig rytm , kan den justeras med yttre stimuli; till exempel kan hjärtfrekvensen ändras av läkemedel såväl som signaler från de sympatiska och parasympatiska nerverna. De yttre stimuli orsakar inte cellens repetitiva avfyrning, utan ändrar bara dess timing. I vissa fall kan regleringen av frekvensen vara mer komplex, vilket leder till handlingsmönster, till exempel sprängning .
Faser
Handlingspotentialens förlopp kan delas in i fem delar: stigningsfasen, toppfasen, fallande fasen, underskridningsfasen och den eldfasta perioden. Under stigande fas depolariseras membranpotentialen (blir mer positiv). Den punkt där depolarisering stoppas kallas toppfasen. I detta skede når membranpotentialen maximalt. Därefter sker en fallande fas. Under detta skede blir membranpotentialen mer negativ och återvänder mot vilopotential. Underskottet, eller efterhyperpolarisering , fas är den period under vilken membranpotentialen tillfälligt blir mer negativt laddad än när den är i vila (hyperpolariserad). Slutligen kallas den tid under vilken en efterföljande åtgärdspotential är omöjlig eller svår att avfyra den eldfasta perioden , som kan överlappa med de andra faserna.
Handlingspotentialens förlopp bestäms av två kopplade effekter. Först, spänningskänsliga jonkanaler öppna och stänga som svar på förändringar i membranspänning V m . Detta förändrar membranets permeabilitet för dessa joner. Andra, enligt Goldman ekvationen , denna förändring i permeabilitet ändrar jämviktspotentialen E m , och sålunda membranet spänningen V m . Således påverkar membranpotentialen permeabiliteten, som sedan ytterligare påverkar membranpotentialen. Detta skapar möjligheten till positiv feedback , vilket är en viktig del av den stigande fasen av åtgärdspotentialen. En komplicerande faktor är att en enda jonkanal kan ha flera interna "grindar" som svarar på förändringar i V m i motsatta sätt, eller med olika hastigheter. Till exempel, även om höjning av V m öppnar de flesta portarna i den spänningskänsliga natriumkanalen, stänger den också kanalens "inaktiveringsport", om än långsammare. Därför, när V m höjs plötsligt, öppnas natriumkanalerna initialt, men stängs sedan på grund av den långsammare inaktiveringen.
Spänningarna och strömmarna för åtgärdspotentialen i alla dess faser modellerades exakt av Alan Lloyd Hodgkin och Andrew Huxley 1952, för vilka de tilldelades Nobelpriset i fysiologi eller medicin 1963. Men deras modell överväger endast två typer av spänningskänsliga jonkanaler och gör flera antaganden om dem, t.ex. att deras inre portar öppnas och stängs oberoende av varandra. I verkligheten finns det många typer av jonkanaler, och de öppnas och stängs inte alltid oberoende.
Stimulering och stigande fas
En typisk åtgärdspotential börjar vid axonbacken med en tillräckligt stark depolarisering, t.ex. en stimulans som ökar V m . Denna depolarisation orsakas ofta genom injektion av extra natrium katjoner in i cellen; dessa katjoner kan komma från en mängd olika källor, såsom kemiska synapser , sensoriska neuroner eller pacemakerpotentialer .
För en neuron i vila finns det en hög koncentration av natrium- och kloridjoner i den extracellulära vätskan jämfört med den intracellulära vätskan , medan det finns en hög koncentration av kaliumjoner i den intracellulära vätskan jämfört med den extracellulära vätskan. Skillnaden i koncentrationer, som får joner att flytta från en hög till en låg koncentration , och elektrostatiska effekter (attraktion av motsatta laddningar) är ansvariga för jonernas rörelse in och ut ur neuronet. Insidan av en neuron har en negativ laddning i förhållande till cellens yttre, från rörelsen av K + ut ur cellen. Neuronmembranet är mer genomträngligt för K + än för andra joner, vilket gör att denna jon selektivt kan röra sig ur cellen, ner i dess koncentrationsgradient. Denna koncentrationsgradient tillsammans med kaliumläckagekanaler som finns på neuronets membran orsakar ett flöde av kaliumjoner vilket gör vilopotentialen nära E K ≈ –75 mV. Eftersom Na + -joner är i högre koncentrationer utanför cellen, driver koncentrationen och spänningsskillnaderna dem in i cellen när Na + -kanalerna öppnas. Depolarisering öppnar både natrium- och kaliumkanalerna i membranet, vilket gör att jonerna kan flöda in och ut ur axonen, respektive. Om depolariseringen är liten (säg att öka V m från −70 mV till −60 mV), överväger den utåtriktade kaliumströmmen den inåtgående natriumströmmen och membranet repolariseras tillbaka till sin normala vilopotential runt −70 mV. Men om depolariseringen är tillräckligt stor ökar den inåtgående natriumströmmen mer än den utåtriktade kaliumströmmen och ett löptillstånd ( positiv feedback ) resulterar: ju mer inåtström det finns, desto mer V m ökar, vilket i sin tur ytterligare ökar inåt nuvarande. En tillräckligt stark depolarisering (ökning i V m ) gör att de spänningskänsliga natriumkanalerna öppnas; den ökande permeabiliteten för natrium driver V m närmare natriumjämviktsspänningen E Na ≈ +55 mV. Den ökande spänningen gör i sin tur att ännu fler natriumkanaler öppnas, vilket driver V m ännu längre mot E Na . Denna positiva återkoppling fortsätter tills natriumkanalerna är helt öppna och V m ligger nära E Na . Den kraftiga ökningen av V m och natrium permeabilitet motsvarar den stigande fasen av aktionspotentialen.
Den kritiska tröskelspänningen för detta tillflyktsituation är vanligtvis runt −45 mV, men det beror på axonens senaste aktivitet. En cell som just avlossat en åtgärdspotential kan inte avfyra en annan omedelbart, eftersom Na + -kanalerna inte har återhämtat sig från det inaktiverade tillståndet. Den period under vilken ingen ny åtgärdspotential kan avfyras kallas den absoluta eldfasta perioden . Vid längre tidpunkter, efter att vissa men inte alla jonkanaler har återhämtat sig, kan axonen stimuleras att producera en annan åtgärdspotential, men med en högre tröskel, vilket kräver en mycket starkare depolarisering, till exempel −30 mV. Den period under vilken handlingspotentialer är ovanligt svåra att framkalla kallas den relativa eldfasta perioden .
Toppfas
Den positiva återkopplingen från den stigande fasen bromsar och stannar när natriumjonkanalerna blir maximalt öppna. Vid toppen av aktionspotentialen, är natrium permeabilitet maximeras och membranspänningen V m är nästan lika med natriumjämviktsspänningen E Na . Men samma upphöjda spänning som öppnade natriumkanalerna inledningsvis stänger dem också långsamt genom att stänga sina porer; natriumkanalerna inaktiveras . Detta sänker membranets permeabilitet till natrium i förhållande till kalium, vilket driver membranspänningen tillbaka mot vilovärdet. Samtidigt öppnar den upphöjda spänningen spänningskänsliga kaliumkanaler; ökningen i membranets kalium permeabilitet driver V m mot E K . Tillsammans gör dessa förändringar i natrium- och kaliumpermeabilitet att V m sjunker snabbt, repolariserar membranet och producerar "fallfasen" av åtgärdspotentialen.
Efterhyperpolarisering
Den depolariserade spänningen öppnar ytterligare spänningsberoende kaliumkanaler, och några av dessa stängs inte direkt när membranet återgår till sin normala vilspänning. Dessutom öppnas ytterligare kaliumkanaler som svar på tillströmningen av kalciumjoner under åtgärdspotentialen. Den intracellulära koncentrationen av kaliumjoner är transient ovanligt låg, vilket gör att membranspänningen V m ännu närmare till kaliumjämviktsspänningen E K . Membranpotentialen går under den vilande membranpotentialen. Därför finns det en undersökning eller hyperpolarisering , benämnd en efterhyperpolarisering , som kvarstår tills membrankaliumpermeabiliteten återgår till sitt vanliga värde och återställer membranpotentialen till vilotillståndet.
Eldfast period
Varje åtgärdspotential följs av en eldfast period , som kan delas in i en absolut eldfast period , under vilken det är omöjligt att framkalla ytterligare en åtgärdspotential, och sedan en relativ eldfast period , under vilken en starkare än vanligt stimulans krävs. Dessa två eldfasta perioder orsakas av förändringar i tillståndet av natrium- och kaliumkanalmolekyler. När de stängs efter en åtgärdspotential går natriumkanaler in i ett "inaktiverat" tillstånd , i vilket de inte kan fås att öppna oavsett membranpotentialen - detta ger upphov till den absoluta eldfasta perioden. Även efter att ett tillräckligt antal natriumkanaler har övergått till viloläge händer det ofta att en bråkdel av kaliumkanaler förblir öppna, vilket gör det svårt för membranpotentialen att depolarisera och därigenom ge upphov till den relativa eldfasta perioden. Eftersom densiteten och undertyperna av kaliumkanaler kan skilja sig mycket mellan olika typer av neuroner, är den relativa eldfasta periodens varaktighet mycket varierande.
Den absoluta eldfasta perioden är till stor del ansvarig för enriktad utbredning av åtgärdspotentialer längs axoner. Vid varje givet ögonblick är axonplåstret bakom den aktivt spikande delen eldfast, men plåstret framför, som inte har aktiverats nyligen, kan stimuleras av depolarisationen från åtgärdspotentialen.
Fortplantning
Handlingspotentialen som genereras vid axonbacken förökar sig som en våg längs axonen. Strömmarna som strömmar inåt vid en punkt på axonet under en aktionspotential sprids ut längs axonen och depolariserar de intilliggande sektionerna av dess membran. Om den är tillräckligt stark framkallar denna depolarisering en liknande åtgärdspotential vid de närliggande membranplåstren. Denna grundläggande mekanism demonstrerades av Alan Lloyd Hodgkin 1937. Efter att ha krossat eller kylt nervsegment och därmed blockerat åtgärdspotentialerna visade han att en åtgärdspotential som anländer på ena sidan av blocket kan provocera en annan åtgärdspotential på den andra, förutsatt att blockerat segment var tillräckligt kort.
När en åtgärdspotential har inträffat vid en membranlapp behöver membranplåstret tid för att återhämta sig innan den kan avfyra igen. På molekylär nivå motsvarar denna absoluta eldfasta period den tid som krävs för de spänningsaktiverade natriumkanalerna att återhämta sig från inaktivering, dvs för att återgå till sitt slutna tillstånd. Det finns många typer av spänningsaktiverade kaliumkanaler i neuroner. Några av dem inaktiveras snabbt (A-typströmmar) och några av dem inaktiverar långsamt eller inte inaktiverar alls; denna variabilitet garanterar att det alltid kommer att finnas en tillgänglig strömkälla för repolarisering, även om några av kaliumkanalerna inaktiveras på grund av föregående depolarisering. Å andra sidan inaktiveras alla neuronala spänningsaktiverade natriumkanaler inom flera millisekunder under stark depolarisering, vilket gör det möjligt att följa depolarisering tills en betydande bråkdel av natriumkanaler har återgått till sitt slutna tillstånd. Även om det begränsar avfyrningsfrekvensen, säkerställer den absoluta eldfasta perioden att åtgärdspotentialen rör sig i endast en riktning längs en axon. Strömmarna som strömmar in på grund av en åtgärdspotential som sprids ut i båda riktningarna längs axonen. Men bara den oeldade delen av axonen kan svara med en åtgärdspotential; den del som just avlossat svarar inte tills åtgärdspotentialen är säkert utanför räckvidd och inte kan återstimulera den delen. I den vanliga ortodroma ledningen förökas åtgärdspotentialen från axonbacken mot de synaptiska knopparna (den axonala änden); förökning i motsatt riktning - känd som antidromisk ledning - är mycket sällsynt. Om emellertid ett laboratorieaxon stimuleras i mitten, är båda axonhalvorna "färska", dvs oeldade; då kommer två åtgärdspotentialer att genereras, en reser mot axonbacken och den andra färdas mot de synaptiska knopparna.
Myelin och saltatorisk ledning

För att möjliggöra snabb och effektiv transduktion av elektriska signaler i nervsystemet är vissa neuronala axoner täckt med myelinskidorna. Myelin är ett multilamellärt membran som omsluter axonen i segment separerade med intervall som kallas Ranviers noder . Den produceras av specialiserade celler: Schwann -celler uteslutande i det perifera nervsystemet och oligodendrocyter uteslutande i centrala nervsystemet . Myelinhöljet minskar membrankapacitansen och ökar membranmotståndet i inter-nodintervallen, vilket möjliggör en snabb, saltatorisk rörelse av åtgärdspotentialer från nod till nod. Myelinisering finns främst hos ryggradsdjur , men ett analogt system har upptäckts hos några få ryggradslösa djur, till exempel vissa arter av räkor . Alla neuroner hos ryggradsdjur är inte myeliniserade; axoner av neuroner som innefattar det autonoma nervsystemet myeliniseras till exempel inte i allmänhet.
Myelin hindrar joner från att komma in eller lämna axonen längs myeliniserade segment. Som en allmän regel ökar myeliniseringen ledningshastigheten för åtgärdspotentialer och gör dem mer energieffektiva. Oavsett om det är saltande eller inte, varierar den genomsnittliga ledningshastigheten för en åtgärdspotential från 1 meter per sekund (m/s) till över 100 m/s, och ökar i allmänhet med axonal diameter.
Åtgärdspotentialer kan inte föröka sig genom membranet i myeliniserade segment av axonen. Strömmen bärs dock av cytoplasman, vilket är tillräckligt för att depolarisera den första eller andra efterföljande noden av Ranvier . Istället framkallar den joniska strömmen från en åtgärdspotential vid en nod av Ranvier en annan åtgärdspotential vid nästa nod; denna uppenbara "hoppning" av åtgärdspotentialen från nod till nod är känd som salterande ledning . Även om mekanismen för saltningsledning föreslogs 1925 av Ralph Lillie, kom de första experimentella bevisen för saltningsledning från Ichiji Tasaki och Taiji Takeuchi och från Andrew Huxley och Robert Stämpfli. I omyeliniserade axoner framkallar däremot åtgärdspotentialen en annan i membranet omedelbart intill och rör sig kontinuerligt nedåt axonen som en våg.

Myelin har två viktiga fördelar: snabb ledningshastighet och energieffektivitet. För axoner som är större än en minsta diameter (ungefär 1 mikrometer ) ökar myeliniseringen ledningshastigheten för en åtgärdspotential, vanligtvis tiofaldig. Omvänt, för en given ledningshastighet, är myeliniserade fibrer mindre än deras omyeliniserade motsvarigheter. Till exempel rör sig åtgärdspotentialer med ungefär samma hastighet (25 m/s) i en myeliniserad grodaaxon och en omyeliniserad bläckfiskjätteaxon , men grodaxonen har en ungefär 30 gånger mindre diameter och 1000 gånger mindre tvärsnittsarea . Eftersom de joniska strömmarna är begränsade till Ranviers noder "läcker" mycket färre joner över membranet, vilket sparar metabolisk energi. Denna besparing är en betydande selektiv fördel , eftersom det mänskliga nervsystemet använder cirka 20% av kroppens metaboliska energi.
Längden på axons myeliniserade segment är viktiga för framgången med saltande ledning. De bör vara så långa som möjligt för att maximera ledningshastigheten, men inte så lång att den ankommande signalen är för svag för att framkalla en åtgärdspotential vid nästa nod av Ranvier. I naturen är myeliniserade segment i allmänhet tillräckligt långa för att den passivt förökade signalen ska färdas i minst två noder samtidigt som den behåller tillräckligt med amplitud för att avfyra en åtgärdspotential vid den andra eller tredje noden. Sålunda är säkerhetsfaktorn för saltningsledning hög, vilket gör att överföring kan kringgå noder vid skada. Handlingspotentialer kan dock sluta i förtid på vissa platser där säkerhetsfaktorn är låg, även i omyeliniserade neuroner; ett vanligt exempel är en axons grenpunkt, där den delar sig i två axoner.
Vissa sjukdomar bryter ner myelin och försämrar saltningsledningen, vilket minskar ledningshastigheten för åtgärdspotentialer. Den mest kända av dessa är multipel skleros , där nedbrytning av myelin försämrar samordnad rörelse.
Kabelteori

Strömflödet i en axon kan beskrivas kvantitativt med kabelteori och dess utarbetningar, till exempel fackmodellen. Kabelteori utvecklades 1855 av Lord Kelvin för att modellera den transatlantiska telegrafkabeln och visade sig vara relevant för neuroner av Hodgkin och Rushton 1946. I enkel kabelteori behandlas neuronen som en elektriskt passiv, perfekt cylindrisk överföringskabel, som kan beskrivas med en partiell differentialekvation
där V ( x , t ) är spänningen över membranet vid en tidpunkt t och en position x längs neuronets längd, och där λ och τ är de karakteristiska längd- och tidsskalorna på vilka dessa spänningar avtar som svar på en stimulans . Med hänvisning till kretsschemat till höger kan dessa skalor bestämmas utifrån motstånd och kapacitanser per längdenhet.
Dessa tids- och längdskalor kan användas för att förstå ledningshastighetens beroende av neuronets diameter i omyeliniserade fibrer. Till exempel ökar tidsskalan τ med både membranmotståndet r m och kapacitansen c m . När kapacitansen ökar måste mer laddning överföras för att producera en given transmembranspänning (med ekvationen Q = CV ); när motståndet ökar, överförs mindre laddning per tidsenhet, vilket gör ekvilibreringen långsammare. På ett liknande sätt, om det inre motståndet per längdenhet r i är lägre i en axon än på ett annat (t.ex. eftersom den första radien är större), blir den rumsliga sönderfallslängden λ längre och ledningshastigheten för en åtgärdspotential borde öka. Om transmembranmotståndet r m ökas, sänker det den genomsnittliga "läck" -strömmen över membranet, vilket också får λ att bli längre, vilket ökar ledningshastigheten.
Uppsägning
Kemiska synapser
I allmänhet orsakar åtgärdspotentialer som når de synaptiska rattarna att en signalsubstans släpps ut i den synaptiska klyftan. Neurotransmittorer är små molekyler som kan öppna jonkanaler i den postsynaptiska cellen; de flesta axoner har samma signalsubstans vid alla sina ändar. Åtkomstpotentialens ankomst öppnar spänningskänsliga kalciumkanaler i det presynaptiska membranet; tillströmningen av kalcium gör att vesiklar fyllda med neurotransmittor migrerar till cellens yta och släpper ut innehållet i den synaptiska klyftan . Denna komplexa process hämmas av neurotoxinerna tetanospasmin och botulinumtoxin , som är ansvariga för stivkramp respektive botulism .

Elektriska synapser
Vissa synapser undviker neurotransmittorns "mellanhand" och kopplar samman de presynaptiska och postsynaptiska cellerna. När en åtgärdspotential når en sådan synaps kan de joniska strömmarna som strömmar in i den presynaptiska cellen passera barriären för de två cellmembranen och komma in i den postsynaptiska cellen genom porer som kallas connexoner . Således kan jonströmmarna i den presynaptiska åtgärdspotentialen direkt stimulera den postsynaptiska cellen. Elektriska synapser möjliggör snabbare överföring eftersom de inte kräver långsam diffusion av signalsubstanser över den synaptiska klyftan. Därför används elektriska synapser närhelst snabb respons och koordinering av timing är avgörande, som vid flyktreflexer , näthinnan hos ryggradsdjur och hjärtat .
Neuromuskulära korsningar
Ett speciellt fall av en kemisk synaps är den neuromuskulära korsningen , där axonen i en motorneuron slutar på en muskelfiber . I sådana fall är den frigjorda signalsubstansen acetylkolin , som binder till acetylkolinreceptorn, ett integrerat membranprotein i membranet ( sarcolemma ) i muskelfibern. Acetylkolinen förblir dock inte bunden; den dissocierar snarare och hydrolyseras av enzymet, acetylkolinesteras , som ligger i synapsen. Detta enzym minskar snabbt stimulansen till muskeln, vilket gör att graden och tidpunkten för muskelsammandragning kan regleras delikat. Vissa gifter inaktiverar acetylkolinesteras för att förhindra denna kontroll, såsom nervmedlen sarin och tabun , och insekticiderna diazinon och malathion .
Andra celltyper
Hjärtaktionspotentialer

Hjärtaktionspotentialen skiljer sig från den neuronala aktionspotentialen genom att ha en utsträckt platå, där membranet hålls vid hög spänning i några hundra millisekunder innan det repolariseras av kaliumströmmen som vanligt. Denna platå beror på att långsammare kalciumkanaler öppnas och håller membranspänningen nära deras jämviktspotential även efter att natriumkanalerna har inaktiverats.
Hjärtaktionspotentialen spelar en viktig roll för att samordna hjärtats sammandragning. Hjärtcellerna i den sinoatriella noden ger pacemakerpotentialen som synkroniserar hjärtat. Handlingspotentialerna för dessa celler förökar sig till och genom atrioventrikulär nod (AV -nod), som normalt är den enda ledningsvägen mellan förmaken och ventriklarna . Handlingspotentialer från AV -noden färdas genom bunten av His och därifrån till Purkinje -fibrerna . Omvänt kan avvikelser i hjärtaktionspotentialen - oavsett om de beror på en medfödd mutation eller skada - leda till mänskliga patologier, särskilt arytmier . Flera antiarytmidroger verkar på hjärtaktionspotentialen, såsom kinidin , lidokain , betablockerare och verapamil .
Muskelaktionspotentialer
Handlingspotentialen i en normal skelettmuskelcell liknar åtgärdspotentialen i neuroner. Åtgärdspotentialer beror på depolarisering av cellmembranet ( sarcolemma ), vilket öppnar spänningskänsliga natriumkanaler; dessa blir inaktiverade och membranet repolariseras genom den yttre strömmen av kaliumjoner. Vilopotentialen före åtgärdspotentialen är vanligtvis −90mV, något mer negativ än typiska neuroner. Muskelaktionspotentialen varar ungefär 2–4 ms, den absoluta eldfasta perioden är ungefär 1–3 ms och ledningshastigheten längs muskeln är ungefär 5 m/s. Handlingspotentialen frigör kalciumjoner som frigör tropomyosinet och låter muskeln dra sig samman. Muskelaktionspotentialer provoceras av ankomsten av en pre-synaptisk neuronal aktionspotential vid den neuromuskulära korsningen , vilket är ett vanligt mål för neurotoxiner .
Växtaktionspotentialer
Växt- och svampceller är också elektriskt exciterade. Den grundläggande skillnaden från animaliska åtgärdspotentialer är att depolarisationen i växtceller inte uppnås genom upptag av positiva natriumjoner, utan genom frisättning av negativa kloridjoner . 1906 publicerade JC Bose de första mätningarna av åtgärdspotentialer i växter, som tidigare hade upptäckts av Burdon-Sanderson och Darwin. En ökning av cytoplasmatiska kalciumjoner kan vara orsaken till anjonfrisättning i cellen. Detta gör kalcium till en föregångare till jonrörelser, såsom tillströmning av negativa kloridjoner och utflöde av positiva kaliumjoner, som man ser i kornblad.
Den initiala tillströmningen av kalciumjoner utgör också en liten cellulär depolarisering, vilket gör att de spänningsstyrda jonkanalerna öppnas och gör att full depolarisering kan förökas av kloridjoner.
Vissa växter (t.ex. Dionaea muscipula ) använder natriumgateda kanaler för att styra rörelser och i huvudsak "räkna". Dionaea muscipula , även känd som Venus flytrap, finns i subtropiska våtmarker i North och South Carolina. När det finns dåliga jordnäringsämnen, är flygfällan beroende av en kost av insekter och djur. Trots forskning om växten saknas förståelse bakom den molekylära grunden för Venus flytraps och köttätande växter i allmänhet.
Men mycket forskning har gjorts om åtgärdspotentialer och hur de påverkar rörelse och urverk inom Venus flytrap. Till att börja med är vilomembranpotentialen för Venus flytrap (-120mV) lägre än djurceller (vanligtvis -90mV till -40mV). Den lägre vilopotentialen gör det lättare att aktivera en åtgärdspotential. Således, när en insekt landar på plantans fälla, utlöser den en hårliknande mekanoreceptor. Denna receptor aktiverar sedan en åtgärdspotential som varar cirka 1,5 ms. I slutändan orsakar detta en ökning av positiva kalciumjoner i cellen, något depolariserar den.
Flygfällan stängs dock inte efter en utlösare. Istället kräver det aktivering av 2 eller fler hårstrån. Om bara ett hår utlöses, kastar det aktiveringen som en falsk positiv. Vidare måste det andra håret aktiveras inom ett visst tidsintervall (0,75 s - 40 s) för att det ska kunna registreras med den första aktiveringen. Således börjar en ansamling av kalcium och faller långsamt från den första utlösaren. När den andra åtgärdspotentialen avfyras inom tidsintervallet når den kalciumtröskeln för att depolarisera cellen och stänger fällan på bytet inom en bråkdel av en sekund.
Tillsammans med den efterföljande frisättningen av positiva kaliumjoner innebär åtgärdspotentialen i växter en osmotisk saltförlust (KCl). Djurverkan är osmotiskt neutral eftersom lika stora mängder natrium som kommer in och lämnar kalium avbryter varandra osmotiskt. Interaktionen mellan elektriska och osmotiska relationer i växtceller tycks ha uppkommit från en osmotisk funktion av elektrisk excitabilitet hos en gemensam encelliga förfäder till växter och djur under förändrade salthalt. Vidare ses den nuvarande funktionen för snabb signalöverföring som en nyare prestation av metazoanceller i en mer stabil osmotisk miljö. Det är troligt att den välkända signalfunktionen hos åtgärdspotentialer i vissa kärlväxter (t.ex. Mimosa pudica ) uppstod oberoende av den i metazoaniska exciterbara celler.
Till skillnad från stigande fas och topp tycks fallande fas och efterhyperpolarisering i första hand bero på katjoner som inte är kalcium. För att initiera repolarisering kräver cellen rörelse av kalium ut ur cellen genom passiv transport på membranet. Detta skiljer sig från neuroner eftersom kaliumrörelsen inte dominerar minskningen av membranpotentialen; Faktum är att för en fullständig repolarisering kräver en växtcell energi i form av ATP för att hjälpa till med utsläpp av väte från cellen-med hjälp av en transportör som allmänt kallas H+-ATPas.
Taxonomisk fördelning och evolutionära fördelar
Handlingspotentialer finns i flercelliga organismer , inklusive växter , ryggradslösa djur som insekter och ryggradsdjur som reptiler och däggdjur . Svampar verkar vara den huvudsakliga phylum av multicellulära eukaryoter som sänder inte aktionspotentialer, även om vissa studier har antytt att dessa organismer har en form av elektrisk signalering, för. Vilopotentialen, liksom åtgärdspotentialens storlek och varaktighet, har inte varierat mycket med evolutionen, även om ledningshastigheten varierar dramatiskt med axonal diameter och myelinisering.
| Djur | Celltyp | Vilopotential (mV) | AP -ökning (mV) | AP -varaktighet (ms) | Ledningshastighet (m/s) |
|---|---|---|---|---|---|
| Bläckfisk ( Loligo ) | Jätte axon | −60 | 120 | 0,75 | 35 |
| Daggmask ( Lumbricus ) | Median jättefiber | −70 | 100 | 1.0 | 30 |
| Kackerlacka ( Periplaneta ) | Jättefiber | −70 | 80–104 | 0,4 | 10 |
| Groda ( Rana ) | Ischiasnerven axon | −60 till −80 | 110–130 | 1.0 | 7–30 |
| Cat ( Felis ) | Spinal motor neuron | −55 till −80 | 80–110 | 1–1,5 | 30–120 |
Med tanke på dess bevarande under hela evolutionen verkar åtgärdspotentialen ge evolutionära fördelar. En funktion av åtgärdspotentialer är snabb, långdistanssignalering inom organismen; ledningshastigheten kan överstiga 110 m/s, vilket är en tredjedel av ljudets hastighet . Som jämförelse rör sig en hormonmolekyl som transporteras i blodomloppet med ungefär 8 m/s i stora artärer. En del av denna funktion är den strama koordineringen av mekaniska händelser, såsom sammandragning av hjärtat. En andra funktion är beräkningen som är associerad med dess generation. Att vara en allt-eller-ingen-signal som inte förfaller med överföringsavstånd, har åtgärdspotentialen liknande fördelar som digital elektronik . Integrationen av olika dendritiska signaler vid axonbacken och dess tröskelvärde för att bilda ett komplext tåg av handlingspotentialer är en annan form av beräkning, en som har utnyttjats biologiskt för att bilda centrala mönstergeneratorer och efterliknade i artificiella neurala nätverk .
Den vanliga prokaryotiska/eukaryota förfadern, som levde för kanske fyra miljarder år sedan, antas ha haft spänningskanaler. Denna funktionalitet var sannolikt, vid något senare tillfälle, avsedd att tillhandahålla en kommunikationsmekanism. Även moderna encelliga bakterier kan utnyttja aktionspotentialer för att kommunicera med andra bakterier i samma biofilm.
Experimentella metoder

Studien av åtgärdspotentialer har krävt utveckling av nya experimentella metoder. Det första arbetet, före 1955, utfördes främst av Alan Lloyd Hodgkin och Andrew Fielding Huxley , som, tillsammans med John Carew Eccles , tilldelades 1963 Nobelpriset i fysiologi eller medicin för deras bidrag till beskrivningen av nervens joniska grund ledning. Den fokuserade på tre mål: att isolera signaler från enstaka neuroner eller axoner, utveckla snabb, känslig elektronik och krympa elektroder så att spänningen inuti en enda cell kunde registreras.
Det första problemet löstes genom att studera de jätteaxoner som fanns i bläckfiskens neuroner ( Loligo forbesii och Doryteuthis pealeii , vid den tiden klassificerad som Loligo pealeii ). Dessa axoner är så stora i diameter (ungefär 1 mm eller 100 gånger större än en typisk neuron) att de kan ses med blotta ögat, vilket gör dem lätta att extrahera och manipulera. De är dock inte representativa för alla exciterbara celler, och många andra system med åtgärdspotentialer har studerats.
Det andra problemet togs upp med den avgörande utvecklingen av spänningsklämman , som gjorde det möjligt för experter att isolera de joniska strömmarna som ligger bakom en åtgärdspotential och eliminerade en nyckelkälla för elektroniskt brus , strömmen I C associerad med membranets kapacitans C . Eftersom strömmen är lika med C gånger graden av förändring av transmembranspänningen V m , lösningen var att utforma en krets som hålls V m fast (noll förändringshastighet) oavsett de strömmar som flyter genom membranet. Sålunda, den ström som erfordras för att hålla V m vid ett fast värde är en direkt avspegling av den ström som flyter genom membranet. Andra elektroniska framsteg inkluderade användningen av Faraday -burar och elektronik med hög ingångsimpedans , så att själva mätningen inte påverkade spänningen som mäts.
Det tredje problemet, att få elektroder som är tillräckligt små för att registrera spänningar inom en enda axon utan att störa den, löstes 1949 med uppfinningen av glasmikropipettelektroden, som snabbt antogs av andra forskare. Förbättringar av denna metod kan producera elektrodspetsar som är så fina som 100 Å (10 nm ), vilket också ger hög ingångsimpedans. Åtgärdspotentialer kan också registreras med små metallelektroder placerade alldeles intill en neuron, med neurochips innehållande EOSFET , eller optiskt med färgämnen som är känsliga för Ca 2+ eller för spänning.

Medan glasmikropipettelektroder mäter summan av de strömmar som passerar genom många jonkanaler, blev det möjligt att studera de elektriska egenskaperna hos en enda jonkanal på 1970 -talet med utvecklingen av patch -klämman av Erwin Neher och Bert Sakmann . För denna upptäckt tilldelades de Nobelpriset i fysiologi eller medicin 1991. Patch-clamping verifierade att joniska kanaler har diskreta konduktanstillstånd, till exempel öppna, stängda och inaktiverade.
Optisk avbildningsteknik har utvecklats under de senaste åren för att mäta åtgärdspotentialer, antingen via samtidiga multisite-inspelningar eller med ultramatlig upplösning. Med hjälp av spänningskänsliga färgämnen har åtgärdspotentialer registrerats optiskt från en liten patch av kardiomyocytmembran .
Neurotoxiner

Flera neurotoxiner , både naturliga och syntetiska, är utformade för att blockera åtgärdspotentialen. Tetrodotoxin från pufferfish och saxitoxin från Gonyaulax ( dinoflagellatsläktet som är ansvarigt för " röda tidvatten ") blockerar åtgärdspotentialer genom att hämma den spänningskänsliga natriumkanalen; på liknande sätt hämmar dendrotoxin från den svarta mambaormen den spänningskänsliga kaliumkanalen. Sådana hämmare av jonkanaler tjänar ett viktigt forskningsändamål, genom att låta forskare "stänga av" specifika kanaler efter behag och därmed isolera de andra kanalernas bidrag; de kan också vara användbara vid rening av jonkanaler genom affinitetskromatografi eller för att analysera deras koncentration. Sådana hämmare producerar emellertid också effektiva neurotoxiner och har övervägts att användas som kemiska vapen . Neurotoxiner riktade mot jonkanalerna hos insekter har varit effektiva insekticider ; ett exempel är det syntetiska permetrinet , vilket förlänger aktiveringen av natriumkanalerna som är involverade i åtgärdspotentialer. Ionkanalerna hos insekter skiljer sig tillräckligt från deras mänskliga motsvarigheter till att det finns få biverkningar hos människor.
Historia

Elektricitetens roll i djurs nervsystem observerades först i dissekerade grodor av Luigi Galvani , som studerade den från 1791 till 1797. Galvanis resultat stimulerade Alessandro Volta att utveckla den voltaiska högen-det tidigast kända elektriska batteriet- som han studerade med. djur elektricitet (såsom elektriska ålar ) och de fysiologiska svaren på applicerade likströmsspänningar .
Forskare från 1800 -talet studerade utbredningen av elektriska signaler i hela nerver (dvs buntar av neuroner ) och visade att nervvävnad består av celler , istället för ett sammankopplat nätverk av rör (ett retikulum ). Carlo Matteucci följde upp Galvanis studier och visade att cellmembranen hade en spänning över dem och kunde producera likström . Matteuccis arbete inspirerade den tyska fysiologen Emil du Bois-Reymond , som upptäckte åtgärdspotentialen 1843. Handlingspotentialernas ledningshastighet mättes först 1850 av du Bois-Reymonds vän, Hermann von Helmholtz . För att fastställa att nervvävnad består av diskreta celler använde den spanska läkaren Santiago Ramón y Cajal och hans elever en fläck som utvecklats av Camillo Golgi för att avslöja de otaliga formerna av neuroner, som de gjorde omhändertagande. För sina upptäckter tilldelades Golgi och Ramón y Cajal Nobelpriset i fysiologi 1906 . Deras arbete löste en mångårig kontrovers i 1800-talets neuroanatomi ; Golgi själv hade argumenterat för nervsystemets nätverksmodell.

1900 -talet var en betydande era för elektrofysiologin. 1902 och igen 1912, framhävde Julius Bernstein hypotesen att åtgärdspotentialen berodde på en förändring av det axonala membranets permeabilitet till joner. Bernsteins hypotes bekräftades av Ken Cole och Howard Curtis, som visade att membrankonduktansen ökar under en åtgärdspotential. 1907 föreslog Louis Lapicque att åtgärdspotentialen genererades när ett tröskelvärde passerade, vad som senare skulle visas som en produkt av de dynamiska systemen för joniska konduktanser. 1949 förädlade Alan Hodgkin och Bernard Katz Bernsteins hypotes genom att tänka på att axonmembranet kan ha olika permeabiliteter för olika joner; i synnerhet visade de natriumpermeabilitetens avgörande roll för åtgärdspotentialen. De gjorde den första faktiska inspelningen av de elektriska förändringarna över neuronmembranet som förmedlar åtgärdspotentialen. Denna forskningslinje kulminerade i de fem 1952 -artiklarna från Hodgkin, Katz och Andrew Huxley , där de använde spänningsklämtekniken för att bestämma beroendet av det axonala membranets permeabiliteter för natrium- och kaliumjoner på spänning och tid, från vilken de kunde att rekonstruera åtgärdspotentialen kvantitativt. Hodgkin och Huxley korrelerade egenskaperna hos deras matematiska modell med diskreta jonkanaler som kan finnas i flera olika tillstånd, inklusive "öppen", "stängd" och "inaktiverad". Deras hypoteser bekräftades i mitten av 1970- och 1980-talen av Erwin Neher och Bert Sakmann , som utvecklade tekniken för patch-clamping för att undersöka konduktanstillstånden för enskilda jonkanaler. Under 2000-talet börjar forskare förstå den strukturella grunden för dessa konduktanstillstånd och för selektiviteten av kanaler för deras jontyp, genom atomupplösta kristallstrukturer , fluorescensavståndsmätningar och kryo-elektronmikroskopistudier .
Julius Bernstein var också den första som introducerade Nernst -ekvationen för vilopotential över membranet; detta generaliserades av David E. Goldman till den likvärdiga Goldman-ekvationen 1943. Natrium-kaliumpumpen identifierades 1957 och dess egenskaper blev gradvis belysta, vilket kulminerade i bestämningen av dess atomupplösningsstruktur genom röntgenkristallografi . Kristallstrukturerna för relaterade jonpumpar har också lösts, vilket ger en bredare bild av hur dessa molekylära maskiner fungerar.
Kvantitativa modeller

Matematiska och beräkningsmodeller är avgörande för att förstå åtgärdspotentialen och erbjuder förutsägelser som kan testas mot experimentella data, vilket ger ett strikt test av en teori. Den viktigaste och mest exakta av de tidiga neurala modellerna är Hodgkin – Huxley -modellen , som beskriver åtgärdspotentialen med en kopplad uppsättning av fyra vanliga differentialekvationer (ODE). Även om Hodgkin-Huxley-modellen kan vara en förenkling med få begränsningar jämfört med det realistiska nervmembranet som det finns i naturen, har dess komplexitet inspirerat flera ännu mer förenklade modeller, till exempel Morris-Lecar-modellen och FitzHugh-Nagumo-modellen som båda bara har två kopplade ODE: er. Egenskaperna hos modellerna Hodgkin – Huxley och FitzHugh – Nagumo och deras släktingar, såsom Bonhoeffer – Van der Pol-modellen, har studerats väl inom matematik, beräkning och elektronik. Men de enkla modellerna av generatorpotential och åtgärdspotential misslyckas med att exakt återge nära tröskelns neurala spikhastighet och spikform, speciellt för mekanoreceptorerna som Pacinian corpuscle . Mer modern forskning har fokuserat på större och mer integrerade system; genom att förena handlingspotentialmodeller med modeller av andra delar av nervsystemet (som dendriter och synapser) kan forskare studera nevral beräkning och enkla reflexer , såsom flyktreflexer och andra som styrs av centrala mönstergeneratorer .
Se även
Anteckningar
- ^ I allmänhet, medan denna enkla beskrivning av åtgärdspotentialinitiering är korrekt, förklarar den inte fenomen som excitationsblock (förmågan att hindra neuroner från att framkalla åtgärdspotentialer genom att stimulera dem med stora strömsteg) och förmågan att framkalla åtgärdspotentialer genom att hyperpolariserar membranet kort. Genom att analysera dynamiken i ett system av natrium- och kaliumkanaler i en membranplåster med hjälp av beräkningsmodeller förklaras dock dessa fenomen lätt.
- ^ Observera att dessa Purkinje -fibrer är muskelfibrer och inte är relaterade till Purkinje -cellerna , som är neuroner som finns i lillhjärnan .
Referenser
Fotnoter
Tidskriftsartiklar
Böcker
- Anderson JA, Rosenfeld E, red. (1988). Neurocomputing: Forskningsgrunder . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-01097-9. LCCN 87003022 . OCLC 15860311 .
- Bernstein J (1912). Elektrobiologie, die Lehre von den elektrischen Vorgängen im Organismus auf moderner Grundlage dargestellt [ Elektrisk biologi, studier av de elektriska processerna i organismen representerade på modern basis ]. Braunschweig: Vieweg und Sohn. LCCN 12027986 . OCLC 11358569 .
- Bower JM, Beeman D (1995). The Book of GENESIS: Exploring Realistic Neural Models with the GEneral NEural SImulation System . Santa Clara, Kalifornien: TELOS. ISBN 978-0-387-94019-9. LCCN 94017624 . OCLC 30518469 .
- Brazier MA (1961). En historia om hjärnans elektriska aktivitet . London: Pitman. LCCN 62001407 . OCLC 556863 .
- Bullock TH , Horridge GA (1965). Struktur och funktion i ryggradslösa djurens nervsystem . En serie böcker i biologi. San Francisco: WH Freeman. LCCN 65007965 . OCLC 558128 .
- Bullock TH , Orkand R, Grinnell A (1977). Introduktion till nervsystemet . En serie böcker i biologi. San Francisco: WH Freeman. ISBN 978-0-7167-0030-2. LCCN 76003735 . OCLC 2048177 .
- Fält J, red. (1959). Handbook of Physiology: a Critical, Comprehensive Presentation of Physiological Knowledge and Concepts: Avsnitt 1: Neurofysiologi . 1 . Washington, DC: American Physiological Society. LCCN 60004587 . OCLC 830755894 .
- Ganong, WF (1991). Granskning av medicinsk fysiologi . Ganong's Review of Medical Physiology (15: e upplagan). Norwalk, Conn .: Appleton och Lange. ISBN 978-0-8385-8418-7. ISSN 0892-1253 . LCCN 87642343 . OCLC 23761261 .
- Guckenheimer J, Holmes P, red. (1986). Olinjära oscillationer, dynamiska system och bifurcationer av vektorfält . Tillämpad matematisk vetenskap. 42 (andra upplagan). New York: Springer Verlag. ISBN 978-0-387-90819-9. OCLC 751129941 .
- Hoppensteadt FC (1986). En introduktion till neurons matematik . Cambridge -studier i matematisk biologi. 6 . Cambridge: Cambridge University Press. ISBN 978-0-521-31574-6. LCCN 85011013 . OCLC 12052275 .
- Junge D (1981). Nerv- och muskelexcitation (andra upplagan). Sunderland, Mass .: Sinauer Associates. ISBN 978-0-87893-410-2. LCCN 80018158 . OCLC 6486925 .
- Kettenmann H, Grantyn R, red. (1992). Praktiska elektrofysiologiska metoder: En guide för in vitro -studier i ryggradsdjurneurobiologi . New York: Wiley. ISBN 978-0-471-56200-9. LCCN 92000179 . OCLC 25204689 .
- Keynes RD , Aidley DJ (1991). Nerv och muskel (2: a uppl.). Cambridge: Cambridge University Press. ISBN 978-0-521-41042-7. LCCN 90015167 . OCLC 25204483 .
- Koch C , Segev I, red. (1989). Metoder för neuronal modellering: Från synapser till nätverk . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-11133-1. LCCN 88008279 . OCLC 18384545 .
- Lavallée M, Schanne OF, Hébert NC, red. (1969). Glaselektroder . New York: Wiley. ISBN 978-0-471-51885-3. LCCN 68009252 . OCLC 686 .
- McCulloch WS (1988). Förkroppsliganden i sinnet . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-63114-3. LCCN 88002987 . OCLC 237280 .
- McHenry LC, Garrison FH (1969). Garrisons historia om neurologi . Springfield, Ill .: Charles C. Thomas. OCLC 429733931 .
- Silverthorn DU (2010). Human Physiology: An Integrated Approach (5: e upplagan). San Francisco: Pearson. ISBN 978-0-321-55980-7. LCCN 2008050369 . OCLC 268788623 .
- Spanswick RM, Lucas WJ, Dainty J, red. (1980). Anläggningsmembrantransport: aktuella konceptuella problem . Utvecklingen inom växtbiologi. 4 . Amsterdam: Elsevier Biomedical Press. ISBN 978-0-444-80192-0. LCCN 79025719 . OCLC 5799924 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, Williams SM (2001). "Frigörning av sändare från Synaptic Vesicles" . Neurovetenskap (2: a upplagan). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-742-4. LCCN 00059496 . OCLC 806472664 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, White LE (2008). Neurovetenskap (4: e upplagan). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-697-7. LCCN 2007024950 . OCLC 144771764 .
- Reeke GN, Poznanski RR, Sporns O, Rosenberg JR, Lindsay KA, red. (2005). Modellering inom neurovetenskap: från biologiska system till neuromimetisk robotik . Boca Raton, Fla.: Taylor & Francis. ISBN 978-0-415-32868-5. LCCN 2005298022 . OCLC 489024131 .
- Schmidt-Nielsen K (1997). Animal Physiology: Adaptation and Environment (5: e upplagan). Cambridge: Cambridge University Press. ISBN 978-0-521-57098-5. LCCN 96039295 . OCLC 35744403 .
- Schwann HP, red. (1969). Biologisk teknik . Inter-University Electronics Series. 9 . New York: McGraw-Hill. ISBN 978-0-07-055734-5. LCCN 68027513 . OCLC 51993 .
- Stevens CF (1966). Neurofysiologi: En primer . New York: John Wiley and Sons. ISBN 9780471824367. LCCN 66015872 . OCLC 1175605 .
- Waxman SG, red. (2007). Molekylär neurologi . Burlington, Mass.: Elsevier Academic Press. ISBN 978-0-12-369509-3. LCCN 2008357317 . OCLC 154760295 .
- Worden FG, Swazey JP, Adelman G, red. (1975). Neurovetenskapen, upptäcktsvägar . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-23072-8. LCCN 75016379 . OCLC 1500233 .
webbsidor
Vidare läsning
- Aidley DJ, Stanfield PR (1996). Jonkanaler: Molekyler i aktion . Cambridge: Cambridge University Press. ISBN 978-0-521-49882-1.
- Bear MF, Connors BW, Paradiso MA (2001). Neurovetenskap: Utforska hjärnan . Baltimore: Lippincott. ISBN 0-7817-3944-6.
- Clay JR (maj 2005). "Axonal excitabilitet återbesökt" . Framsteg inom biofysik och molekylärbiologi . 88 (1): 59–90. doi : 10.1016/j.pbiomolbio.2003.12.004 . PMID 15561301 .
- Deutsch S, Micheli-Tzanakou E (1987). Neuroelektriska system . New York: New York University Press. ISBN 0-8147-1782-9.
- Hille B (2001). Ion Channels of Excitable Membranes (3: e upplagan). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-321-1.
- Johnston D, Wu SM (1995). Grunden för cellulär neurofysiologi . Cambridge, Massachusetts: Bradford Book, The MIT Press. ISBN 0-262-10053-3.
- Kandel ER , Schwartz JH, Jessell TM (2000). Principles of Neural Science (4: e upplagan). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Miller C (1987). "Hur jonkanalproteiner fungerar". I Kaczmarek LK, Levitan IB (red.). Neuromodulering: Den biokemiska kontrollen av neuronal excitabilitet . New York: Oxford University Press. s. 39–63. ISBN 978-0-19-504097-5.
- Nelson DL, Cox MM (2008). Lehninger Principles of Biochemistry (5: e upplagan). New York: WH Freeman. ISBN 978-0-7167-7108-1.
externa länkar
- Joniskt flöde i actionpotentialer på Blackwell Publishing
- Handlingspotentialförökning i myeliniserade och omelininerade axoner på Blackwell Publishing
- Generering av AP i hjärtceller och generation av AP i neuronceller
- Resting membran potential from Life: The Science of Biology , av WK Purves, D Sadava, GH Orians och HC Heller, åttonde upplagan, New York: WH Freeman, ISBN 978-0-7167-7671-0 .
- Jonisk rörelse och Goldman -spänningen för godtyckliga joniska koncentrationer vid University of Arizona
- En tecknad film som illustrerar actionpotentialen
- Åtgärdspotentialförökning
- Produktion av åtgärdspotentialen: spännings- och strömspänningssimuleringar
- Programvara med öppen källkod för att simulera potentialer för neuron- och hjärtåtgärder på SourceForge.net
- Introduktion till Action Potential , Neuroscience Online (elektronisk neurovetenskaplig lärobok av UT Houston Medical School)
- Khan Academy: Electrotonic och actionpotential






