Metall - Metal


| Del av en serie om |
| Periodiska systemet |
|---|
En metall (från grekiska μέταλλον metallon , "min, stenbrott, metall") är ett material som, när det är nyframställt, polerat eller sönderdelat, visar ett glänsande utseende och leder elektricitet och värme relativt bra. Metaller är vanligtvis formbara (de kan hamras i tunna ark) eller formbara (kan dras in i trådar). En metall kan vara ett kemiskt element såsom järn ; en legering såsom rostfritt stål ; eller en molekylär förening, såsom polymer svavelnitrid .
Inom fysiken betraktas en metall i allmänhet som varje ämne som kan leda elektricitet vid en temperatur av absolut noll . Många grundämnen och föreningar som normalt inte klassificeras som metaller blir metalliska under höga tryck. Till exempel blir det icke -metalliska jodet gradvis en metall vid ett tryck mellan 40 och 170 tusen gånger atmosfärstrycket . Vissa material som betraktas som metaller kan också bli icke -metaller. Natrium , till exempel, blir en icke -metall vid ett tryck på knappt två miljoner gånger atmosfärstrycket.
Inom kemi är två element som annars skulle kvalificera sig (i fysiken) som spröda metaller- arsenik och antimon- vanligtvis istället erkända som metalloider på grund av deras kemi (främst icke-metalliska för arsenik och balanserade mellan metallicitet och icke-metallicitet för antimon). Omkring 95 av de 118 elementen i det periodiska systemet är metaller (eller kommer sannolikt att vara sådana). Antalet är inexakt eftersom gränserna mellan metaller, icke -metaller och metalloider fluktuerar något på grund av brist på allmänt accepterade definitioner av de involverade kategorierna.
Inom astrofysik kastas termen "metall" bredare för att referera till alla kemiska element i en stjärna som är tyngre än helium , och inte bara traditionella metaller. I denna mening är de första fyra "metaller" som samlas i stjärnkärnor genom nukleosyntes kol , kväve , syre och neon , som alla är strikt icke-metaller i kemi. En stjärna smälter lättare atomer, mestadels väte och helium, till tyngre atomer under sin livstid. Används i den meningen är metalliciteten hos ett astronomiskt föremål andelen av dess materia som består av de tyngre kemiska elementen.
Metaller, som kemiska element, utgör 25% av jordskorpan och finns i många aspekter av det moderna livet. Styrkan och elasticiteten hos vissa metaller har lett till deras regelbunden användning i till exempel bygga höghus och bro konstruktion , liksom de flesta fordon, många hushållsapparater , verktyg, rör och järnvägsspår. Ädelmetaller användes historiskt som mynt , men i modern tid har myntmetaller utvidgats till minst 23 av de kemiska elementen.
Historien om raffinerade metaller antas börja med användning av koppar för cirka 11 000 år sedan. Guld, silver, järn (som meteoriskt järn), bly och mässing användes på samma sätt före det första kända utseendet av brons på 500 -talet f.Kr. Efterföljande utveckling inkluderar produktion av tidiga former av stål; upptäckten av natrium - den första lättmetallen - 1809; uppkomsten av moderna legerade stål ; och, sedan slutet av andra världskriget, utvecklingen av mer sofistikerade legeringar.
Egenskaper
Form och struktur

Metaller är blanka och glänsande , åtminstone när de är nyberedda, polerade eller sönderdelade. Metallplåtar som är tjockare än några mikrometer verkar ogenomskinliga, men guldblad överför grönt ljus.
Metallernas fasta eller flytande tillstånd har till stor del sitt ursprung i att de involverade metallatomerna lätt kan tappa sina yttre skalelektroner. I stort sett är krafterna som håller en enskild atoms yttre skalelektroner på plats svagare än attraktionskrafterna på samma elektroner som härrör från interaktioner mellan atomerna i den fasta eller flytande metallen. De inblandade elektronerna blir delokaliserade och atomens struktur kan effektivt visualiseras som en samling atomer inbäddade i ett moln av relativt rörliga elektroner. Denna typ av interaktion kallas en metallisk bindning . Styrkan hos metalliska bindningar för olika elementära metaller når ett maximalt runt mitten av övergångsmetallserien , eftersom dessa element har ett stort antal delokaliserade elektroner.
Även om de flesta elementära metaller har högre densiteter än de flesta icke -metaller , finns det en stor variation i deras densiteter, litium är den minst täta (0,534 g/cm 3 ) och osmium (22,59 g/cm 3 ) den mest täta. Magnesium, aluminium och titan är lättmetaller av betydande kommersiell betydelse. Deras respektive densiteter av 1,7, 2,7 och 4,5 g / cm 3 kan jämföras med de hos de äldre strukturella metaller, som järn vid 7,9 och koppar vid 8,9 g / cm 3 . En järnkula skulle alltså väga ungefär lika mycket som tre aluminiumkulor med lika stor volym.

Metaller är vanligtvis formbara och segbara, deformeras under stress utan klyvning . Metallbindningens icke -riktade natur antas bidra avsevärt till duktiliteten hos de flesta metalliska fasta ämnena. I motsats därtill, i en jonisk förening som bordsalt, när planen för en jonisk bindning glider förbi varandra, flyttar den resulterande förändringen i platsen joner av samma laddning i närheten, vilket resulterar i klyvningen av kristallen. En sådan förskjutning observeras inte i en kovalent bunden kristall, såsom en diamant, där sprickor och kristallfragmentering sker. Reversibel elastisk deformation i metaller kan beskrivas av Hookes lag för att återställa krafter, där spänningen är linjärt proportionell mot töjningen .
Värme eller krafter större än metallens elastiska gräns kan orsaka en permanent (irreversibel) deformation, känd som plastisk deformation eller plasticitet . En applicerad kraft kan vara en drag (dragning) kraft, en kompressiv (driver) kraft eller en skjuvning , böjning eller torsion (vridning) kraft. En temperaturförändring kan påverka rörelsen eller förskjutningen av strukturella defekter i metallen, såsom korngränser , lediga platser , lednings- och skruvförskjutningar , staplingsfel och tvillingar i både kristallina och icke-kristallina metaller. Inre glidning , krypning och metalltrötthet kan uppstå.
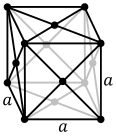
Atomerna i metalliska ämnen är vanligtvis anordnade i en av tre vanliga kristallstrukturer , nämligen kroppscentrerad kubik (bcc), ansiktscentrerad kubik (fcc) och sexkantig närpackad (hcp). I bcc är varje atom placerad i mitten av en kub med åtta andra. I fcc och hcp är varje atom omgiven av tolv andra, men staplingen av lagren skiljer sig åt. Vissa metaller antar olika strukturer beroende på temperaturen.
Den enhetscell för varje kristallstruktur är den minsta grupp av atomer som har den övergripande symmetrin i kristallen, och från vilka hela kristallgittret kan byggas upp genom upprepning i tre dimensioner. När det gäller den kroppscentrerade kubiska kristallstrukturen som visas ovan består enhetscellen av den centrala atomen plus en åtta av var och en av de åtta hörnatomerna.
Elektrisk och termisk

Metallernas elektroniska struktur innebär att de är relativt bra ledare av elektricitet . Elektroner i materia kan bara ha fasta snarare än variabla energinivåer, och i en metall motsvarar elektronernas energinivåer i dess elektronmoln åtminstone till viss del de energinivåer vid vilka elektrisk ledning kan uppstå. I en halvledare som kisel eller ett icke -metall som svavel finns det en energiklyfta mellan elektronerna i ämnet och energinivån vid vilken elektrisk ledning kan uppstå. Följaktligen är halvledare och icke -metaller relativt dåliga ledare.
De elementära metaller har elektriska konduktivitetsvärdena för från 6,9 x 10 3 S / cm för mangan till 6,3 x 10 5 S / cm för silver . Däremot har en halvledande metalloid som bor en elektrisk konduktivitet 1,5 × 10 −6 S/cm. Med ett undantag minskar metalliska element deras elektriska konduktivitet vid uppvärmning. Plutonium ökar sin elektriska konduktivitet vid uppvärmning i temperaturintervallet runt -175 till +125 ° C.
Metaller är relativt goda värmeledare . Elektronerna i en metalls elektronmoln är mycket rörliga och kan lätt överföra värmeinducerad vibrationsenergi.
Metallens elektroners bidrag till dess värmekapacitet och värmeledningsförmåga och metallens elektriska konduktivitet kan beräknas utifrån den fria elektronmodellen . Detta tar dock inte hänsyn till den detaljerade strukturen för metallens jongitter. Med beaktande av den positiva potential som orsakas av arrangemanget av jonkärnorna möjliggör övervägande av den elektroniska bandstrukturen och bindningsenergin hos en metall. Olika matematiska modeller är tillämpliga, den enklaste är den nästan fria elektronmodellen .
Kemisk
Metaller är vanligtvis benägna att bilda katjoner genom elektronförlust. De flesta kommer att reagera med syre i luften för att bilda oxider över olika tidsskalor ( kalium brinner på några sekunder medan järn rostar över år). Vissa andra, som palladium , platina och guld , reagerar inte alls med atmosfären. De oxider av metaller i allmänhet är grundläggande , i motsats till de av icke-metaller , vilka är sura eller neutrala. Undantag är till stor del oxider med mycket höga oxidationstillstånd såsom CrOs 3 , Mn 2 O 7 , och OSO 4 , som har strängt sura reaktioner.
Målning , anodisering eller plätering av metaller är bra sätt att förhindra korrosion . En mer reaktiv metall i den elektrokemiska serien måste emellertid väljas för beläggning, särskilt när spånning av beläggningen förväntas. Vatten och de två metaller bildar en elektrokemisk cell , och om beläggningen är mindre reaktiv än den underliggande metallen, främjar beläggningen faktiskt korrosion.
Distribution av periodiska system
Inom kemi visas de element som vanligtvis anses vara metaller under vanliga förhållanden med gult i det periodiska systemet nedan. De återstående elementen är antingen metalloider (B, Si, Ge, As, Sb och Te är allmänt kända som sådana) eller icke -metaller. Astatin (At) klassificeras vanligtvis som antingen en icke -metall eller en metalloid, men vissa förutsägelser förväntar sig att det är en metall; som sådan har det lämnats tomt på grund av den experimentella kunskapens otydliga tillstånd. De andra elementen som visas ha okända egenskaper är sannolikt metaller, men det finns viss tvekan för copernicium (Cn) och oganesson (Og).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupp → | ||||||||||||||||||||||||||||||||
| ↓ Period | ||||||||||||||||||||||||||||||||
| 1 | H | han | ||||||||||||||||||||||||||||||
| 2 | Li | Vara | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Som | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | CD | I | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | På | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Centimeter | Bk | Jfr | Es | Fm | Md | Nej | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
|
|
||||||||||||||||||||||||||||||||
|
Metall Metalloid Icke -metall Okända fastigheter Bakgrundsfärg visar metall – metalloid – icke -metallisk trend i det periodiska systemet |
||||||||||||||||||||||||||||||||
Legeringar

En legering är ett ämne som har metalliska egenskaper och som består av två eller flera element varav minst ett är en metall. En legering kan ha en variabel eller fast sammansättning. Till exempel bildar guld och silver en legering där proportionerna guld eller silver kan justeras fritt; titan och kisel bildar en legering Ti 2 Si i vilken förhållandet mellan de två komponenterna är fast (även känd som en intermetallisk förening ).

De flesta rena metaller är antingen för mjuka, spröda eller kemiskt reaktiva för praktisk användning. Genom att kombinera olika förhållanden mellan metaller och legeringar ändras egenskaperna hos rena metaller för att ge önskvärda egenskaper. Målet med att göra legeringar är i allmänhet att göra dem mindre spröda, hårdare, motståndskraftiga mot korrosion eller ha en mer önskvärd färg och lyster. Av alla metalllegeringar som används idag utgör legeringarna av järn ( stål , rostfritt stål , gjutjärn , verktygsstål , legerat stål ) den största andelen både efter kvantitet och kommersiellt värde. Järnlegerat med olika andelar av kol ger låg-, mellan- och högkolstål, med ökande kolnivåer som minskar duktiliteten och segheten. Tillsatsen av kisel kommer att producera gjutjärn, medan tillsats av krom , nickel och molybden till kolstål (mer än 10%) resulterar i rostfritt stål.
Andra betydande metalllegeringar är aluminium , titan , koppar och magnesium . Kopparlegeringar har varit kända sedan förhistorien - brons gav bronsåldern sitt namn - och har många tillämpningar idag, viktigast av allt inom elektriska ledningar. Legeringarna för de andra tre metallerna har utvecklats relativt nyligen; på grund av deras kemiska reaktivitet kräver de elektrolytiska extraktionsprocesser. Legeringarna av aluminium, titan och magnesium värderas för sina höga hållfasthets-viktförhållanden; magnesium kan också ge elektromagnetisk skärmning . Dessa material är idealiska för situationer där hög styrka / viktförhållande är viktigare än materialkostnad, till exempel inom flyg och vissa fordonsapplikationer.
Legeringar speciellt utformade för mycket krävande applikationer, till exempel jetmotorer , kan innehålla mer än tio element.
Kategorier
| Metalliska element |
|---|
| Alkaliska metaller |
| Alkaliska jordartsmetaller |
| Övergångsmetaller |
| Metaller efter övergången |
| Lantanider |
| Actinides |
| Element som möjligen är metaller |
| Element som ibland anses vara metaller |
Metaller kan kategoriseras efter deras fysikaliska eller kemiska egenskaper. Kategorier som beskrivs i underavsnitten nedan inkluderar järnhaltiga och icke-järnmetaller ; spröda metaller och eldfasta metaller ; vita metaller; tunga och lätta metaller; och bas- , ädel- och ädelmetaller . Den element Metallic tabellen i detta avsnitt kategoriserar de elementära metallerna på basis av deras kemiska egenskaper till alkali- och alkaliska jordartsmetaller; övergångs och post-övergångsmetaller; och lantanider och aktinider . Andra kategorier är möjliga, beroende på kriterierna för inkludering. Till exempel är de ferromagnetiska metaller - de metaller som är magnetiska vid rumstemperatur - järn, kobolt och nickel.
Järnhaltiga och icke-järnmetaller
Termen "järn" härrör från det latinska ordet som betyder "innehållande järn". Detta kan innefatta rent järn, såsom smidesjärn , eller en legering som stål . Järnmetaller är ofta magnetiska , men inte uteslutande. Icke-järnmetaller-legeringar-saknar betydande mängder järn.
Spröd metall
Medan nästan alla metaller är formbara eller segbara är några - beryllium, krom, mangan, gallium och vismut - spröda. Arsenik och antimon, om de tillåts som metaller, är spröda. Låga värden för förhållandet mellan bulkelastisk modul och skjuvmodul ( Pughs kriterium ) är ett tecken på inneboende sprödhet.
Eldfast metall
Inom materialvetenskap, metallurgi och teknik är en eldfast metall en metall som är utomordentligt resistent mot värme och slitage. Vilka metaller som tillhör denna kategori varierar; den vanligaste definitionen inkluderar niob, molybden, tantal, volfram och rhenium. De har alla smältpunkter över 2000 ° C och hög hårdhet vid rumstemperatur.
-
Niobkristaller och en 1 cm 3 anodiserad niobiumkub för jämförelse
Vit metall
En vit metall är vilken som helst av olika färgade metaller (eller deras legeringar) med relativt låga smältpunkter. Sådana metaller inkluderar zink, kadmium, tenn, antimon (här räknat som metall), bly och vismut, varav några är ganska giftiga. I Storbritannien använder konsthandeln termen "vitmetall" i auktionskataloger för att beskriva utländska silverföremål som inte har British Assay Office -märken, men som ändå förstås vara silver och prissätts därefter.
Tunga och lätta metaller
En tungmetall är vilken som helst relativt tät metall eller metalloid . Mer specifika definitioner har föreslagits, men ingen har fått stor acceptans. Vissa tungmetaller har nischanvändning eller är särskilt giftiga; vissa är viktiga i spårmängder. Alla andra metaller är lätta metaller.
Bas, ädelmetaller och ädelmetaller
Inom kemi används termen basmetall informellt för att hänvisa till en metall som lätt oxideras eller korroderas , såsom att lätt reagera med utspädd saltsyra (HCl) för att bilda en metallklorid och väte . Exempel inkluderar järn, nickel , bly och zink. Koppar anses vara en basmetall eftersom den oxideras relativt lätt, även om den inte reagerar med HCl.
Termen ädelmetall används vanligtvis i motsats till basmetall . Ädelmetaller är motståndskraftiga mot korrosion eller oxidation , till skillnad från de flesta basmetaller . De tenderar att vara ädelmetaller, ofta på grund av upplevd sällsynthet. Exempel inkluderar guld, platina, silver, rodium , iridium och palladium.
Inom alkemi och numismatik står termen basmetall i kontrast med ädelmetall , det vill säga de av högt ekonomiskt värde. Ett mångårigt mål för alkemisterna var omvandling av basmetaller till ädelmetaller inklusive myntmetaller som silver och guld. De flesta mynt idag är gjorda av basmetaller utan eget värde , tidigare har mynt ofta härlett sitt värde främst från deras ädelmetallinnehåll .
Kemiskt sett är ädelmetallerna (som ädelmetallerna) mindre reaktiva än de flesta element, har hög glans och hög elektrisk konduktivitet. Historiskt sett ädelmetaller var viktiga som valuta , men nu betraktas i huvudsak som investeringar och industriella råvaror . Guld , silver , platina och palladium har vardera en ISO 4217 valutakod. De mest kända ädelmetallerna är guld och silver. Medan båda har industriell användning, är de mer kända för sin användning inom konst , smycken och mynt . Andra ädelmetaller inkluderar platinagruppmetallerna : rutenium , rodium , palladium, osmium , iridium och platina, varav platina är den mest omsatta.
Efterfrågan på ädelmetaller drivs inte bara av deras praktiska användning, utan också av deras roll som investeringar och värdeförråd . Palladium och platina värderades från hösten 2018 till cirka tre fjärdedelar av guldpriset. Silver är betydligt billigare än dessa metaller, men anses ofta traditionellt vara en ädelmetall mot bakgrund av dess roll i mynt och smycken.
Ventilmetaller
Inom elektrokemi är en ventilmetall en metall som passerar ström i endast en riktning.
Livscykel
Bildning
|
Metaller i jordskorpan:
|
|||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| överflöd och huvudsaklig förekomst eller källa, i vikt | |||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | han | |||||||||||||||||
| 2 | Li | Vara | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Som | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Ru | Rh | Pd | Ag | CD | I | Sn | Sb | Te | I | Xe | ||
| 6 | Cs | Ba |
|
Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | |||
| 7 |
|
||||||||||||||||||
|
|
La | Ce | Pr | Nd | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | ||||||
|
|
Th | U | |||||||||||||||||
|
Mest förekommande (upp till 82 000 sid / min)
|
|||||||||||||||||||
|
Rikligt (100 -999 sid / min)
|
|||||||||||||||||||
|
Mindre vanliga (1–99 sid / min)
|
|||||||||||||||||||
|
Sällsynt (0,01 -0,99 sid / min)
|
|||||||||||||||||||
|
Mycket sällsynt (0,0001 -0,0099 sid / min )
|
|||||||||||||||||||
| Metaller kvar av delningslinjen förekommer (eller kommer från) huvudsakligen som litofiler ; de till höger, som kalkofiler utom guld (en siderofil ) och tenn (en litofil). | |||||||||||||||||||
- Detta underavsnitt behandlar bildandet av elementära metaller i det periodiska systemet eftersom dessa utgör grunden för metalliska material, enligt definitionen i denna artikel.
Metaller upp till järnns närhet (i det periodiska systemet) tillverkas till stor del via stjärnnukleosyntes . I denna process genomgår lättare element från väte till kisel successiva fusionsreaktioner inuti stjärnor, som släpper ut ljus och värme och bildar tyngre element med högre atomnummer.
Tyngre metaller bildas vanligtvis inte på detta sätt eftersom fusionsreaktioner som involverar sådana kärnor skulle konsumera snarare än att släppa ut energi. Snarare syntetiseras de till stor del (från element med ett lägre atomnummer) genom neutronfångst , med de två huvudlägena för denna repetitiva fångst är s-processen och r-processen . I s-processen ("s" står för "långsam") separeras enskilda fångster med år eller decennier, vilket gör att de mindre stabila kärnorna kan beta-förfallna , medan i r-processen ("snabb") sker fångster snabbare än kärnor kan förfalla. Därför tar s-processen en mer eller mindre tydlig väg: till exempel bombarderas stabila kadmium-110-kärnor successivt av fria neutroner inuti en stjärna tills de bildar kadmium-115-kärnor som är instabila och sönderfaller för att bilda indium-115 (vilket är nästan stabil, med en halveringstid30 000 gånger universums ålder). Dessa kärnor fångar upp neutroner och bildar indium-116, vilket är instabilt, och sönderfaller för att bilda tenn-116, och så vidare. Däremot finns det ingen sådan väg i r-processen. S-processen stannar vid vismut på grund av de korta halveringstiderna för de två kommande elementen, polonium och astatin, som förfaller till vismut eller bly. R-processen är så snabb att den kan hoppa över denna instabilitetszon och fortsätta skapa tyngre element som torium och uran.
Metaller kondenseras på planeter som ett resultat av stjärnutveckling och förstörelseprocesser. Stjärnor förlorar mycket av sin massa när den matas ut sent i deras livstid, och ibland därefter som ett resultat av en sammanslagning av neutronstjärnor , vilket ökar mängden element som är tyngre än helium i det interstellära mediet . När tyngdkraftsattraktion får denna materia att sammanföras och kollapsa bildas nya stjärnor och planeter .
Överflöd och förekomst

Jordskorpan består av cirka 25 viktprocent metaller, varav 80 procent är lätta metaller som natrium, magnesium och aluminium. Icke -metaller (~ 75%) utgör resten av skorpan. Trots den totala bristen på vissa tyngre metaller som koppar kan de koncentreras till ekonomiskt utvinnbara mängder till följd av bergsbyggnad, erosion eller andra geologiska processer.
Metaller återfinns främst som litofiler (bergälskande) eller kalkofiler (malmälskande). Litofila metaller är främst s-blockelementen, desto mer reaktiva av d-blockelementen. och f-blockelementen. De har en stark affinitet för syre och existerar mestadels som silikatmineraler med relativt låg densitet. Chalkofilmetaller är främst de mindre reaktiva d-blockelementen och perioden 4-6 p-blockmetaller. De finns vanligtvis i (olösliga) sulfidmineraler. Eftersom kalkofilerna är tätare än litofilerna och därmed sjunker lägre i skorpan vid tidpunkten för dess stelning, tenderar de att vara mindre rikliga än litofilerna.
Å andra sidan är guld ett siderofilt eller järnälskande element. Det bildar inte direkt föreningar med vare sig syre eller svavel. Vid tidpunkten för jordens bildning, och som den ädlaste (inerta) metallen, sjönk guld in i kärnan på grund av dess tendens att bilda metalliska legeringar med hög densitet. Följaktligen är det en relativt sällsynt metall. Några andra (mindre) ädelmetaller - molybden, rhenium, platinagruppmetallerna (rutenium, rodium, palladium, osmium, iridium och platina), germanium och tenn - kan räknas som siderofiler, men endast när det gäller deras primära förekomst i jorden (kärna, mantel och skorpa), snarare skorpan. Dessa metaller förekommer annars i skorpan, i små mängder, främst som kalkofiler (mindre i sin ursprungliga form).
Den roterande vätskans yttre kärna i jordens inre, som till största delen består av järn, anses vara källan till jordens skyddande magnetfält. Kärnan ligger ovanför jordens fasta inre kärna och under dess mantel. Om det kunde omarrangeras i en kolonn som har en 5 m 2 (54 sq ft) fotavtryck det skulle ha en höjd av nästan 700 ljusår. Magnetfältet skyddar jorden från solvindens laddade partiklar och kosmiska strålar som annars skulle ta bort den övre atmosfären (inklusive ozonskiktet som begränsar överföringen av ultraviolett strålning).
Extraktion
Metaller extraheras ofta från jorden med hjälp av gruvmalm som är rika källor till de nödvändiga elementen, till exempel bauxit . Malm lokaliseras med prospekteringsteknik , följt av utforskning och undersökning av fyndigheter. Mineralkällor är vanligtvis indelade i ytgruvor som bryts genom utgrävning med tung utrustning och gruvor under marken . I vissa fall gör försäljningspriset för de inblandade metallerna det ekonomiskt möjligt att bryta lägre koncentrationer.
När malmen väl är utvald måste metaller extraheras , vanligtvis genom kemisk eller elektrolytisk reduktion. Pyrometallurgi använder höga temperaturer för att omvandla malm till råa metaller, medan hydrometallurg utnyttjar vattenbaserad kemi för samma ändamål. Metoderna som används beror på metallen och deras föroreningar.
När en metallmalm är en jonisk förening av den metallen och en icke-metall måste malmen vanligtvis smältas- upphettas med ett reduktionsmedel-för att extrahera den rena metallen. Många vanliga metaller, såsom järn, smälts med kol som reduktionsmedel. Vissa metaller, såsom aluminium och natrium , har inget kommersiellt praktiskt reduktionsmedel och extraheras istället med elektrolys .
Sulfidmalm reduceras inte direkt till metallen utan rostas i luft för att omvandla dem till oxider.
Användningsområden

Metaller finns i nästan alla aspekter av det moderna livet. Järn, en tungmetall , kan vara den vanligaste eftersom den står för 90% av alla raffinerade metaller; aluminium, en lättmetall , är den näst vanligaste raffinerade metallen. Rent järn kan vara det billigaste metallelementet av alla till en kostnad av cirka US $ 0,07 per gram. Dess malmer är utbredda; det är lätt att förfina ; och den involverade tekniken har utvecklats under hundratals år. Gjutjärn är ännu billigare, till en bråkdel av 0,01 US $ per gram, eftersom det inte behövs någon efterföljande rening. Platina, till en kostnad av cirka $ 27 per gram, kan vara den mest allestädes närvarande med tanke på dess mycket höga smältpunkt, korrosionsbeständighet, elektrisk konduktivitet och hållbarhet. Det sägs att det finns i eller används för att producera 20% av alla konsumtionsvaror. Polonium kommer sannolikt att vara den dyraste metallen, till en fiktiv kostnad på cirka 100 000 000 dollar per gram, på grund av dess brist och produktion i mikroskala.
Vissa metaller och metalllegeringar har hög strukturell hållfasthet per massenhet, vilket gör dem användbara material för att bära stora laster eller motstå slagskador. Metalllegeringar kan konstrueras för att ha hög motståndskraft mot skjuvning, vridmoment och deformation. Men samma metall kan också vara sårbar för trötthetsskador genom upprepad användning eller från plötsligt spänningsbrott när en lastkapacitet överskrids. Metallernas styrka och motståndskraft har lett till att de ofta används i höghus och brokonstruktion, liksom de flesta fordon, många apparater, verktyg, rör och järnvägsspår.
Metaller är bra ledare, vilket gör dem värdefulla i elektriska apparater och för att bära en elektrisk ström över en sträcka med lite energi förlorad. Elnät är beroende av metallkablar för att distribuera el. Hemelektriska system är för det mesta kopplade med koppartråd för dess goda ledande egenskaper.
Metallers värmeledningsförmåga är användbar för behållare för att värma material över en låga. Metaller används också för kylflänsar för att skydda känslig utrustning från överhettning.
Vissa metallers höga reflektivitet möjliggör användning i speglar, inklusive precisionsastronomiska instrument, och bidrar till estetiken hos metalliska smycken.
Vissa metaller har specialiserade användningsområden; kvicksilver är en vätska vid rumstemperatur och används i omkopplare för att slutföra en krets när den flyter över omkopplarkontakterna. Radioaktiva metaller som uran och plutonium används i kärnkraftverk för att producera energi via kärnklyvning . Formminneslegeringar används för applikationer som rör, fästelement och vaskulära stentar .
Metaller kan dopas med främmande molekyler - organiska, oorganiska, biologiska och polymerer. Denna dopning innebär metallen med nya egenskaper som induceras av gästmolekylerna. Applikationer inom katalys, medicin, elektrokemiska celler, korrosion och mer har utvecklats.
Återvinning
Efterfrågan på metaller är nära kopplad till ekonomisk tillväxt med tanke på deras användning inom infrastruktur, konstruktion, tillverkning och konsumtionsvaror. Under 1900 -talet växte mångfalden av metaller som används i samhället snabbt. Idag driver utvecklingen av stora nationer, som Kina och Indien, och tekniska framsteg, allt större efterfrågan. Resultatet är att gruvverksamheten expanderar, och fler och fler av världens metallbestånd är över marken i användning, snarare än under marken som oanvända reserver. Ett exempel är kopparlagret som används . Mellan 1932 och 1999 ökade koppar i USA i USA från 73 g till 238 g per person.
Metaller är i sig återvinningsbara, så i princip kan de användas om och om igen, vilket minimerar dessa negativa miljöpåverkan och sparar energi. Exempelvis sparas 95% av energin som används för att tillverka aluminium av bauxitmalm genom att använda återvunnet material.
Globalt är metallåtervinning i allmänhet låg. Under 2010 publicerade International Resource Panel , som värd för FN: s miljöprogram, rapporter om metallbestånd som finns i samhället och deras återvinningsgrader. Författarna till rapporten konstaterade att metallbestånden i samhället kan tjäna som enorma gruvor ovanför marken. De varnade för att återvinningsgraden för vissa sällsynta metaller som används i applikationer som mobiltelefoner, batteripaket för hybridbilar och bränsleceller är så låg att om inte framtida återvinningsgrader dramatiskt höjs dramatiskt blir dessa kritiska metaller otillgängliga för användning i modern teknik.
Biologiska interaktioner
Metallelementens roll i utvecklingen av cellbiokemi har granskats, inklusive ett detaljerat avsnitt om kalciumets roll i redoxenzymer.
Ett eller flera av grundämnena järn , kobolt , nickel , koppar och zink är avgörande för alla högre livsformer. Molybden är en viktig komponent i vitamin B12 . Föreningar av alla andra övergångselement och element efter övergången är giftiga i större eller mindre utsträckning, med få undantag, såsom vissa föreningar av antimon och tenn . Potentiella källor till metallförgiftning inkluderar gruvdrift , avverkningar , industriavfall , jordbruksavrinning , yrkesmässig exponering , färg och behandlat virke .
Historia
Förhistoria
Koppar, som förekommer i naturlig form, kan ha varit den första metallen som upptäcktes med tanke på dess distinkta utseende, tyngd och formbarhet jämfört med andra stenar eller småsten. Guld, silver och järn (som meteoriskt järn) och bly upptäcktes på samma sätt i förhistorien. Former av mässing , en legering av koppar och zink tillverkade genom att samtidigt smälta malmarna av dessa metaller, härstammar från denna period (även om rent zink inte isolerades förrän på 1200 -talet). De fasta metallernas formbarhet ledde till de första försöken att tillverka metallprydnader, verktyg och vapen. Meteoriskt järninnehållande nickel upptäcktes då och då och i vissa avseenden var detta överlägset industriellt stål som tillverkades fram till 1880 -talet när legerat stål blev framträdande.
Antiken

Upptäckten av brons (en legering av koppar med arsenik eller tenn) gjorde det möjligt för människor att skapa metallföremål som var hårdare och mer hållbara än tidigare möjligt. Bronsverktyg, vapen, rustningar och byggmaterial som dekorativa plattor var hårdare och mer hållbara än deras föregångare av sten och koppar (" kalkolit "). Ursprungligen gjordes brons av koppar och arsenik (bildande arsenbrons ) genom att smälta naturligt eller artificiellt blandade malmer av koppar och arsenik. De tidigaste artefakterna som hittills är kända kommer från den iranska platån under 500 -talet f.Kr. Det var först senare som tenn användes och blev den huvudsakliga icke-kopparrediensen i brons i slutet av 3: e årtusendet f.Kr. Ren tenn själv isolerades första gången 1800 BCE av kinesiska och japanska metallarbetare.
Kvicksilver var känt av forntida kineser och indianer före 2000 f.Kr., och hittades i egyptiska gravar från 1500 f.Kr.
Den tidigaste kända tillverkningen av stål, en järn-kollegering, ses i bitar av järnvaror som grävts ut från en arkeologisk plats i Anatolien ( Kaman-Kalehöyük ) och är nästan 4000 år gamla, från 1800 fvt.
Från omkring 500 fvt svärdstillverkare i Toledo tillverkade Spanien tidiga former av legerat stål genom att tillsätta ett mineral som kallas wolframit , som innehöll volfram och mangan, till järnmalm (och kol). Det resulterande Toledo -stålet uppmärksammades i Rom när det användes av Hannibal i Puniska krig . Det blev snart grunden för de romerska legionernas vapen; deras svärd sades ha varit "så ivriga att det inte finns någon hjälm som inte kan skäras igenom av dem".
I förkolumbianskt Amerika började föremål tillverkade av tumbaga , en legering av koppar och guld, tillverkas i Panama och Costa Rica mellan 300 och 500 CE. Små metallskulpturer var vanliga och ett omfattande utbud av tumbaga (och guld) prydnader omfattade de vanliga regalierna för personer med hög status.
Ungefär samtidigt kombinerade inhemska ecuadorianer guld med en naturligt förekommande platinumlegering innehållande små mängder palladium, rodium och iridium, för att producera miniatyrer och masker bestående av en vitguld-platina-legering. Metallarbetarna involverade uppvärmt guld med korn av platinumlegeringen tills guldet smälte vid vilken tidpunkt platinagruppmetallerna blev bundna i guldet. Efter kylning hamrades den resulterande konglomerationen och uppvärmdes upprepade gånger tills den blev lika homogen som om alla berörda metaller hade smälts ihop (att uppnå smältpunkterna för de berörda platinagruppmetallerna var bortom dagens teknik).
-
En tallrik av tenn , en legering av 85–99% tenn och (vanligtvis) koppar. Tenn användes först i början av bronsåldern i Mellanöstern.
-
En pectoral (prydnadsbröstplatta) gjord av tumbaga , en legering av guld och koppar
Medeltiden
Koppar till hantverkaren som är listig på sitt yrke.
"Bra!" sade baronen, sittande i sin hall,
"Men järn - kallt järn - är herre över dem alla."
från Cold Iron av Rudyard Kipling
Arabiska och medeltida alkemister trodde att alla metaller och materia var sammansatta av principen om svavel, fader till alla metaller och bärande brännbar egendom, och principen om kvicksilver, moder till alla metaller och bärare av likviditet, smältbarhet och flyktighet egenskaper. Dessa principer var inte nödvändigtvis de vanliga ämnena svavel och kvicksilver som finns i de flesta laboratorier. Denna teori förstärkte tron att alla metaller var avsedda att bli guld i jordens tarmar genom de rätta kombinationerna av värme, matsmältning, tid och eliminering av föroreningar, som alla kunde utvecklas och påskyndas genom alkemiens kunskap och metoder .
Arsenik, zink, antimon och vismut blev känt, även om dessa först kallades halvmetaller eller bastardmetaller på grund av deras omåttlighet. Alla fyra kan ha använts för övrigt i tidigare tider utan att känna igen deras karaktär. Albertus Magnus tros ha varit den första som isolerade arsen från en förening år 1250 genom att värma tvål tillsammans med arsenik trisulfid . Metalliskt zink, som är sprött om det är orent, isolerades i Indien 1300 e.Kr. Den första beskrivningen av ett förfarande för isolering av antimon finns i boken De la pirotechnia från 1540 av Vannoccio Biringuccio . Vismut beskrevs av Agricola i De Natura Fossilium (c. 1546); det hade förväxlats i tidiga tider med tenn och bly på grund av dess likhet med dessa element.
Renässansen


Den första systematiska texten om gruvdrift och metallurgi var De la Pirotechnia (1540) av Vannoccio Biringuccio , som behandlar undersökning, sammansmältning och bearbetning av metaller.
Sexton år senare, Georgius Agricola publicerade De Re Metallica i 1556, en klar och fullständig redogörelse för yrket gruvdrift, metallurgi och tillbehörs Arts and Sciences, liksom kvalificerade som den största avhandling om den kemiska industrin genom det sextonde århundradet.
Han gav följande beskrivning av en metall i sitt De Natura Fossilium (1546):
Metall är en mineralkropp, till sin natur antingen flytande eller något hård. Den senare kan smälta av eldens värme, men när den har svalnat igen och tappat all värme blir den hård igen och återupptar sin rätta form. I detta avseende skiljer den sig från stenen som smälter i elden, för även om den senare återfår sin hårdhet, förlorar den ändå sin orörda form och egenskaper.
Traditionellt finns det sex olika sorters metaller, nämligen guld, silver, koppar, järn, tenn och bly. Det finns verkligen andra, för kvicksilver är en metall, även om alkemisterna inte håller med oss om detta ämne, och vismut är det också. De antika grekiska författarna verkar ha varit okunniga om vismut, varför Ammonius med rätta säger att det finns många metaller, djur och växter som är okända för oss. Stibium när det smälts i degeln och raffineras har lika mycket rätt att betraktas som en riktig metall som författare ger. Om det vid smältning tillsätts en viss portion till tenn, framställs en bokhandlarlegering av vilken typen tillverkas som används av dem som trycker böcker på papper.
Varje metall har sin egen form som den bevarar när den separeras från de metaller som blandades med den. Därför är varken electrum eller Stannum [inte betyder vårt tenn] i sig en riktig metall, utan snarare en legering av två metaller. Electrum är en legering av guld och silver, Stannum av bly och silver. Och ändå, om silver avskiljs från elektrummet, så återstår guld och inte elektrum; om silver tas ifrån Stannum, så finns bly kvar och inte Stannum.
Huruvida mässing finns som en infödd metall eller inte, kan inte fastställas med säkerhet. Vi vet bara om den konstgjorda mässingen, som består av koppar tonad med färgen på mineralet kalamin . Och ändå, om någon skulle grävas upp, skulle det vara en riktig metall. Svart och vitt koppar verkar skilja sig från det röda.
Metall är därför till sin natur antingen fast, som jag har sagt, eller flytande, som i det unika fallet med kvicksilver.
Men nu är det nog med den enkla typen.
Platina, den tredje ädelmetallen efter guld och silver, upptäcktes i Ecuador under perioden 1736 till 1744, av den spanska astronomen Antonio de Ulloa och hans kollega matematikern Jorge Juan y Santacilia. Ulloa var den första personen som skrev en vetenskaplig beskrivning av metallen 1748.
1789 kunde den tyska kemisten Martin Heinrich Klaproth isolera en oxid av uran, som han trodde var själva metallen. Klaproth krediterades därefter som upptäckaren av uran. Det var först 1841 som den franska kemisten Eugène-Melchior Péligot kunde förbereda det första provet av uranmetall. Henri Becquerel upptäckte därefter radioaktivitet 1896 genom att använda uran.
På 1790 -talet observerade Joseph Priestley och den nederländska kemisten Martinus van Marum metallytornas transformativa verkan på dehydrogenering av alkohol, en utveckling som senare ledde till 1831 syntes av industriell skala av svavelsyra med hjälp av en platinakatalysator.
1803 var cerium den första av lantanidmetallerna som upptäcktes i Bastnäs, Sverige av Jöns Jakob Berzelius och Wilhelm Hisinger, och oberoende av Martin Heinrich Klaproth i Tyskland. Lantanidmetallerna betraktades till stor del som konstigheter fram till 1960 -talet då metoder utvecklades för att mer effektivt skilja dem från varandra. De har därefter funnit användningar i mobiltelefoner, magneter, lasrar, belysning, batterier, katalysatorer och i andra applikationer som möjliggör modern teknik.
Andra metaller som upptäcktes och framställdes under denna tid var kobolt, nickel, mangan, molybden, volfram och krom; och några av platinagruppens metaller, palladium, osmium, iridium och rodium.
Lätta metaller
Alla metaller som upptäcktes fram till 1809 hade relativt höga densiteter; deras tyngd betraktades som ett särskiljande kriterium. Från 1809 och framåt isolerades lätta metaller som natrium, kalium och strontium. Deras låga densitet utmanade konventionell visdom när det gäller metaller. De uppträdde emellertid kemiskt som metaller och erkändes därefter som sådana.
Aluminium upptäcktes 1824 men det var först 1886 som en industriell storskalig produktionsmetod utvecklades. Priserna på aluminium sjönk och aluminium användes mycket i smycken, vardagsartiklar, glasögonramar, optiska instrument, porslin och folie på 1890 -talet och början av 1900 -talet. Aluminiums förmåga att bilda hårda men lätta legeringar med andra metaller gav metallen många användningsområden vid den tiden. Under första världskriget krävde stora regeringar stora transporter av aluminium för lätta starka flygramar. Den vanligaste metallen som används för elektrisk kraftöverföring idag är aluminiumledare stålförstärkt . Också mycket användbar är ledare av aluminiumlegering . Aluminium används eftersom det har ungefär hälften av vikten av en jämförbar motståndskopparkabel (fast större diameter på grund av lägre specifik konduktivitet ), samt att den är billigare. Koppar var mer populärt tidigare och används fortfarande, särskilt vid lägre spänningar och för jordning.
Medan rent metalliskt titan (99,9%) först framställdes 1910 användes det inte utanför laboratoriet förrän 1932. Under 1950- och 1960 -talen var Sovjetunionen en föregångare i användningen av titan i militära och ubåtstillämpningar som en del av program relaterade till kylan Krig. Från början av 1950-talet kom titan i stor utsträckning i användning inom militärflyg, särskilt i högpresterande jetflygplan, som började med flygplan som F-100 Super Sabre och Lockheed A-12 och SR-71 .
Metalliskt skandium tillverkades första gången 1937. Det första pundet 99% ren skandiummetall tillverkades 1960. Produktionen av aluminium-skandiumlegeringar började 1971 efter ett amerikanskt patent. Aluminium-skandiumlegeringar utvecklades också i Sovjetunionen.
Stålåldern

Den moderna eran i ståltillverkning började med införandet av Henry Bessemer s Bessemer process 1855, råmaterialet för vilket var tackjärn. Hans metod lät honom producera stål i stora mängder billigt, och därför kom mjukt stål att användas för de flesta ändamål för vilka smidesjärn tidigare användes. Gilchrist-Thomas-processen (eller grundläggande Bessemer-processen ) var en förbättring av Bessemer-processen, gjord genom att beklädda omvandlaren med ett grundmaterial för att avlägsna fosfor.
På grund av sin höga draghållfasthet och låga kostnad blev stål en viktig komponent som används i byggnader , infrastruktur , verktyg , fartyg , bilar , maskiner , apparater och vapen .
År 1872 patenterade engelsmännen Clark och Woods en legering som idag skulle betraktas som ett rostfritt stål. Korrosionsbeständigheten hos järnkromlegeringar hade erkänts 1821 av den franske metallurgisten Pierre Berthier. Han noterade deras motståndskraft mot angrepp av vissa syror och föreslog att de skulle användas i bestick. Metallurgister från 1800-talet kunde inte producera kombinationen av lågkolhaltigt och högt krom som finns i de flesta moderna rostfria stål, och de högkromlegeringar de kunde producera var för spröda för att vara praktiska. Det var inte förrän 1912 som industrialiseringen av legeringar av rostfritt stål skedde i England, Tyskland och USA.
De sista stabila metallelementen
År 1900 återstod tre metaller med atomnummer mindre än bly (#82), den tyngsta stabila metallen: elementen 71, 72, 75.
Von Welsbach, 1906, bevisade att det gamla ytterbiet också innehöll ett nytt element (#71), som han kallade cassiopeium . Urbain bevisade detta samtidigt, men hans prover var mycket orena och innehöll endast spårmängder av det nya elementet. Trots detta antogs hans valda namn lutetium .
1908 fann Ogawa element 75 i thorianit men tilldelade det som element 43 istället för 75 och gav det namnet nipponium . År 1925 meddelade Walter Noddack, Ida Eva Tacke och Otto Berg att det skilde sig från gadolinit och gav det nuvarande namnet rhenium .
Georges Urbain påstod att ha hittat element 72 i sällsynta jordartsmetaller, medan Vladimir Vernadsky självständigt hittade det i ortit. Ingen av påståenden bekräftades på grund av första världskriget, och ingen kunde bekräftas senare, eftersom kemin de rapporterade inte stämmer överens med den som nu är känd för hafnium . Efter kriget, 1922, hittade Coster och Hevesy det genom röntgenspektroskopisk analys i norsk zirkon. Hafnium var alltså det sista stabila elementet som upptäcktes.
Vid slutet av andra världskriget hade forskare syntetiserat fyra posturanelement, som alla är radioaktiva (instabila) metaller: neptunium (1940), plutonium (1940–41) och curium och americium (1944), som representerar element 93 till 96. De två första av dessa hittades så småningom också i naturen. Curium och americium var biprodukter från Manhattan-projektet, som producerade världens första atombomb 1945. Bomben baserades på kärnklyvningen av uran, en metall som först trodde att man hade upptäckt nästan 150 år tidigare.
Utvecklingen efter andra världskriget
Superlegeringar
Superlegeringar sammansatta av kombinationer av Fe, Ni, Co och Cr och mindre mängder W, Mo, Ta, Nb, Ti och Al utvecklades strax efter andra världskriget för användning i högpresterande motorer som arbetar vid förhöjda temperaturer (ovan 650 ° C (1200 ° F)). De behåller det mesta av sin styrka under dessa förhållanden under långa perioder och kombinerar god lågtemperatur-seghet med motståndskraft mot korrosion eller oxidation. Superlegeringar kan nu hittas i ett brett spektrum av applikationer, inklusive land-, sjö- och rymdturbiner och kemiska och petroleumanläggningar.
Transcurium -metaller
Den framgångsrika utvecklingen av atombomben i slutet av andra världskriget väckte ytterligare ansträngningar att syntetisera nya element, som nästan alla är, eller förväntas vara, metaller och som alla är radioaktiva. Det var inte förrän 1949 som element 97 (berkelium), nästa efter element 96 (curium), syntetiserades genom att avfyra alfapartiklar mot ett americium -mål. År 1952 hittades element 100 (fermium) i skräp från den första vätebombsexplosionen; väte, ett icke -metall, hade identifierats som ett element nästan 200 år tidigare. Sedan 1952 har elementen 101 (mendelevium) till 118 (oganesson) syntetiserats.
Bulkiga metalliska glasögon
Ett metalliskt glas (även känt som en amorf eller glasartad metall) är ett fast metalliskt material, vanligtvis en legering, med störd atomskala struktur. De flesta rena och legerade metaller, i sitt fasta tillstånd, har atomer arrangerade i en mycket ordnad kristallin struktur. Amorfa metaller har en icke-kristallin glasliknande struktur. Men till skillnad från vanliga glasögon, som fönsterglas, som vanligtvis är elektriska isolatorer, har amorfa metaller god elektrisk konduktivitet. Amorfa metaller produceras på flera sätt, inklusive extremt snabb kylning, fysikalisk ångavsättning, reaktion i fast tillstånd, jonbestrålning och mekanisk legering. Det första rapporterade metallglaset var en legering (Au 75 Si 25 ) som tillverkades vid Caltech 1960. Mer nyligen har partier av amorft stål med tre gånger styrkan av konventionella stållegeringar producerats. För närvarande är de viktigaste tillämpningarna beroende av de speciella magnetiska egenskaperna hos vissa ferromagnetiska metallglas. Den låga magnetiseringsförlusten används i högeffektiva transformatorer. Stöldkontroll -ID -taggar och andra artikelövervakningssystem använder ofta metalliska glasögon på grund av dessa magnetiska egenskaper.
Formminneslegeringar
En formminneslegering (SMA) är en legering som "kommer ihåg" sin ursprungliga form och när den deformeras återgår till sin fördeformerade form vid uppvärmning. Medan formminneseffekten först observerades 1932, i en Au-Cd-legering, var det först 1962, med en oavsiktlig upptäckt av effekten i en Ni-Ti-legering som forskningen började på allvar och ytterligare tio år innan kommersiell applikationer dök upp. SMA har tillämpningar inom robotik och fordons-, flyg- och biomedicinsk industri. Det finns en annan typ av SMA, kallad en ferromagnetisk formminneslegering (FSMA), som ändrar form under starka magnetfält. Dessa material är av särskilt intresse eftersom det magnetiska svaret tenderar att vara snabbare och mer effektivt än temperaturinducerade svar.
Kvasicyrstallina legeringar
År 1984 hittade den israeliska kemisten Dan Shechtman en aluminium-manganlegering med femfaldig symmetri, i strid med den kristallografiska konventionen vid den tiden som sa att kristallina strukturer bara kunde ha två-, tre-, fyra- eller sexfaldiga symmetri. På grund av rädsla för det vetenskapliga samfundets reaktion tog det två år att publicera resultaten för vilka han tilldelades Nobelpriset i kemi 2011. Sedan denna tid har hundratals kvasikristaller rapporterats och bekräftats. De finns i många metalllegeringar (och vissa polymerer). Kvasikristaller finns oftast i aluminiumlegeringar (Al-Li-Cu, Al-Mn-Si, Al-Ni-Co, Al-Pd-Mn, Al-Cu-Fe, Al-Cu-V, etc.), men många andra kompositioner är också kända (Cd-Yb, Ti-Zr-Ni, Zn-Mg-Ho, Zn-Mg-Sc, In-Ag-Yb, Pd-U-Si, etc.). Kvasikristaller har effektivt oändligt stora enhetsceller. Icosahedrite Al 63 Cu 24 Fe 13 , den första kvasikristall som finns i naturen, upptäcktes 2009. De flesta kvasikristaller har keramikliknande egenskaper inklusive låg elektrisk konduktivitet (närmar sig värden som ses i isolatorer) och låg värmeledningsförmåga, hög hårdhet, sprödhet och motstånd mot korrosion och non-stick egenskaper. Kvasikristaller har använts för att utveckla värmeisolering, lysdioder, dieselmotorer och nya material som omvandlar värme till el. Nya tillämpningar kan dra nytta av den låga friktionskoefficienten och hårdheten hos vissa kvaskristallina material, till exempel inbäddning av partiklar i plast för att tillverka starka, slitstarka, lågfriktionsplastdrev. Andra potentiella tillämpningar inkluderar selektiva solabsorbatorer för effektomvandling, bredvågslängdreflektorer och benreparations- och protesapplikationer där biokompatibilitet, låg friktion och korrosionsbeständighet krävs.
Komplexa metalllegeringar
Komplexa metalllegeringar (CMA) är intermetalliska föreningar som kännetecknas av stora enhetsceller som omfattar några tiotals upp till tusentals atomer; närvaron av väldefinierade kluster av atomer (ofta med ikosahedrisk symmetri); och partiell störning inom sina kristallina galler. De består av två eller flera metalliska element, ibland med metalloider eller kalkogenider tillsatta. De inkluderar till exempel NaCd2, med 348 natriumatomer och 768 kadmiumatomer i enhetscellen. Linus Pauling försökte beskriva strukturen för NaCd 2 1923, men lyckades inte förrän 1955. Först kallades "jätteenhetens cellkristaller", intresset för CMA, som de kom att kallas, tog inte fart förrän 2002, med publicering av en uppsats som heter "Structurally Complex Alloy Phases", som hölls vid den åttonde internationella konferensen om kvasikristaller. Potentiella tillämpningar av CMA inkluderar värmeisolering; solvärme; magnetiska kylskåp; använda spillvärme för att generera el; och beläggningar för turbinblad i militära motorer.
Legeringar med hög entropi
Legeringar med hög entropi (HEA) som AlLiMgScTi består av lika eller nästan lika stora kvantiteter av fem eller flera metaller. Jämfört med konventionella legeringar med endast en eller två basmetaller har HEA betydligt bättre styrka / vikt-förhållanden, högre draghållfasthet och större motståndskraft mot sprickbildning, korrosion och oxidation. Även om HEA beskrevs redan 1981, utvecklades inte ett betydande intresse förrän under 2010 -talet; de fortsätter att vara i fokus för forskning inom materialvetenskap och teknik på grund av deras potential för önskvärda egenskaper.
MAX -faslegeringar
| MAX | M | A | X |
|---|---|---|---|
| Hf 2 SnC | Hf | Sn | C |
| Ti 4 AlN 3 | Ti | Al | N |
| Ti 3 SiC 2 | Ti | Si | C |
| Ti 2 AlC | Ti | Al | C |
| Cr 2 AlC 2 | Cr | Al | C |
| Ti 3 AlC 2 | Ti | Al | C |
I en MAX -faslegering är M en tidig övergångsmetall, A är ett A -gruppelement (mestadels grupp IIIA och IVA, eller grupperna 13 och 14), och X är antingen kol eller kväve. Exempel är Hf 2 SnC och Ti 4 AIN 3 . Sådana legeringar har några av de bästa egenskaperna hos metaller och keramik. Dessa egenskaper inkluderar hög elektrisk och värmeledningsförmåga, värmechockmotstånd, skadetolerans, bearbetbarhet, hög elastisk styvhet och låga termiska expansionskoefficienter. </ref> De kan poleras till en metallisk glans på grund av deras utmärkta elektriska ledningsförmåga. Under mekanisk testning har det visat sig att polykristallina Ti 3 SiC 2 -cylindrar kan komprimeras upprepade gånger vid rumstemperatur, upp till spänningar på 1 GPa, och återhämta sig fullständigt vid avlägsnande av lasten. Vissa MAX-faser är också mycket resistenta mot kemiska angrepp (t.ex. Ti 3 SiC 2 ) och oxidation vid hög temperatur i luft (Ti 2 AlC, Cr 2 AlC 2 och Ti 3 AlC 2 ). Potentiella applikationer för MAX-faslegeringar inkluderar: som tuffa, bearbetningsbara, värmechockbeständiga eldfasta material; värmeelement med hög temperatur; beläggningar för elektriska kontakter; och neutronbestrålningsresistenta delar för kärntekniska applikationer. Medan MAX -faslegeringar upptäcktes på 1960 -talet, publicerades den första uppsatsen om ämnet först 1996.
Se även
Anteckningar
Referenser
Vidare läsning
- Choptuik MW , Lehner L. & Pretorias F. 2015, "Probing strong-field gravity through numerical simulation", i A. Ashtekar , BK Berger , J. Isenberg & M. MacCallum (red.), General Relativity and Gravitation: A Centennial Perspective , Cambridge University Press, Cambridge, ISBN 978-1-107-03731-1 .
- Cox PA 1997, Elementen: deras ursprung, överflöd och distribution, Oxford University Press, Oxford, ISBN 978-0-19-855298-7
- Crow JM 2016, " Omöjliga legeringar: Hur man gör metaller som vi aldrig sett tidigare ", New Scientist, 12 oktober
- Hadhazy A. 2016, " Galaktisk" guldgruva "förklarar ursprunget till naturens tyngsta element ", Science Spotlights , 10 maj 2016, öppnade 11 juli 2016.
- Hofmann S. 2002, On Beyond Uranium: Journey to the End of the Periodic Table , Taylor & Francis , London, ISBN 978-0-415-28495-0 .
- Padmanabhan T. 2001, Theoretical Astrophysics , vol. 2, Stars and Stellar Systems, Cambridge University Press , Cambridge, ISBN 978-0-521-56241-6 .
- Parish RV 1977, The metallic elements, Longman, London, ISBN 978-0-582-44278-8
- Podosek FA 2011, "Noble gases", i HD Holland & KK Turekian (red), Isotope Geochemistry: From the Treatise on Geochemistry , Elsevier, Amsterdam, s. 467–492, ISBN 978-0-08-096710-3 .
- Raymond R. 1984, Out of the eldy ugn: Metallers inverkan på mänsklighetens historia, Macmillan Australia, Melbourne, ISBN 978-0-333-38024-6
- Rehder D. 2010, Chemistry in Space: From Interstellar Matter to the Origin of Life , Wiley-VCH, Weinheim, ISBN 978-3-527-32689-1 .
- Russell AM & Lee KL 2005, Struktur-fastighetsrelationer i icke-järnmetaller, John Wiley & Sons, Hoboken, New Jersey, ISBN 978-0-471-64952-6
- Street A. & Alexander W. 1998, Metals in service of man, 11: e upplagan, Penguin Books, London, ISBN 978-0-14-025776-2
- Wilson AJ 1994, The living rock: Theory of metals sedan de äldsta tiderna och deras inverkan på utvecklingen av civilisationen , Woodhead Publishing, Cambridge, ISBN 978-1-85573-154-7
externa länkar
- ASM International (tidigare American Society for Metals)
- Stark som titan, billig som smuts: nya stållegeringar lyser
- Hemsidan för samhället för mineraler, metaller och material