Uran -Uranium
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Uran | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Uttal |
/ j ʊ ˈ r eɪ n i ə m / ( yuu- RAY -nee-əm ) |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | silvergrå metallisk; korroderar till en sprickande svart oxidbeläggning i luft | |||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomvikt A r, std (U) | 238,028 91 (3) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Uran i det periodiska systemet | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer ( Z ) | 92 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Grupp | grupp n/a | |||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 7 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Blockera | f-block | |||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [ Rn ] 5f 3 6d 1 7s 2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner per skal | 2, 8, 18, 32, 21, 9, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Fas vid STP | fast | |||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 1405,3 K (1132,2 °C, 2070 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 4404 K (4131 °C, 7468 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Densitet (nära rt ) | 19,1 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| när flytande (vid mp ) | 17,3 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Värme av fusion | 9,14 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||
| Förångningsvärme | 417,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||
| Molär värmekapacitet | 27,665 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||
Ångtryck
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomegenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | +1, +2, +3, +4 , +5, +6 (en amfoter oxid) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronnegativitet | Pauling-skala: 1,38 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Joniseringsenergier | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom radie | empiri: 156 pm | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 196±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radie | 186 pm | |||||||||||||||||||||||||||||||||||||||||||||||||
| Spektrallinjer av uran | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Övriga fastigheter | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Naturlig förekomst | ursprunglig | |||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | ortorombisk | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ljudhastighet tunn stång | 3155 m/s (vid 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Termisk expansion | 13,9 µm/(m⋅K) (vid 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 27,5 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk resistans | 0,280 µΩ⋅m (vid 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetisk beställning | paramagnetisk | |||||||||||||||||||||||||||||||||||||||||||||||||
| Youngs modul | 208 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Skjuvmodul | 111 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Bulkmodul | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson-förhållande | 0,23 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hårdhet | 1960–2500 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hårdhet | 2350–3850 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Namngivning | efter planeten Uranus , själv uppkallad efter den grekiska himlens gud Uranus | |||||||||||||||||||||||||||||||||||||||||||||||||
| Upptäckt | Martin Heinrich Klaproth (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Första isoleringen | Eugène-Melchior Péligot (1841) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Huvudisotoper av uran | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Uran är ett kemiskt grundämne med symbolen U och atomnummer 92. Det är en silvergrå metall i aktinidserien i det periodiska systemet . En uranatom har 92 protoner och 92 elektroner , varav 6 är valenselektroner . Uran är svagt radioaktivt eftersom alla isotoper av uran är instabila; halveringstiden för dess naturligt förekommande isotoper varierar mellan 159 200 år och 4,5 miljarder år. De vanligaste isotoperna i naturligt uran är uran-238 (som har 146 neutroner och står för över 99% av uran på jorden) och uran-235 (som har 143 neutroner). Uran har den högsta atomvikten av de ursprungligen förekommande grundämnena. Dess densitet är cirka 70 % högre än för bly och något lägre än för guld eller volfram . Det förekommer naturligt i låga koncentrationer på några miljondelar i jord, berg och vatten, och utvinns kommersiellt från uranhaltiga mineraler som uraninit .
I naturen finns uran som uran-238 (99,2739–99,2752%), uran-235 (0,7198–0,7202%) och en mycket liten mängd uran-234 (0,0050–0,0059%). Uran sönderfaller långsamt genom att avge en alfapartikel . Halveringstiden för uran-238 är cirka 4,47 miljarder år och för uran-235 är 704 miljoner år, vilket gör dem användbara för att datera jordens ålder .
Många moderna användningar av uran utnyttjar dess unika kärnkraftsegenskaper . Uran-235 är den enda naturligt förekommande klyvbara isotopen , vilket gör att den används flitigt i kärnkraftverk och kärnvapen . Men på grund av de små mängder som finns i naturen måste uran genomgå anrikning så att tillräckligt med uran-235 är närvarande. Uranium-238 är klyvbart av snabba neutroner och är fertilt , vilket betyder att det kan omvandlas till klyvbart plutonium-239 i en kärnreaktor . En annan klyvbar isotop, uran-233 , kan framställas från naturligt torium och studeras för framtida industriell användning inom kärnteknik. Uran-238 har en liten sannolikhet för spontan fission eller till och med inducerad fission med snabba neutroner; uran-235 och i mindre grad uranium-233 har ett mycket högre fissionstvärsnitt för långsamma neutroner. I tillräcklig koncentration upprätthåller dessa isotoper en ihållande kärnkedjereaktion . Detta genererar värmen i kärnkraftsreaktorer och producerar klyvbart material för kärnvapen. Utarmat uran ( 238 U) används i penetratorer för kinetisk energi och pansarplätering . Uran används som färgämne i uranglas , vilket ger citrongula till gröna färger. Uranglas fluorescerar grönt i ultraviolett ljus. Den användes också för toning och skuggning i tidig fotografering .
Upptäckten 1789 av uran i mineralet pitchblende krediteras Martin Heinrich Klaproth , som döpte det nya grundämnet efter den nyligen upptäckta planeten Uranus . Eugène-Melchior Péligot var den första personen som isolerade metallen och dess radioaktiva egenskaper upptäcktes 1896 av Henri Becquerel . Forskning av Otto Hahn , Lise Meitner , Enrico Fermi och andra, såsom J. Robert Oppenheimer från 1934 ledde till att det användes som bränsle i kärnkraftsindustrin och i Little Boy , det första kärnvapen som användes i krig . En efterföljande kapprustning under det kalla kriget mellan USA och Sovjetunionen producerade tiotusentals kärnvapen som använde uranmetall och uranhärlett plutonium-239 . Säkerheten för dessa vapen övervakas noga. Sedan omkring 2000 används plutonium som erhållits genom att demontera bomber från kalla krigets eran som bränsle för kärnreaktorer. Utvecklingen och utbyggnaden av dessa kärnreaktorer fortsätter på en global bas eftersom de är kraftfulla källor till CO 2 -fri energi.
Egenskaper
När det raffineras är uran en silvervit, svagt radioaktiv metall . Den har en Mohs hårdhet på 6, tillräcklig för att repa glas och ungefär lika med den för titan , rodium , mangan och niob . Den är formbar , formbar , lätt paramagnetisk , starkt elektropositiv och en dålig elektrisk ledare . Uranmetall har en mycket hög densitet på 19,1 g/cm 3 , tätare än bly (11,3 g/cm 3 ), men något mindre tät än volfram och guld (19,3 g/cm 3 ).
Uranmetall reagerar med nästan alla icke-metalliska element (med undantag för ädelgaserna ) och deras föreningar , med reaktiviteten som ökar med temperaturen. Saltsyra och salpetersyra löser upp uran, men andra icke-oxiderande syror än saltsyra angriper grundämnet mycket långsamt. När den är finfördelad kan den reagera med kallt vatten; i luft blir uranmetall belagd med ett mörkt lager av uranoxid . Uran i malmer utvinns kemiskt och omvandlas till urandioxid eller andra kemiska former som är användbara inom industrin.
Uranium-235 var den första isotopen som visade sig vara klyvbar . Andra naturligt förekommande isotoper är klyvbara, men inte klyvbara. Vid bombardemang med långsamma neutroner kommer dess uran-235 isotop för det mesta att delas i två mindre kärnor , vilket frigör kärnkraft och fler neutroner. Om för många av dessa neutroner absorberas av andra uran-235 kärnor uppstår en kärnkedjereaktion som resulterar i en värmesprängning eller (under särskilda omständigheter) en explosion. I en kärnreaktor bromsas en sådan kedjereaktion och kontrolleras av ett neutrongift som absorberar några av de fria neutronerna. Sådana neutronabsorberande material är ofta en del av reaktorstyrstavar ( se kärnreaktorfysik för en beskrivning av denna process för reaktorstyrning).
Så lite som 15 lb (6,8 kg) uran-235 kan användas för att göra en atombomb. Kärnvapnet som detonerade över Hiroshima , kallat Little Boy , förlitade sig på klyvning av uran. Den första kärnvapenbomben ( Gadgeten som användes vid Trinity ) och bomben som detonerades över Nagasaki ( Fat Man ) var dock båda plutoniumbomber.
Uranmetall har tre allotropa former:
- α ( ortorombisk ) stabil upp till 668 °C (1 234 °F). Ortorhombisk, rymdgrupp nr 63, Cmcm , gitterparametrar a = 285,4 pm, b = 587 pm, c = 495,5 pm.
- β ( tetragonal ) stabil från 668 till 775 °C (1 234 till 1 427 °F). Tetragonal, rymdgrupp P42 / mnm , P42nm eller P4n2 , gitterparametrar a = 565,6 pm , b = c = 1075,9 pm .
- γ ( kroppscentrerad kubik ) från 775 °C (1 427 °F) till smältpunkt – detta är det mest formbara och formbara tillståndet. Kroppscentrerad kubik, gitterparameter a = 352,4 pm.
Ansökningar
Militär

Den huvudsakliga användningen av uran i den militära sektorn är i penetratorer med hög densitet. Denna ammunition består av utarmat uran (DU) legerat med 1–2 % andra grundämnen, såsom titan eller molybden . Vid hög anslagshastighet möjliggör projektilens densitet, hårdhet och pyroforicitet förstörelse av tungt bepansrade mål. Tankpansar och andra avtagbara fordonspansar kan också härdas med utarmade uranplattor. Användningen av utarmat uran blev politiskt och miljömässigt kontroversiellt efter att USA, Storbritannien och andra länder använde sådan ammunition under krig i Persiska viken och på Balkan väckte frågor angående uranföreningar kvar i marken (se Gulf War syndrome ).
Utarmat uran används också som skyddsmaterial i vissa behållare som används för att lagra och transportera radioaktivt material. Även om metallen i sig är radioaktiv, gör dess höga densitet den mer effektiv än bly för att stoppa strålning från starka källor som radium . Andra användningsområden för utarmat uran inkluderar motvikter för flygplanskontrollytor, som ballast för missiler för återinträdesfordon och som ett avskärmningsmaterial. På grund av sin höga densitet finns detta material i tröghetsstyrningssystem och i gyroskopiska kompasser . Utarmat uran föredras framför liknande täta metaller på grund av dess förmåga att lätt bearbetas och gjutas samt dess relativt låga kostnad. Den största risken för exponering för utarmat uran är kemisk förgiftning av uranoxid snarare än radioaktivitet (uran är bara en svag alfasändare ).
Under andra världskrigets senare skeden , hela det kalla kriget , och i mindre utsträckning därefter, har uran-235 använts som det klyvbara explosiva materialet för att producera kärnvapen. Inledningsvis byggdes två huvudtyper av fissionsbomber: en relativt enkel anordning som använder uran-235 och en mer komplicerad mekanism som använder plutonium-239 härrörande från uran-238. Senare byggdes en mycket mer komplicerad och mycket kraftfullare typ av klyvnings-/fusionsbomb ( termonukleärt vapen ), som använder en plutoniumbaserad enhet för att få en blandning av tritium och deuterium att genomgå kärnfusion . Sådana bomber är mantlade i ett icke-klyvbart (oanrikat) uranhölje, och de får mer än hälften av sin kraft från klyvningen av detta material av snabba neutroner från kärnfusionsprocessen.
Civil

Den huvudsakliga användningen av uran i den civila sektorn är att driva kärnkraftverk . Ett kilogram uran-235 kan teoretiskt producera cirka 20 terajoule energi (2 × 1013 joule ), förutsatt fullständig fission; lika mycket energi som 1,5 miljoner kilo (1 500 ton ) kol .
Kommersiella kärnkraftverk använder bränsle som vanligtvis är anrikat till cirka 3 % uran-235. CANDU- och Magnox - konstruktionerna är de enda kommersiella reaktorerna som kan använda oanrikat uranbränsle. Bränsle som används för United States Navy reaktorer är vanligtvis starkt anrikat i uran-235 (de exakta värdena är klassificerade ). I en förädlingsreaktor kan uran-238 också omvandlas till plutonium genom följande reaktion:

Före (och ibland efter) upptäckten av radioaktivitet användes uran främst i små mängder för gult glas och keramikglasyrer, såsom uranglas och i Fiestaware .
Upptäckten och isoleringen av radium i uranmalm (pitchblende) av Marie Curie satte igång utvecklingen av uranbrytning för att utvinna radium, som användes för att göra glöd-i-mörkerfärger för ur och flygplansvisare. Detta lämnade en enorm mängd uran som avfallsprodukt, eftersom det krävs tre ton uran för att utvinna ett gram radium. Denna avfallsprodukt avleddes till glasindustrin, vilket gjorde uranglasyrer mycket billiga och rikliga. Förutom keramikglasyrer stod urankakelglasyrer för huvuddelen av användningen, inklusive gemensamma badrums- och köksplattor som kan tillverkas i grönt, gult, lila , svart, blått, rött och andra färger.

Uran användes också i fotografiska kemikalier (särskilt uraniumnitrat som toner ), i lamptrådar för scenbelysningslampor , för att förbättra utseendet på proteser , och i läder- och träindustrin för fläckar och färgämnen. Uransalter är betningsmedel av silke eller ull. Uranylacetat och uranylformiat används som elektrontäta "fläckar" i transmissionselektronmikroskopi , för att öka kontrasten hos biologiska prover i ultratunna snitt och vid negativ färgning av virus , isolerade cellorganeller och makromolekyler .
Upptäckten av uranets radioaktivitet inledde ytterligare vetenskapliga och praktiska användningar av grundämnet. Den långa halveringstiden för isotopen uranium-238 (4,47 × 109 år) gör den väl lämpad för användning för att uppskatta åldern på de tidigaste magmatiska bergarterna och för andra typer av radiometrisk datering , inklusive uran-torium-datering , uran-bly-datering och uran-uran-datering . Uranmetall används för röntgenmål vid framställning av högenergiröntgenstrålar.
Historia
Användning före upptäckt

Användningen av uran i dess naturliga oxidform går tillbaka till åtminstone år 79 e.Kr. , då det användes i Romarriket för att lägga till en gul färg till keramiska glasyrer. Gult glas med 1 % uranoxid hittades i en romersk villa på Cape Posillipo i Neapelbukten , Italien, av RT Gunther från University of Oxford 1912. Från och med senmedeltiden utvanns beckblende från Habsburgs silvergruvor i Joachimsthal , Böhmen (nu Jáchymov i Tjeckien), och användes som färgämne i den lokala glastillverkningsindustrin . I början av 1800-talet var världens enda kända källor till uranmalm dessa gruvor. Brytning av uran i Ertsbergen upphörde på tysk sida efter det kalla krigets slut och SDAG Wismut avvecklades. På den tjeckiska sidan förekom försök under uranprisbubblan 2007 att återuppta gruvbrytning, men dessa övergavs snabbt efter ett fall i uranpriserna.
Upptäckt

Upptäckten av grundämnet krediteras den tyske kemisten Martin Heinrich Klaproth . Medan han arbetade i sitt experimentella laboratorium i Berlin 1789, kunde Klaproth fälla ut en gul förening (troligen natriumdiuranat ) genom att lösa upp beckblende i salpetersyra och neutralisera lösningen med natriumhydroxid . Klaproth antog att det gula ämnet var oxiden av ett ännu oupptäckt grundämne och värmde det med träkol för att få ett svart pulver, som han trodde var den nyupptäckta metallen i sig (i själva verket var det pulvret en oxid av uran). Han döpte det nyupptäckta elementet efter planeten Uranus (uppkallad efter den ursprungliga grekiska himlens gud ), som hade upptäckts åtta år tidigare av William Herschel .
År 1841 isolerade Eugène-Melchior Péligot , professor i analytisk kemi vid Conservatoire National des Arts et Métiers (Central School of Arts and Manufactures) i Paris , det första provet av uranmetall genom att värma urantetraklorid med kalium .
Henri Becquerel upptäckte radioaktivitet genom att använda uran 1896. Becquerel gjorde upptäckten i Paris genom att lämna ett prov av ett uransalt, K 2 UO 2 (SO 4 ) 2 (kaliumuranylsulfat), ovanpå en oexponerad fotografisk platta i en låda och noterade att plattan hade blivit "immig". Han fastställde att en form av osynligt ljus eller strålar som sänds ut av uran hade exponerat plattan.
Under första världskriget, när centralmakterna led av brist på molybden för att tillverka artilleripönor och höghastighetsverktygsstål, ersatte de rutinmässigt ferrourangegeringar som har många av samma fysiska egenskaper. När denna praxis blev känd 1916 bad USA:s regering flera framstående universitet att undersöka dessa användningar för uran och verktyg gjorda med dessa formler förblev i användning i flera decennier och slutade först när Manhattanprojektet och det kalla kriget ställde en stor efterfrågan på uran för klyvning forskning och vapenutveckling.
Fissionsforskning
Ett team ledd av Enrico Fermi 1934 observerade att bombardering av uran med neutroner producerar utsläpp av beta-strålar ( elektroner eller positroner från de grundämnen som produceras; se beta-partikel ). Klyvningsprodukterna förväxlades först med nya grundämnen med atomnummer 93 och 94, som dekanus vid Roms fakultet, Orso Mario Corbino, döpte till ausonium respektive hesperium . Experimenten som ledde till upptäckten av uranets förmåga att klyva (bryta isär) till lättare grundämnen och frigöra bindningsenergi utfördes av Otto Hahn och Fritz Strassmann i Hahns laboratorium i Berlin. Lise Meitner och hennes brorson, fysikern Otto Robert Frisch , publicerade den fysiska förklaringen i februari 1939 och kallade processen " kärnklyvning ". Strax efter antog Fermi att klyvningen av uran kan frigöra tillräckligt med neutroner för att upprätthålla en klyvningsreaktion. Bekräftelse av denna hypotes kom 1939, och senare arbete fann att i genomsnitt cirka 2,5 neutroner frigörs vid varje klyvning av den sällsynta uranisotopen uranium-235. Fermi uppmanade Alfred OC Nier att separera uranisotoper för bestämning av den klyvbara komponenten, och den 29 februari 1940 använde Nier ett instrument som han byggde vid University of Minnesota för att separera världens första uran-235- prov i Tate Laboratory. Efter att ha skickats till Columbia Universitys cyklotron bekräftade John Dunning att provet var det isolerade klyvbara materialet den 1 mars. Ytterligare arbete visade att den mycket vanligare uran-238-isotopen kan omvandlas till plutonium, som, liksom uran-235, också är klyvbart av termiska neutroner. Dessa upptäckter ledde till att många länder började arbeta med utvecklingen av kärnvapen och kärnkraft . Trots att klyvning hade upptäckts i Tyskland, försvårades Uranverein ("uranklubben") Tysklands krigstida projekt för att forska om kärnkraft och/eller vapen av begränsade resurser, strider, exil eller icke-inblandning av flera framstående vetenskapsmän på området och flera avgörande misstag som att inte ta hänsyn till föroreningar i tillgängliga grafitprover som gjorde att den verkade mindre lämplig som neutronmoderator än den är i verkligheten. Tysklands försök att bygga en naturlig uran / tungvattenreaktor hade inte kommit i närheten av att nå kritik när amerikanerna nådde Haigerloch , platsen för det sista tyska reaktorexperimentet under krigstid.
Den 2 december 1942, som en del av Manhattan Project , kunde ett annat team under ledning av Enrico Fermi initiera den första konstgjorda självförsörjande kärnkraftskedjereaktionen , Chicago Pile-1 . En första plan med anrikat uran-235 övergavs eftersom det ännu inte var tillgängligt i tillräckliga mängder. Teamet arbetade i ett labb under läktaren på Stagg Field vid University of Chicago och skapade förutsättningarna för en sådan reaktion genom att stapla ihop 400 korta ton (360 ton ) grafit , 58 korta ton (53 ton) uran. oxid och sex korta ton (5,5 ton) uranmetall, varav en majoritet levererades av Westinghouse Lamp Plant i en provisorisk produktionsprocess.
Kärnvapen

Två huvudtyper av atombomber utvecklades av USA under andra världskriget : en uranbaserad anordning (kodnamnet " Little Boy ") vars klyvbara material var starkt anrikat uran , och en plutoniumbaserad anordning (se Trinity-testet och " Fat " Man ") vars plutonium härrörde från uran-238. Den uranbaserade Little Boy-anordningen blev det första kärnvapnet som användes i krig när det detonerades över den japanska staden Hiroshima den 6 augusti 1945. Exploderande med en avkastning motsvarande 12 500 ton TNT , förstörde explosionen och termiska vågen av bomben nästan 50 000 byggnader och dödade cirka 75 000 människor (se atombombningar av Hiroshima och Nagasaki ). Till en början trodde man att uran var relativt sällsynt och att kärnvapenspridning kunde undvikas genom att helt enkelt köpa upp alla kända uranlager, men inom ett decennium upptäcktes stora fyndigheter av det på många platser runt om i världen.
Reaktorer

X -10 grafitreaktorn vid Oak Ridge National Laboratory (ORNL) i Oak Ridge, Tennessee, tidigare känd som Clinton Pile och X-10 Pile, var världens andra konstgjorda kärnreaktor (efter Enrico Fermis Chicago Pile) och var den första reaktor designad och byggd för kontinuerlig drift. Argonne National Laboratory 's Experimental Breeder Reactor I , belägen vid Atomic Energy Commissions National Reactor Testing Station nära Arco, Idaho , blev den första kärnreaktorn som skapade elektricitet den 20 december 1951. Till en början tändes fyra 150-watts glödlampor av reaktorn, men förbättringar gjorde det så småningom möjligt för den att driva hela anläggningen (senare blev staden Arco den första i världen som fick all sin el från kärnkraft genererad av BORAX-III , en annan reaktor designad och drevs av Argonne National Laboratory ) . Världens första kärnkraftverk i kommersiell skala, Obninsk i Sovjetunionen , började genereras med sin reaktor AM-1 den 27 juni 1954. Andra tidiga kärnkraftverk var Calder Hall i England , som började genereras den 17 oktober 1956, och Shippingport Atomkraftverk i Pennsylvania , som startade den 26 maj 1958. Kärnkraft användes för första gången för framdrivning av en ubåt , USS Nautilus , 1954.
Förhistorisk naturligt förekommande klyvning
1972 upptäckte den franske fysikern Francis Perrin femton gamla och inte längre aktiva naturliga kärnklyvningsreaktorer i tre separata malmfyndigheter vid Oklogruvan i Gabon , Västafrika , gemensamt kända som Oklo Fossil Reactors . Malmfyndigheten är 1,7 miljarder år gammal; då utgjorde uran-235 cirka 3 % av det totala uranet på jorden. Detta är tillräckligt högt för att tillåta en ihållande kärnklyvningskedjereaktion att inträffa, förutsatt att andra stödjande förhållanden finns. Förmågan hos det omgivande sedimentet att innehålla kärnavfallsprodukterna har citerats av den amerikanska federala regeringen som stödjande bevis för möjligheten att lagra använt kärnbränsle vid kärnavfallsförvaret i Yucca Mountain .
Kontaminering och det kalla krigets arv
Ovanjordiska kärnvapenprov av Sovjetunionen och USA under 1950-talet och början av 1960-talet och av Frankrike till 1970- och 1980-talen spred en betydande mängd nedfall från urandotterisotoper runt om i världen. Ytterligare nedfall och föroreningar inträffade från flera kärnkraftsolyckor .
Urangruvarbetare har en högre förekomst av cancer . En överrisk för lungcancer bland Navajo urangruvarbetare, till exempel, har dokumenterats och kopplats till deras yrke. Radiation Exposure Compensation Act , en lag från 1990 i USA, krävde $100 000 i "medkänslasbetalningar" till urangruvarbetare som diagnostiserats med cancer eller andra luftvägssjukdomar.
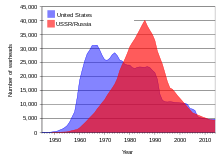
Under det kalla kriget mellan Sovjetunionen och USA samlades enorma lager av uran och tiotusentals kärnvapen skapades med anrikat uran och plutonium tillverkat av uran. Sedan Sovjetunionens upplösning 1991 har uppskattningsvis 600 korta ton (540 ton) höganrikat uran av vapenkvalitet (tillräckligt för att göra 40 000 kärnstridsspetsar) lagrats i ofta otillräckligt bevakade anläggningar i Ryska federationen och flera andra före detta sovjetstater. Poliser i Asien , Europa och Sydamerika har vid minst 16 tillfällen från 1993 till 2005 avlyssnat transporter av smugglat uran eller plutonium av bombkvalitet, varav de flesta var från före detta sovjetiska källor. Från 1993 till 2005 spenderade programmet för materialskydd, kontroll och redovisning, som drivs av USA :s federala regering , cirka 550 miljoner USD för att hjälpa till att skydda uran- och plutoniumlager i Ryssland. Dessa pengar användes till förbättringar och säkerhetsförbättringar vid forsknings- och lagringsanläggningar. Scientific American rapporterade i februari 2006 att säkerheten i några av anläggningarna bestod av kedjelänksstängsel som var i allvarligt förfallna tillstånd. Enligt en intervju från artikeln hade en anläggning lagrat prover av anrikat (vapenkvalitet) uran i en kvastskåp före förbättringsprojektet; en annan hade hållit reda på sitt lager av kärnstridsspetsar med hjälp av registerkort i en skokartong.
Förekomst
Ursprung
Tillsammans med alla beståndsdelar som har högre atomvikter än järns , bildas uran endast naturligt av r-processen (snabb neutronfångst) i supernovor och sammanslagningar av neutronstjärnor . Primordialt torium och uran produceras bara i r-processen, eftersom s-processen (långsam neutroninfångning) är för långsam och inte kan passera instabilitetsgapet efter vismut. Förutom de två befintliga uranisotoperna, 235 U och 238 U, producerade r-processen också betydande kvantiteter av 236 U , som har en kortare halveringstid och så är en utdöd radionuklid , som sedan länge har sönderfallit helt till 232 Th. Uran-236 anrikades i sig av sönderfallet av 244 Pu , vilket förklarar det observerade överflöd av torium än förväntat och lägre än förväntat överflöd av uran. Medan den naturliga mängden uran har kompletterats med sönderfallet av utdöda 242 Pu (halveringstid 0,375 miljoner år) och 247 Cm (halveringstid 16 miljoner år), vilket producerar 238 U respektive 235 U, inträffade detta till en nästan försumbar på grund av dessa föräldrars kortare halveringstider och deras lägre produktion än 236 U och 244 Pu, var föräldrarna till torium: förhållandet 247 Cm: 235 U vid bildandet av solsystemet(7,0 ± 1,6 ) × 10-5 .
Biotiska och abiotiska

Uran är ett naturligt förekommande grundämne som kan hittas i låga nivåer i allt berg, jord och vatten. Uran är det 51:a grundämnet i överflödsordning i jordskorpan. Uran är också det högst numrerade grundämnet som finns naturligt i betydande mängder på jorden och finns nästan alltid i kombination med andra grundämnen. Nedfallet av uran, thorium och kalium-40 i jordens mantel tros vara den huvudsakliga värmekällan som håller jordens yttre kärna i flytande tillstånd och driver mantelkonvektion , vilket i sin tur driver plattektoniken .
Urans genomsnittliga koncentration i jordskorpan är (beroende på referensen) 2 till 4 delar per miljon, eller cirka 40 gånger så rikligt som silver . Jordskorpan från ytan till 25 km (15 mi) ner beräknas innehålla 10 17 kg (2 × 1017 lb) uran medan haven kan innehålla 10 13 kg (2 × 1013 lb). Koncentrationen av uran i marken varierar från 0,7 till 11 delar per miljon (upp till 15 miljondelar i jordbruksmark på grund av användning av fosfatgödselmedel ) , och dess koncentration i havsvatten är 3 delar per miljard.
Uran är mer rikligt än antimon , tenn , kadmium , kvicksilver eller silver, och det är ungefär lika rikligt som arsenik eller molybden . Uran finns i hundratals mineraler, inklusive uraninite (den vanligaste uranmalmen ) , carnotite , autunite , uranophane , torbernite och coffinite . Signifikanta koncentrationer av uran förekommer i vissa ämnen som fosfatavlagringar och mineraler som brunkol och monazitsand i uranrika malmer (det återvinns kommersiellt från källor med så lite som 0,1 % uran).

Vissa bakterier, såsom Shewanella putrefaciens , Geobacter metallireducens och vissa stammar av Burkholderia fungorum , använder uran för sin tillväxt och omvandlar U(VI) till U(IV). Ny forskning tyder på att denna väg inkluderar reduktion av det lösliga U(VI) via ett mellanliggande U(V) pentavalent tillstånd.
Andra organismer, som laven Trapelia involuta eller mikroorganismer som bakterien Citrobacter , kan absorbera koncentrationer av uran som är upp till 300 gånger nivån i deras miljö. Citrobacter- arter absorberar uranyljoner när de ges glycerolfosfat (eller andra liknande organiska fosfater). Efter en dag kan ett gram bakterier täcka sig med nio gram uranylfosfatkristaller; detta skapar möjligheten att dessa organismer kan användas i biosanering för att sanera uranförorenat vatten. Proteobakterien Geobacter har också visat sig biosanera uran i grundvatten. Mykorrhizasvampen Glomus intraradices ökar uranhalten i rötterna på sin symbiotiska växt.
I naturen bildar uran(VI) mycket lösliga karbonatkomplex vid alkaliskt pH. Detta leder till en ökad rörlighet och tillgänglighet av uran till grundvatten och mark från kärnavfall vilket leder till hälsorisker. Det är dock svårt att fälla ut uran som fosfat i närvaro av överskott av karbonat vid alkaliskt pH. En Sphingomonas sp. stam BSAR-1 har visat sig uttrycka ett högaktivt alkaliskt fosfatas (PhoK) som har använts för biofällning av uran som uranylfosfat från alkaliska lösningar. Utfällningsförmågan förbättrades genom att överuttrycka PhoK-protein i E. coli .
Växter absorberar en del uran från jorden. Torrviktskoncentrationer av uran i växter varierar från 5 till 60 delar per miljard, och aska från bränt trä kan ha koncentrationer upp till 4 delar per miljon. Torrviktskoncentrationer av uran i matväxter är vanligtvis lägre med ett till två mikrogram per dag som intas genom maten människor äter.
Produktion och gruvdrift
Den globala produktionen av U 3 O 8 (Yellowcake) 2013 uppgick till 70 015 ton , varav 22 451 ton (32%) bröts i Kazakstan . Andra viktiga länder för uranbrytning är Kanada (9 331 ton), Australien (6 350 ton), Niger (4 518 ton), Namibia (4 323 ton) och Ryssland (3 135 ton).
Uranmalm bryts på flera sätt: genom dagbrott , under jord , in-situ urlakning och borrhålsbrytning (se uranbrytning ). Lågvärdig uranmalm som bryts innehåller vanligtvis 0,01 till 0,25 % uranoxider. Omfattande åtgärder måste vidtas för att utvinna metallen från dess malm. Högkvalitativa malmer som finns i Athabasca Basin - avlagringar i Saskatchewan , Kanada kan innehålla upp till 23 % uranoxider i genomsnitt. Uranmalm krossas och omvandlas till ett fint pulver och lakas sedan med antingen en syra eller alkali . Lakvattnet utsätts för en av flera sekvenser av utfällning, lösningsmedelsextraktion och jonbyte. Den resulterande blandningen, kallad yellowcake , innehåller minst 75 % uranoxider U 3 O 8 . Yellowcake kalcineras sedan för att avlägsna orenheter från malningsprocessen innan raffinering och omvandling.
Kommersiellt uran kan framställas genom reduktion av uranhalogenider med alkali- eller jordalkalimetaller . Uranmetall kan också framställas genom elektrolys av KUF
5eller
UF
4löst i smält kalciumklorid ( CaCl
2(NaCl ) och natriumkloridlösning ( NaCl ). Mycket rent uran produceras genom termisk nedbrytning av uranhalogenider på en het glödtråd.
Yellowcake är en koncentrerad blandning av uranoxider som raffineras ytterligare för att extrahera rent uran.
Resurser och reserver
Det uppskattas att 5,5 miljoner ton uran finns i malmreserver som är ekonomiskt lönsamma till 59 USD per lb uran, medan 35 miljoner ton klassas som mineraltillgångar (rimliga utsikter för eventuell ekonomisk utvinning). Priserna gick från cirka 10 USD/lb i maj 2003 till 138 USD/lb i juli 2007. Detta har orsakat en stor ökning av utgifterna för prospektering, med 200 miljoner USD som spenderades över hela världen 2005, en ökning med 54 % jämfört med föregående år. Denna trend fortsatte under 2006, då utgifterna för prospektering ökade till över 774 miljoner dollar, en ökning med över 250 % jämfört med 2004. OECD :s kärnenergiorgan sa att prospekteringssiffrorna för 2007 sannolikt skulle matcha siffrorna för 2006.
Australien har 31 % av världens kända uranmalmreserver och världens största enskilda uranfyndighet, belägen vid Olympic Dam Mine i södra Australien . Det finns en betydande reserv av uran i Bakouma , en sub-prefektur i prefekturen Mbomou i Centralafrikanska republiken .
En del kärnbränsle kommer från kärnvapen som demonteras, till exempel från Megatons till Megawatts-programmet .
Ytterligare 4,6 miljarder ton uran uppskattas finnas i havsvatten ( japanska forskare på 1980-talet visade att utvinning av uran från havsvatten med jonbytare var tekniskt genomförbart). Det har gjorts experiment för att utvinna uran ur havsvatten, men utbytet har varit lågt på grund av karbonatet som finns i vattnet. År 2012 tillkännagav ORNL- forskare den framgångsrika utvecklingen av ett nytt absorberande material kallat HiCap som utför ytretention av fasta eller gasmolekyler, atomer eller joner och även effektivt tar bort giftiga metaller från vatten, enligt resultat som verifierats av forskare vid Pacific Northwest National Laboratory.
Tillbehör

År 2005 producerade sjutton länder koncentrerade uranoxider: Kanada (27,9 % av världsproduktionen), Australien (22,8 %), Kazakstan (10,5 %), Ryssland (8,0 %), Namibia (7,5 %), Niger (7,4 %), Uzbekistan (5,5 %), USA (2,5 %), Argentina (2,1 %), Ukraina (1,9 %) och Kina (1,7 %). 2008 förväntades Kazakstan öka produktionen och kan ha blivit världens största producent av uran 2009 med en förväntad produktion på 12 826 ton, jämfört med Kanada med 11 100 ton och Australien med 9 430 ton. Förutsägelserna har gått i uppfyllelse. Under 2019 producerar Kazakstan den största andelen uran från gruvor 42 % av världens utbud, följt av Kanada (13 %) och Australien (12 %), Namibia (10 %), Uzbekistan (6 %), Niger (5 %), Ryssland (5%), Kina (3%), Ukraina (1,5%), USA (0,12%), Indien (0,6%), Iran (0,13%), med en total världsproduktion på 54752 ton från gruvor. Det bör dock nämnas att uran 2019 bröts inte bara genom konventionell underjordisk brytning av malmer 43% av produktionen (54752 ton), där sten som mineraliserats avlägsnas från marken, bryts upp och behandlas för att avlägsna de mineraler som eftersöks men också genom in-situ lakningsmetoder (ISL) 57 % av världsproduktionen (64 566 ton).
I slutet av 1960-talet upptäckte FN-geologer också stora uranfyndigheter och andra sällsynta mineralreserver i Somalia . Fyndet var det största i sitt slag, med branschexperter som uppskattade fyndigheterna till över 25 % av världens då kända uranreserver på 800 000 ton.
Det slutgiltiga tillgängliga utbudet tros vara tillräckligt för åtminstone de kommande 85 åren, även om vissa studier tyder på att underinvesteringar i slutet av 1900-talet kan ge problem med utbudet under 2000-talet. Uranfyndigheter verkar vara log-normalfördelade. Det finns en 300-faldig ökning av mängden uran som kan utvinnas för varje tiofaldig minskning av malmhalten. Det finns med andra ord lite höghaltig malm och proportionellt mycket mer låghaltig malm tillgänglig.
Föreningar
Oxidationstillstånd och oxider
Oxider
Kalcinerad urangulkaka, som produceras i många stora bruk, innehåller en fördelning av uranoxidationsarter i olika former, från mest oxiderat till minst oxiderat. Partiklar med korta uppehållstider i en kalcinerare kommer i allmänhet att vara mindre oxiderade än de med långa retentionstider eller partiklar som återvinns i skorstenen. Uraninnehåll refereras vanligtvis till U
3O
8, som dateras till Manhattan-projektets dagar då U
3O
8användes som en analytisk kemirapporteringsstandard.
Fasförhållandena i uran-syresystemet är komplexa. De viktigaste oxidationstillstånden för uran är uran(IV) och uran(VI), och deras två motsvarande oxider är urandioxid ( UO)
2) och urantrioxid ( UO
3). Andra uranoxider som uranmonoxid (UO), diuranpentoxid ( U
2O
5), och uranperoxid ( UO
4·2H
2O ) finns också.
De vanligaste formerna av uranoxid är triuranoktoxid ( U
3O
8) och UO
2. Båda oxidformerna är fasta ämnen som har låg löslighet i vatten och är relativt stabila över ett brett spektrum av miljöförhållanden. Triuranoktoxid är (beroende på förhållandena) den mest stabila föreningen av uran och är den form som oftast finns i naturen. Urandioxid är den form i vilken uran oftast används som kärnreaktorbränsle. Vid omgivningstemperatur, UO
2kommer gradvis att konvertera till U
3O
8. På grund av sin stabilitet anses uranoxider i allmänhet vara den föredragna kemiska formen för lagring eller bortskaffande.
Vattenhaltig kemi
Salter av många oxidationstillstånd av uran är vattenlösliga och kan studeras i vattenlösningar . De vanligaste jonformerna är U3+
(brunröd), U4+
(grön), UO+
2(instabil) och UO2+
2(gul), för U(III), U(IV), U(V) respektive U(VI). Ett fåtal fasta och halvmetalliska föreningar som UO och US existerar för det formella oxidationstillståndet uran(II), men inga enkla joner är kända för att existera i lösning för det tillståndet. Joner av U3+
frigör väte från vatten och anses därför vara mycket instabila. UO _2+
2jon representerar uran(VI)-tillståndet och är känt för att bilda föreningar som uranylkarbonat , uranylklorid och uranylsulfat . UO2+
2bildar också komplex med olika organiska kelatbildare , varav det vanligaste är uranylacetat .
Till skillnad från uranylsalterna av uran och katjoniska former av uranoxid med polyatomiska joner, är uranaterna , salter som innehåller en polyatomisk uranoxidanjon, i allmänhet inte vattenlösliga.
Karbonater
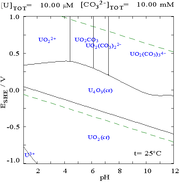
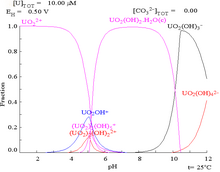
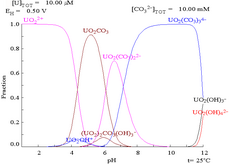
Interaktionerna mellan karbonatanjoner och uran(VI) gör att Pourbaix-diagrammet förändras kraftigt när mediet ändras från vatten till en karbonathaltig lösning. Medan de allra flesta karbonater är olösliga i vatten (studenter får ofta lära sig att alla andra karbonater än de av alkalimetaller är olösliga i vatten), är urankarbonater ofta lösliga i vatten. Detta beror på att en U(VI)-katjon kan binda två terminala oxider och tre eller flera karbonater för att bilda anjoniska komplex.
| Uran i ett icke-komplexbildande vattenhaltigt medium (t.ex. perklorsyra /natriumhydroxid). | Uran i karbonatlösning |
| Relativa koncentrationer av de olika kemiska formerna av uran i ett icke-komplexbildande vattenhaltigt medium (t.ex. perklorsyra /natriumhydroxid). | Relativa koncentrationer av de olika kemiska formerna av uran i en vattenhaltig karbonatlösning. |
Effekter av pH
Uranfraktionsdiagrammen i närvaro av karbonat illustrerar detta ytterligare: när pH i en uran(VI)-lösning ökar, omvandlas uranet till en hydratiserad uranoxidhydroxid och vid höga pH-värden blir det ett anjoniskt hydroxidkomplex.
När karbonat tillsätts omvandlas uran till en serie karbonatkomplex om pH höjs. En effekt av dessa reaktioner är ökad löslighet av uran i pH-intervallet 6 till 8, ett faktum som har direkt betydelse för den långsiktiga stabiliteten hos använt urandioxidkärnbränsle.
Hydrider, karbider och nitrider
Uranmetall uppvärmd till 250 till 300 °C (482 till 572 °F) reagerar med väte för att bilda uranhydrid . Ännu högre temperaturer kommer reversibelt att ta bort vätet. Denna egenskap gör uranhydrider lämpliga utgångsmaterial för att skapa reaktivt uranpulver tillsammans med olika urankarbid- , nitrid- och halogenidföreningar . Det finns två kristallmodifieringar av uranhydrid: en α-form som erhålls vid låga temperaturer och en β-form som skapas när formationstemperaturen är över 250 °C.
Urankarbider och urannitrider är båda relativt inerta semimetalliska föreningar som är minimalt lösliga i syror , reagerar med vatten och kan antändas i luft och bilda U
3O
8. Karbider av uran inkluderar uranmonokarbid (UC ), urandikarbid ( UC )
2), och diurantrikarbid ( U
2C
3). Både UC och UC
2bildas genom att tillsätta kol till smält uran eller genom att utsätta metallen för kolmonoxid vid höga temperaturer. Stabil under 1800 °C, U
2C
3framställs genom att utsätta en upphettad blandning av UC och UC
2till mekanisk påfrestning. Urannitrider som erhålls genom direkt exponering av metallen för kväve inkluderar uranmononitrid (UN), uraniumdinitrid ( UN )
2), och diurantrinitrid ( U
2N
3).
Halider

Alla uranfluorider skapas med urantetrafluorid ( UF
4); UF
4själv framställs genom hydrofluorering av urandioxid. Minskning av UF
4med väte vid 1000 °C producerar urantrifluorid ( UF
3). Under de rätta förhållandena för temperatur och tryck, reaktionen av fast UF
4med gasformig uranhexafluorid ( UF
6) kan bilda mellanliggande fluorider av U
2F
9, U
4F
17och UF
5.
Vid rumstemperatur, UF
6har ett högt ångtryck , vilket gör det användbart i gasdiffusionsprocessen för att separera det sällsynta uran-235 från den vanliga uran-238 isotopen. Denna förening kan framställas från urandioxid och uranhydrid genom följande process:
-
UO
2+ 4 HF → UF
4+ 2 H
2O (500 °C, endotermisk) -
UF
4+ F
2→ UF
6(350 °C, endotermisk)
Den resulterande UF
6, ett vitt fast ämne, är mycket reaktivt (genom fluorering), sublimeras lätt (avger en ånga som beter sig som en nästan idealisk gas ), och är den mest flyktiga uranföreningen som finns.
En metod för att framställa urantetraklorid ( UCl
4) är att direkt kombinera klor med antingen uranmetall eller uranhydrid. Minskningen av UCl
4av väte producerar urantriklorid ( UCl
3) medan de högre kloriderna av uran framställs genom reaktion med ytterligare klor. Alla uranklorider reagerar med vatten och luft.
Bromider och jodider av uran bildas genom direkt reaktion av brom respektive jod med uran eller genom tillsats av UH
3till dessa grundämnens syror. Kända exempel inkluderar: UBr
3, UBr
4, UI
3och UI
4. UI
5har aldrig förberetts. Uranoxihalider är vattenlösliga och inkluderar UO
2F
2, UOCl
2, UO
2Cl
2och UO
2Br
2. Stabiliteten för oxihalogeniderna minskar när atomvikten för komponenthalogeniden ökar.
Isotoper
Naturliga koncentrationer
Naturligt uran består av tre huvudisotoper: uran-238 (99,28 % naturligt överflöd), uran-235 (0,71 %) och uran-234 (0,0054 %). Alla tre är radioaktiva och sänder ut alfapartiklar , med undantaget att alla dessa tre isotoper har små sannolikheter att genomgå spontan fission . Det finns också fyra andra spårisotoper: uran-239, som bildas när 238 U genomgår spontan klyvning och frigör neutroner som fångas upp av ytterligare en 238 U-atom; uran-237, som bildas när 238 U fångar en neutron men avger två till, som sedan sönderfaller till neptunium-237 ; uran-236 , som förekommer i spårmängder på grund av neutroninfångning på 235 U och som en sönderfallsprodukt av plutonium-244 ; och slutligen uran-233, som bildas i sönderfallskedjan av neptunium-237. Det förväntas också att torium-232 ska kunna genomgå dubbelt beta-sönderfall , vilket skulle producera uran-232, men detta har ännu inte observerats experimentellt. Den enda betydande avvikelsen från förhållandet U-235 till U-238 i några kända naturliga prover inträffar i Oklo , Gabon , där naturliga kärnklyvningsreaktorer förbrukade en del av U-235 för cirka två miljarder år sedan när förhållandet mellan U-235 och U -238 var mer besläktad med låganrikat uran som tillåter vanligt ("lätt") vatten att fungera som en neutronmoderator besläktad med processen i mänskligt tillverkade lättvattenreaktorer . Förekomsten av sådana naturliga klyvningsreaktorer som hade förutspåtts teoretiskt på förhand bevisades då en liten avvikelse av U-235-koncentrationen från de förväntade värdena upptäcktes under urananrikning i Frankrike. Efterföljande undersökningar för att utesluta all otrevlig mänsklig handling (som att stjäla U-235) bekräftade teorin genom att hitta isotopförhållanden för vanliga fissionsprodukter (eller snarare deras stabila dotternuklider) i linje med de värden som förväntas för fission men som avviker från värdena förväntas för icke-klyvningshärledda prover av dessa grundämnen.
Uran-238 är den mest stabila isotopen av uran, med en halveringstid på cirka 4,468 × 109 år, ungefär jordens ålder . Uran-235 har en halveringstid på cirka 7,13 × 108 år, och uran-234 har en halveringstid på cirka 2,48 × 105 år. Cirka 49 % av alfapartiklarna i naturligt uran släpps ut av 238 U, 49 % emitteras av 234 U (eftersom den senare är bildad av den förra), och cirka 2 % av 235 U. När jorden var ung, troligen ungefär en -femtedel av dess uran var uran-235, men andelen 234 U var förmodligen mycket lägre än så här.
Uranium-238 är vanligtvis en alfasändare (ibland genomgår den spontan klyvning), som sönderfaller genom uranserien , som har 18 medlemmar, till bly-206 , genom en mängd olika sönderfallsvägar.
Nedbrytningskedjan av 235 U, som kallas aktiniumserien , har 15 medlemmar och sönderfaller så småningom till bly-207. De konstanta sönderfallshastigheterna i dessa sönderfallsserier gör jämförelsen av förhållandet mellan förälder och dotterelement användbar vid radiometrisk datering.
Uran-234, som ingår i uranserien (sönderfallskedjan av uran-238), sönderfaller till bly-206 genom en serie relativt kortlivade isotoper.
Uran-233 tillverkas av torium-232 genom neutronbombardement, vanligtvis i en kärnreaktor, och 233 U är också klyvbart. Dess sönderfallskedja är en del av neptunium-serien och slutar vid vismut-209 och tallium -205.
Uran-235 är viktigt för både kärnreaktorer och kärnvapen , eftersom det är den enda uranisotopen som finns i naturen på jorden i någon betydande mängd som är klyvbar. Detta innebär att den kan delas i två eller tre fragment ( klyvningsprodukter ) av termiska neutroner.
Uran-238 är inte klyvbart, utan är en fertil isotop, eftersom den efter neutronaktivering kan omvandlas till plutonium-239, en annan klyvbar isotop. Faktum är att 238 U-kärnan kan absorbera en neutron för att producera den radioaktiva isotopen uran-239 . 239 U sönderfaller genom beta-emission till neptunium -239, också en beta-emitter, som i sin tur sönderfaller inom några dagar till plutonium-239. 239 Pu användes som klyvbart material i den första atombomben som detonerade i "Trinity-testet" den 15 juli 1945 i New Mexico .
Berikning

I naturen finns uran som uran-238 (99,2742%) och uran-235 (0,7204%). Isotopseparation koncentrerar (berikar) det klyvbara uran-235 för kärnvapen och de flesta kärnkraftverk, förutom gaskylda reaktorer och trycksatta tungvattenreaktorer . De flesta neutroner som frigörs av en klyvningsatom av uran-235 måste påverka andra uran-235-atomer för att upprätthålla kärnkedjereaktionen . Koncentrationen och mängden uran-235 som behövs för att uppnå detta kallas en " kritisk massa ".
För att betraktas som "berikad" bör andelen uran-235 vara mellan 3 % och 5 %. Denna process producerar enorma mängder uran som är utarmat på uran-235 och med en motsvarande ökad andel uran-238, kallat utarmat uran eller "DU". För att betraktas som "utarmad" bör uran-235 isotopkoncentrationen inte vara mer än 0,3 %. Priset på uran har stigit sedan 2001, så anrikningsavfall som innehåller mer än 0,35 % uran-235 övervägs för återanrikning, vilket driver priset på utarmat uranhexafluorid till över 130 USD per kilogram i juli 2007 från 5 USD 2001.
Gascentrifugprocessen , där gasformig uranhexafluorid ( UF
6) separeras av skillnaden i molekylvikt mellan 235 UF 6 och 238 UF 6 med användning av höghastighetscentrifuger , är den billigaste och ledande anrikningsprocessen . Gasdiffusionsprocessen hade varit den ledande metoden för anrikning och användes i Manhattan Project . I denna process diffunderar uranhexafluorid upprepade gånger genom ett silver - zinkmembran , och de olika isotoper av uran separeras genom diffusionshastighet (eftersom uran-238 är tyngre diffunderar det något långsammare än uran-235). Den molekylära laserisotopseparationsmetoden använder en laserstråle med exakt energi för att bryta bindningen mellan uran-235 och fluor. Detta lämnar uran-238 bundet till fluor och tillåter uran-235-metall att fällas ut från lösningen. En alternativ lasermetod för anrikning är känd som atomic vapor laser isotope separation (AVLIS) och använder synliga avstämbara lasrar som färglasrar . En annan metod som används är flytande termisk diffusion.
Människoexponering
En person kan utsättas för uran (eller dess radioaktiva döttrar , såsom radon ) genom att andas in damm i luft eller genom att inta förorenat vatten och mat. Mängden uran i luften är vanligtvis mycket liten; men människor som arbetar i fabriker som bearbetar fosfatgödselmedel , bor nära statliga anläggningar som tillverkade eller testade kärnvapen, bor eller arbetar nära ett modernt slagfält där vapen med utarmat uran har använts, eller bor eller arbetar nära ett koleldat kraftverk, anläggningar som bryter eller bearbetar uranmalm, eller anrikar uran för reaktorbränsle, kan ha ökad exponering för uran. Hus eller strukturer som ligger över uranavlagringar (antingen naturliga eller konstgjorda slaggavlagringar) kan ha en ökad förekomst av exponering för radongas. Occupational Safety and Health Administration (OSHA) har satt den tillåtna exponeringsgränsen för uranexponering på arbetsplatsen till 0,25 mg/m 3 under en 8-timmars arbetsdag. National Institute for Occupational Safety and Health (NIOSH) har satt ett rekommenderat exponeringsgränsvärde (REL) på 0,2 mg/m 3 över en 8-timmars arbetsdag och en korttidsgräns på 0,6 mg/m 3 . Vid halter av 10 mg/m 3 är uran omedelbart farligt för liv och hälsa .
Mest intaget uran utsöndras under matsmältningen . Endast 0,5 % absorberas när olösliga former av uran, såsom dess oxid, intas, medan absorptionen av den mer lösliga uranyljonen kan vara upp till 5 %. Lösliga uranföreningar tenderar dock att snabbt passera genom kroppen, medan olösliga uranföreningar, särskilt när de andas in med damm i lungorna , utgör en allvarligare exponeringsrisk. Efter att ha kommit in i blodomloppet tenderar det absorberade uranet att bioackumuleras och stanna i många år i benvävnaden på grund av uranets affinitet för fosfater. Uran absorberas inte genom huden och alfapartiklar som frigörs av uran kan inte penetrera huden.
Inkorporerat uran blir uranyljoner , som ackumuleras i ben, lever, njure och reproduktionsvävnader. Uran kan saneras från stålytor och akviferer .
Effekter och försiktighetsåtgärder
Normal funktion av njurar , hjärna , lever , hjärta och andra system kan påverkas av exponering för uran, eftersom uran, förutom att vara svagt radioaktivt, är en giftig metall . Uran är också ett reproduktionstoxiskt ämne. Radiologiska effekter är i allmänhet lokala eftersom alfastrålning, den primära formen av 238 U-sönderfall, har en mycket kort räckvidd och kommer inte att penetrera huden. Alfastrålning från inhalerat uran har visat sig orsaka lungcancer hos exponerade kärnkraftsarbetare. Uranyl ( UO2+
2) joner, såsom från urantrioxid eller uranylnitrat och andra sexvärda uranföreningar, har visat sig orsaka fosterskador och skador på immunsystemet hos laboratoriedjur. Medan CDC har publicerat en studie där ingen cancer hos människa har setts som ett resultat av exponering för naturligt eller utarmat uran, är exponering för uran och dess sönderfallsprodukter, särskilt radon , allmänt kända och betydande hälsohot. Exponering för strontium-90 , jod-131 och andra klyvningsprodukter är inte relaterad till uranexponering, men kan bero på medicinska procedurer eller exponering för använt reaktorbränsle eller nedfall från kärnvapen. Även om oavsiktlig inandningsexponering för en hög koncentration av uranhexafluorid har resulterat i dödsfall hos människor, var dessa dödsfall förknippade med genereringen av mycket giftig fluorvätesyra och uranylfluorid snarare än med uran i sig. Finfördelad uranmetall utgör en brandrisk eftersom uran är pyrofor ; små korn kommer att antändas spontant i luft vid rumstemperatur.
Uranmetall hanteras vanligtvis med handskar som en tillräcklig försiktighetsåtgärd. Urankoncentrat hanteras och innesluts för att säkerställa att människor inte andas in eller förtär det.
| Kroppssystem | Människostudier | Djurstudier | In vitro |
|---|---|---|---|
| Njur | Förhöjda nivåer av proteinutsöndring, urinkatalas och diures | Skador på proximala hopvikta tubuli, nekrotiska celler gjutna från tubulärt epitel, glomerulära förändringar ( njursvikt ) | Inga studier |
| Hjärna/CNS | Minskad prestation på neurokognitiva tester | Akut kolinerg toxicitet; Dosberoende ackumulering i cortex, mellanhjärnan och vermis; Elektrofysiologiska förändringar i hippocampus | Inga studier |
| DNA | Ökade rapporter om cancer | Ökad mutagenicitet (hos möss) och induktion av tumörer | Binukleerade celler med mikrokärnor, hämning av cellcykelkinetik och proliferation; Systerkromatidinduktion, tumörframkallande fenotyp |
| Ben/muskel | Inga studier | Hämning av parodontal benbildning; och alveolär sårläkning | Inga studier |
| Reproduktiv | Urangruvarbetare har fler förstfödda döttrar | Måttlig till svår fokal tubulär atrofi; vakuolisering av Leydig-celler | Inga studier |
| Lungor/andningsvägar | Inga negativa hälsoeffekter rapporterade | Allvarlig nästäppa och blödning, lungskador och fibros, ödem och svullnad, lungcancer | Inga studier |
| Gastrointestinala | Kräkningar, diarré, albuminuri | Inga studier | Inga studier |
| Lever | Inga effekter ses vid exponeringsdos | Fettlever, fokal nekros | Inga studier |
| Hud | Inga exponeringsbedömningsdata tillgängliga | Svullna vakuolerade epidermala celler, skador på hårsäckar och talgkörtlar | Inga studier |
| Vävnader som omger inbäddade DU-fragment | Förhöjda urinkoncentrationer av uran | Förhöjda urinkoncentrationer av uran, störningar i biokemiska och neuropsykologiska tester | Inga studier |
| Immunförsvar | Kronisk trötthet, utslag, öron- och ögoninfektioner, hår och viktminskning, hosta. Kan bero på kombinerad kemikalieexponering snarare än DU enbart | Inga studier | Inga studier |
| Ögon | Inga studier | Konjunktivit, irritation inflammation, ödem, sårbildning i konjunktivalsäckar | Inga studier |
| Blod | Inga studier | Minskad antal RBC och hemoglobinkoncentration | Inga studier |
| Kardiovaskulär | Myokardit till följd av intag av uran, som upphörde sex månader efter intag | Inga effekter | Inga studier |
Se även
Anteckningar
Referenser
- Emsley, John (2001). "Uran" . Naturens byggstenar: En guide från A till Ö till elementen . Oxford : Oxford University Press . s. 476–482 . ISBN 978-0-19-850340-8.
- Seaborg, Glenn T. (1968). "Uran". The Encyclopedia of the Chemical Elements . Skokie, Illinois : Reinhold Book Corporation. s. 773–786. LCCN 68029938 .
externa länkar
- US EPA: Strålningsinformation för uran
- "Vad är uran?" från World Nuclear Association
- Kärnbränsledata och analys från US Energy Information Administration
- Aktuellt marknadspris på uran
- Världskartor för uranfyndigheter
- Kommenterad bibliografi för uran från Alsos Digital Library
- NLM databank för farliga ämnen – uran, radioaktivt
- CDC – NIOSH Pocket Guide to Chemical Hazards
- Bryt uran vid Langer Heinrich-gruvan i Namibia
- World Nuclear News
- ATSDR Fallstudier i miljömedicin: Urantoxicitet US Department of Health and Human Services
- Uran vid The Periodic Table of Videos (University of Nottingham)