Platina - Platinum
 | |||||||||||||||||||||||||||||||||||||||||
| Platina | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Uttal |
/ P l æ t ɪ n əm / ( PLAT -i-əm ) |
||||||||||||||||||||||||||||||||||||||||
| Utseende | silvervit | ||||||||||||||||||||||||||||||||||||||||
| Standard atomvikt A r, std (Pt) | 195.084 (9) | ||||||||||||||||||||||||||||||||||||||||
| Platina i det periodiska systemet | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Atomnummer ( Z ) | 78 | ||||||||||||||||||||||||||||||||||||||||
| Grupp | grupp 10 | ||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||
| Blockera | d-block | ||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [ Xe ] 4f 14 5d 9 6s 1 | ||||||||||||||||||||||||||||||||||||||||
| Elektroner per skal | 2, 8, 18, 32, 17, 1 | ||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | |||||||||||||||||||||||||||||||||||||||||
| Fas vid STP | fast | ||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 2041,4 K (1768,3 ° C, 3214,9 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 4098 K (3825 ° C, 6917 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Densitet (nära rt ) | 21,45 g / cm 3 | ||||||||||||||||||||||||||||||||||||||||
| när den är flytande (vid mp ) | 19,77 g / cm 3 | ||||||||||||||||||||||||||||||||||||||||
| Smältvärme | 22,17 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Förångningsvärme | 510 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Molär värmekapacitet | 25,86 J/(mol · K) | ||||||||||||||||||||||||||||||||||||||||
Ångtryck
| |||||||||||||||||||||||||||||||||||||||||
| Atomegenskaper | |||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | −3, −2, −1, 0, +1, +2 , +3, +4 , +5, +6 (en lätt basisk oxid) | ||||||||||||||||||||||||||||||||||||||||
| Elektronnegativitet | Pauling -skala: 2,28 | ||||||||||||||||||||||||||||||||||||||||
| Joniseringsenergier | |||||||||||||||||||||||||||||||||||||||||
| Atom radie | empiriska: 139 pm | ||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 136 ± 17.00 | ||||||||||||||||||||||||||||||||||||||||
| Van der Waals radie | 175.00 | ||||||||||||||||||||||||||||||||||||||||
| Spektrala linjer av platina | |||||||||||||||||||||||||||||||||||||||||
| Övriga fastigheter | |||||||||||||||||||||||||||||||||||||||||
| Naturlig förekomst | ursprunglig | ||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | ytcentrerad kubisk (fcc) | ||||||||||||||||||||||||||||||||||||||||
| Ljudhastighet tunn stång | 2800 m/s (vid rt ) | ||||||||||||||||||||||||||||||||||||||||
| Termisk expansion | 8,8 µm/(m⋅K) (vid 25 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 71,6 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||
| Elektrisk resistans | 105 nΩ⋅m (vid 20 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Magnetisk beställning | paramagnetisk | ||||||||||||||||||||||||||||||||||||||||
| Molär magnetisk känslighet | +201,9 × 10 −6 cm 3 /mol (290 K) | ||||||||||||||||||||||||||||||||||||||||
| Brottgräns | 125–240 MPa | ||||||||||||||||||||||||||||||||||||||||
| Youngs modul | 168 GPa | ||||||||||||||||||||||||||||||||||||||||
| Skjuvmodul | 61 GPa | ||||||||||||||||||||||||||||||||||||||||
| Bulkmodul | 230 GPa | ||||||||||||||||||||||||||||||||||||||||
| Poisson -förhållande | 0,38 | ||||||||||||||||||||||||||||||||||||||||
| Mohs hårdhet | 3.5 | ||||||||||||||||||||||||||||||||||||||||
| Vickers hårdhet | 400–550 MPa | ||||||||||||||||||||||||||||||||||||||||
| Brinell hårdhet | 300–500 MPa | ||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7440-06-4 | ||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||
| Upptäckt | Antonio de Ulloa (1735) | ||||||||||||||||||||||||||||||||||||||||
| Huvudsakliga isotoper av platina | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Platina är ett kemiskt element med symbolen Pt och atomnummer 78. Det är en tät , formbar, seg , mycket oreaktiv, dyrbar , silvervit vit övergångsmetall . Dess namn härrör från den spanska termen platino , som betyder "lite silver".
Platina är medlem i platinagruppen av element och grupp 10 i det periodiska systemet . Den har sex naturligt förekommande isotoper . Det är ett av de sällsynta elementen i jordskorpan , med ett genomsnittligt överflöd på cirka 5 μg /kg. Det förekommer i vissa nickel- och kopparmalmer tillsammans med några inhemska fyndigheter, mestadels i Sydafrika , som står för 80% av världsproduktionen. På grund av sin knapphet i jordskorpan produceras bara några hundra ton årligen, och med tanke på dess viktiga användningsområden är den mycket värdefull och är en viktig ädelmetallvara .
Platina är en av de minst reaktiva metaller . Den har anmärkningsvärd motståndskraft mot korrosion , även vid höga temperaturer, och anses därför vara en ädelmetall . Följaktligen finns platina ofta kemiskt okombinerad som nativ platina. Eftersom det förekommer naturligt i alluviala sanden i olika floder, användes det först av förkolumbianska sydamerikanska infödingar för att producera artefakter. Det hänvisades till det i europeiska skrifter redan på 1500 -talet, men det var inte förrän Antonio de Ulloa publicerade en rapport om en ny metall av colombianskt ursprung 1748 som den började undersökas av forskare.
Platina används i katalysatorer , laboratorieutrustning, elektriska kontakter och elektroder , platinamotståndstermometrar , tandläkarutrustning och smycken. Eftersom det är en tungmetall leder det till hälsoproblem vid exponering för dess salter ; men på grund av dess korrosionsbeständighet har metallisk platina inte kopplats till negativa hälsoeffekter. Föreningar som innehåller platina, såsom cisplatin , oxaliplatin och karboplatin , appliceras i kemoterapi mot vissa typer av cancer.
I början av 2021 varierade platinavärdet från 1 055 US $ per troy ounce till 1 320 US $ per troy ounce.
Egenskaper
Fysisk
Ren platina är en glansig, seg och smidig , silvervit metall. Platina är mer segt än guld , silver eller koppar , vilket är den mest segma av rena metaller, men det är mindre formbart än guld. Metallen har utmärkt korrosionsbeständighet , är stabil vid höga temperaturer och har stabila elektriska egenskaper. Platina oxiderar och bildar PtO
2, vid 500 ° C; denna oxid kan enkelt avlägsnas termiskt. Den reagerar kraftigt med fluor vid 500 ° C (932 ° F) för att bilda platintetrafluorid . Det attackeras också av klor , brom , jod och svavel . Platina är olösligt i saltsyra och salpetersyra , men löser sig i heta vattenregier (en blandning av salpetersyra och saltsyra) för att bilda kloroplatinsyra , H
2PtCl
6.
Dess fysiska egenskaper och kemiska stabilitet gör den användbar för industriella applikationer. Dess motståndskraft mot slitage och fläckar är väl lämpad att använda i fina smycken .
Kemisk

De vanligaste oxidationstillstånden för platina är +2 och +4. +1 och +3 oxidationstillstånden är mindre vanliga och stabiliseras ofta genom metallbindning i bimetalliska (eller polymetalliska) arter. Som förväntat tenderar tetrakoordinat platina (II) föreningar att anta 16-elektron kvadratiska plana geometrier. Även om elementär platina generellt är oreaktiv, löses den upp i heta vattenregier för att ge vattenhaltig kloroplatinsyra (H
2PtCl
6):
- Pt + 4 HNO
3 + 6 HCl → H
2PtCl
6 + 4 NEJ
2 + 4 H
2O
Som en mjuk syra har platina en stor affinitet för svavel, såsom dimetylsulfoxid (DMSO); många DMSO -komplex har rapporterats och försiktighet bör iakttas vid valet av reaktionslösningsmedel.
I 2007, den tyska vetenskapsmannen Gerhard Ertl vann Nobelpriset i kemi för bestämning av de detaljerade molekylära mekanismerna för katalytisk oxidation av kolmonoxid över platina ( katalysator ).
Isotoper
Platina har sex naturligt förekommande isotoper : 190 Pt, 192 Pt, 194 Pt, 195 Pt, 196 Pt och 198 Pt. Den mest överflödande av dessa är 195 Pt, bestående 33,83% av all platina. Det är den enda stabila isotopen med ett snurr som inte är noll. Spinn av 1 / 2 och andra gynnsamma magnetiska egenskaperna hos de kärnan utnyttjas i 195 Pt-NMR . På grund av dess snurrning och stora överflöd observeras också 195 Pt satellittoppar ofta i 1 H och 31 P NMR-spektroskopi ( t.ex. för Pt-fosfin- och Pt-alkylkomplex). 190 Pt är det minst rikliga med endast 0,01%. Av de naturligt förekommande isotoperna är endast 190 Pt instabil, även om den förfaller med en halveringstid på 6,5 × 10 11 år, vilket orsakar en aktivitet på 15 Bq /kg naturlig platina. 198 Pt kan genomgå alfa-förfall , men dess förfall har aldrig observerats ( halveringstiden är känd för att vara längre än 3,2 × 10 14 år); därför anses det vara stabilt. Platina har också 34 syntetiska isotoper som sträcker sig i atommassa från 165 till 204, vilket gör det totala antalet kända isotoper till 40. De minst stabila av dessa är 165 Pt och 166 Pt, med halveringstider på 260 µs, medan den mest stabila är 193 Pt med en halveringstid på 50 år. De flesta platinaisotoper sönderfaller genom någon kombination av beta -sönderfall och alfa -sönderfall. 188 Pt, 191 Pt och 193 Pt förfaller främst genom elektronfångst . 190 Pt och 198 Pt förutspås ha energiskt gynnsamma dubbla beta -sönderfallssätt .
Förekomst
Platina är en extremt sällsynt metall som förekommer i en koncentration av endast 0,005 ppm i jordskorpan . Det misstas ibland med silver. Platina återfinns ofta kemiskt okombinerat som nativ platina och som legering med de andra platinagruppmetallerna och järn mestadels. Oftast finns den inhemska platinan i sekundära avlagringar i alluviala avlagringar. De alluviala avlagringar som används av förkolumbianska människor i Chocó-avdelningen , Colombia, är fortfarande en källa för metaller i platinagrupper. En annan stor alluvial fyndighet är i Uralbergen , Ryssland, och den bryts fortfarande.
I nickel- och kopparavlagringar förekommer platinagruppmetaller som sulfider (t.ex. (Pt, Pd) S) , tellurider (t.ex. PtBiTe ), antimonider (PdSb) och arsenider (t.ex. PtA)
2), och som slutlegeringar med nickel eller koppar. Platina arsenid, sperrylite ( PtAs
2), är en viktig källa till platina associerad med nickelmalm i Sudbury Basin -fyndigheten i Ontario , Kanada . Vid Platinum, Alaska , var cirka 17 tusen kg (550 tusen ozt) bryts mellan 1927 och 1975. Den gruvan upphörde funktioner 1990. Den sällsynta sulfidmineral cooperite , (Pt, Pd, Ni) S , innehåller platina tillsammans med palladium och nickel. Cooperit förekommer i Merensky Reef i Bushveld -komplexet , Gauteng , Sydafrika .
År 1865, kromiter identifierades i Bushveld regionen i södra Afrika, följt av upptäckten av platina 1906. År 1924 geologen Hans Merensky upptäckt ett stort utbud av platina i Bushveld Igneous Complex i Sydafrika. Det specifika lager han hittade, namnet Merensky Reef , innehåller cirka 75% av världens kända platina. De stora koppar -nickelfyndigheterna nära Norilsk i Ryssland och Sudbury Basin , Kanada , är de två andra stora fyndigheterna. I Sudbury -bassängen utgör de stora mängderna nickelmalm som bearbetas platina närvarande som endast 0,5 ppm i malmen. Mindre reserver finns i USA, till exempel i Absaroka -området i Montana . År 2010 var Sydafrika den högsta tillverkaren av platina, med en andel på nästan 77%, följt av Ryssland med 13%; världsproduktionen 2010 var 192 000 kg (423 000 lb).
Stora platinaavlagringar finns i delstaten Tamil Nadu , Indien .
Platina finns i högre överflöd på månen och i meteoriter. På motsvarande sätt finns platina i något högre överflöd på platser med bolidpåverkan på jorden som är förknippade med resulterande vulkanism efter påverkan och kan brytas ekonomiskt; den Sudbury Basin är ett sådant exempel.
Föreningar
Halider
Hexakloroplatinsyra som nämns ovan är förmodligen den viktigaste platinaföreningen, eftersom den fungerar som föregångare till många andra platinaföreningar. I sig har den olika tillämpningar inom fotografering, zinketsningar, outplånligt bläck , plätering, speglar, porslinsfärgning och som katalysator.
Behandling av hexakloroplatinsyra med ett ammoniumsalt, såsom ammoniumklorid , ger ammoniumhexakloroplatinat , som är relativt olösligt i ammoniumlösningar. Uppvärmning av detta ammoniumsalt i närvaro av väte reducerar det till elementär platina. Kaliumhexakloroplatinat är på samma sätt olösligt och hexakloroplatinsyra har använts vid bestämning av kaliumjoner genom gravimetri .
När hexakloroplatinsyra upphettas sönderdelas den genom platina (IV) klorid och platina (II) klorid till elementär platina, även om reaktionerna inte sker stegvis:
- (H
3O)
2PtCl
6· N H
2O ⇌ PtCl
4+ 2 HCl + ( n + 2) H
2O - PtCl
4 ⇌ PtCl
2 + Cl
2 - PtCl
2 ⇌ Pt + Cl
2
Alla tre reaktionerna är reversibla. Platinum (II) och platina (IV) bromider är också kända. Platinahexafluorid är en stark oxidationsmedel som kan oxidera syre .
Oxider
Platina (IV) oxid , PtO
2, även känd som ' Adams' katalysator ', är ett svart pulver som är lösligt i kaliumhydroxid (KOH) lösningar och koncentrerade syror. PtO
2och den mindre vanliga PtO sönderdelas båda vid uppvärmning. Platina (II, IV) oxid, Pt
3O
4, bildas i följande reaktion:
- 2 Pt 2+ + Pt 4+ + 4 O 2− → Pt
3O
4
Andra föreningar
Till skillnad från palladiumacetat är platina (II) acetat inte kommersiellt tillgängligt. När en bas önskas har haliderna använts i kombination med natriumacetat . Användningen av platina (II) acetylacetonat har också rapporterats.
Flera bariumplatinider har syntetiserats där platina uppvisar negativa oxidationstillstånd som sträcker sig från -1 till -2. Dessa inkluderar BaPt, Ba
3Pt
2och Ba
2Pt . Cesiumplatinid, Cs
2Pt , en mörkröd transparent kristallin förening har visat sig innehålla Pt2−
anjoner. Platina uppvisar också negativa oxidationstillstånd vid ytor reducerade elektrokemiskt. De negativa oxidationstillstånden som platina uppvisar är ovanliga för metalliska element, och de tillskrivs den relativistiska stabiliseringen av 6 -talets orbitaler.
Det förutses att även katjonen PtO 4 2+ i vilken platina finns i +10 oxidationstillstånd kan vara uppnåelig.
Zeises salt , innehållande en eten -ligand, var en av de första metallorganiska föreningar som upptäckts. Dichloro (cycloocta-1,5-dien) platina (II) är ett kommersiellt tillgängligt olefinkomplex , som innehåller lätt förskjutbara torskligander ("torsk" är en förkortning av 1,5-cyclooctadiene). Torskkomplexet och halogeniderna är lämpliga utgångspunkter för platinakemi.
Cisplatin , eller cis -diamminedichloroplatinum (II) är det första i en serie av kvadratiska platina (II) -innehållande kemoterapiläkemedel. Andra inkluderar karboplatin och oxaliplatin . Dessa föreningar kan tvärbinda DNA och döda celler genom liknande vägar till alkylering av kemoterapeutiska medel . (Biverkningar av cisplatin inkluderar illamående och kräkningar, håravfall, tinnitus, hörselnedsättning och nefrotoxicitet.)
Organoplatinumföreningar , såsom ovanstående antitumörmedel, liksom lösliga oorganiska platinakomplex, karakteriseras rutinmässigt med användning av 195 Pt kärnmagnetisk resonansspektroskopi .
Historia
Tidig användning
Arkeologer har upptäckt spår av platina i guldet som användes vid gamla egyptiska begravningar redan 1200 f.Kr. Till exempel befanns en liten låda från begravningen av Shepenupet II vara dekorerad med guld-platina hieroglyfer. Emellertid är omfattningen av de tidiga egyptiernas kunskap om metallen oklar. Det är fullt möjligt att de inte insåg att det fanns platina i deras guld.
Metallen användes av förkolumbianska amerikaner nära dagens Esmeraldas, Ecuador för att producera artefakter av en vitguldplatinumlegering. Arkeologer brukar förknippa traditionen med platinabearbetning i Sydamerika med La Tolita-kulturen (cirka 600 f.Kr.-200 e.Kr.), men exakta datum och plats är svårt, eftersom de flesta platinaartefakter från området köptes begagnade genom antikhandel snarare än erhålls genom direkt arkeologisk utgrävning. För att bearbeta metallen skulle de kombinera guld- och platinapulver genom sintring . Den resulterande guld -platinumlegeringen skulle då vara tillräckligt mjuk för att forma med verktyg. Platinum som användes i sådana föremål var inte det rena elementet, utan snarare en naturligt förekommande blandning av platinagruppsmetallerna , med små mängder palladium, rodium och iridium.
Europeisk upptäckt
Den första europeiska hänvisningen till platina förekommer 1557 i den italienska humanisten Julius Caesar Scaligers skrifter som en beskrivning av en okänd ädelmetall som hittades mellan Darién och Mexiko, "som ingen eld eller något spanskt konstverk ännu har kunnat göra flytande". Från sina första möten med platina såg spanjorerna i allmänhet metallen som en slags orenhet i guld, och den behandlades som sådan. Det kastades ofta helt enkelt och det fanns ett officiellt dekret som förbjöd förfalskning av guld med föroreningar från platina.

År 1735 såg Antonio de Ulloa och Jorge Juan y Santacilia indianer bryta platina medan spanjorerna reste genom Colombia och Peru i åtta år. Ulloa och Juan hittade gruvor med de vita metallkornen och tog dem hem till Spanien. Antonio de Ulloa återvände till Spanien och etablerade det första mineralogilaboratoriet i Spanien och var den första som systematiskt studerade platina, vilket var 1748. Hans historiska redogörelse för expeditionen innehöll en beskrivning av platina som varken separerbar eller kalcinerbar . Ulloa förväntade sig också upptäckten av platinagruvor. Efter att ha publicerat rapporten 1748 fortsatte Ulloa inte att undersöka den nya metallen. År 1758 skickades han till chef för kvicksilverbrytning i Huancavelica .
År 1741 hittade Charles Wood, en brittisk metallurg , olika prover av colombiansk platina på Jamaica, som han skickade till William Brownrigg för vidare undersökning.
År 1750, efter att ha studerat den platina som Wood skickade till honom, presenterade Brownrigg en detaljerad redogörelse för metallen för Royal Society , där han uppgav att han inte hade nämnt det i några tidigare redogörelser för kända mineraler. Brownrigg noterade också platinas extremt höga smältpunkt och eldfasthet mot borax . Andra kemister över hela Europa började snart studera platina, inklusive Andreas Sigismund Marggraf , Torbern Bergman , Jöns Jakob Berzelius , William Lewis och Pierre Macquer . År 1752 publicerade Henrik Scheffer en detaljerad vetenskaplig beskrivning av metallen, som han kallade "vitt guld", inklusive en redogörelse för hur han lyckades smälta platina malm med hjälp av arsenik . Scheffer beskrev platina som mindre böjlig än guld, men med liknande korrosionsbeständighet.
Medel för formbarhet
Carl von Sickingen undersökte platina i stor utsträckning 1772. Han lyckades göra formbar platina genom att legera den med guld, lösa legeringen i heta vattenregier , fälla ut platina med ammoniumklorid , antända ammoniumkloroplatinatet och slå den resulterande finfördelade platina för att göra det hänger ihop. Franz Karl Achard gjorde den första platina -degeln 1784. Han arbetade med platina genom att smälta ihop den med arsenik och sedan förånga arsenik.
Eftersom de andra platina-familjemedlemmarna ännu inte upptäcktes (platina var den första i listan), gjorde Scheffer och Sickingen det falska antagandet att på grund av dess hårdhet-vilket är något mer än för rent järn- skulle platinum vara en relativt icke- böjligt material, till och med sprött ibland, när det i själva verket är formbarhet och formbarhet nära guldets. Deras antaganden kunde inte undvikas eftersom platina som de experimenterade med var mycket förorenad med mycket små mängder platina-familjelement som osmium och iridium , bland annat, som skakade platinumlegeringen. Att legera denna orena platina -rest som kallas "plyoxen" med guld var den enda lösningen vid den tidpunkten för att erhålla en böjlig förening, men för närvarande är mycket ren platina tillgänglig och extremt långa trådar kan dras från ren platina, mycket enkelt på grund av dess kristallina struktur, som liknar den hos många mjuka metaller.
År 1786 gav Charles III av Spanien ett bibliotek och ett laboratorium till Pierre-François Chabaneau för att hjälpa till med hans forskning om platina. Chabaneau lyckades ta bort olika föroreningar från malmen, inklusive guld, kvicksilver, bly, koppar och järn. Detta fick honom att tro att han arbetade med en enda metall, men i sanning innehöll malmen fortfarande de ännu oupptäckta platinagruppmetallerna. Detta ledde till inkonsekventa resultat i hans experiment. Ibland verkade platinan formbar, men när den legerades med iridium skulle den bli mycket mer spröd . Ibland var metallen helt obrännbar, men när den legerades med osmium skulle den förångas. Efter flera månader lyckades Chabaneau producera 23 kilo ren, formbar platina genom att hamra och komprimera svampformen medan den var varm. Chabeneau insåg att platinans infusibilitet skulle ge värde för föremål som gjorts av den, och startade därför ett företag med Joaquín Cabezas som tillverkade platinagöt och -redskap. Detta startade det som kallas "platinaåldern" i Spanien.
Produktion
Platina, tillsammans med resten av platinagruppmetallerna , erhålls kommersiellt som en biprodukt från nickel- och kopparbrytning och bearbetning. Vid elektrorefinering av koppar sätter sig ädelmetaller som silver, guld och platinagruppsmetaller samt selen och tellur till botten av cellen som "anodslam", vilket utgör utgångspunkten för extraktion av platinagruppen metaller.
Om ren platina finns i placerare eller andra malmer, isoleras den från dem genom olika metoder för att subtrahera föroreningar. Eftersom platina är betydligt tätare än många av dess föroreningar kan de lättare föroreningarna avlägsnas genom att helt enkelt flyta bort dem i en vätska. Platina är paramagnetiskt , medan nickel och järn båda är ferromagnetiska . Dessa två föroreningar avlägsnas således genom att köra en elektromagnet över blandningen. Eftersom platina har en högre smältpunkt än de flesta andra ämnen kan många föroreningar brännas eller smälta bort utan att platina smälter. Slutligen är platina resistent mot saltsyra och svavelsyror, medan andra ämnen lätt attackeras av dem. Metallföroreningar kan avlägsnas genom omrörning av blandningen i någon av de två syrorna och återvinning av återstående platina.
En lämplig metod för rening för den råa platinan, som innehåller platina, guld och de andra platinagruppmetallerna, är att bearbeta den med aqua regia , där palladium, guld och platina löses, medan osmium, iridium, rutenium och rodium förbli oreagerad. Guldet fälls ut genom tillsats av järn (II) klorid och efter filtrering av guldet fälls platina ut som ammoniumkloroplatinat genom tillsats av ammoniumklorid . Ammoniumkloroplatinat kan omvandlas till platina genom uppvärmning. Oprecipiterat hexakloroplatinat (IV) kan reduceras med elementärt zink , och en liknande metod är lämplig för småskalig återvinning av platina från laboratorierester. Gruvdrift och raffinering av platina har miljöpåverkan.
Ansökningar

Av de 218 ton platina som såldes 2014 användes 98 ton för fordonets utsläppskontrollanordningar (45%), 74,7 ton för smycken (34%), 20,0 ton för kemisk produktion och petroleumraffinering (9,2%) och 5,85 ton för elektriska applikationer som hårddiskar (2,7%). Resterande 28,9 ton gick till olika andra mindre applikationer, såsom medicin och biomedicin, utrustning för glasframställning, investeringar, elektroder, läkemedel mot cancer, syresensorer , tändstift och turbinmotorer.
Katalysator
Den vanligaste användningen av platina är som katalysator vid kemiska reaktioner, ofta som platinasvart . Det har använts som katalysator sedan början av 1800 -talet, då platinapulver användes för att katalysera antändning av väte. Dess viktigaste tillämpning är i bilar som katalysator , vilket möjliggör fullständig förbränning av låga koncentrationer av oförbrända kolväten från avgaserna till koldioxid och vattenånga. Platina används också i petroleumindustrin som katalysator i ett antal separata processer, men särskilt vid katalytisk reformering av rakdriven nafta till bensin med högre oktan som blir rik på aromatiska föreningar. PtO
2, även känd som Adams katalysator , används som en hydrogeneringskatalysator, speciellt för vegetabiliska oljor . Platina katalyserar också starkt nedbrytningen av väteperoxid till vatten och syre och den används i bränsleceller som en katalysator för minskning av syre .
Standard

Från 1889 till 1960 definierades mätaren som längden på en legeringstång av platina-iridium (90:10), känd som den internationella prototypmätaren . Den föregående ribban gjordes av platina 1799. Fram till maj 2019 definierades kilogrammet som massan av den internationella prototypen för kilogrammet , en cylinder av samma platina-iridiumlegering tillverkad 1879.
Standard Platinum Resistance Thermometer (SPRT) är en av de fyra typerna av termometrar som används för att definiera den internationella temperaturskala 1990 (ITS-90), den internationella kalibreringsstandarden för temperaturmätningar. Motståndstråden i termometern är tillverkad av ren platina (t.ex. NIST tillverkade trådarna av platinastång med en kemisk renhet av 99,999 viktprocent). Förutom laboratoriebruk har Platinum Resistance Thermometry (PRT) också många industriella tillämpningar, industriella standarder inkluderar ASTM E1137 och IEC 60751.
Den standardväteelektrod använder också en platinerad platinaelektrod på grund av dess korrosionsbeständighet och andra attribut.
Som en investering
Platina är en ädelmetall handelsvara ; dess bullion har ISO -valutakoden XPT. Mynt, barer och göt handlas eller samlas in. Platina finner användning i smycken, vanligtvis som en 90–95% legering, på grund av dess inertitet. Det används för detta ändamål för sin prestige och inneboende bullionvärde. Smyckebranschpublikationer rekommenderar juvelerare att presentera små ytliga repor (som de kallar patina ) som en önskvärd egenskap i försök att öka värdet av platinaprodukter.
I urmakeri , Vacheron Constantin , Patek Philippe , Rolex , Breitling , och andra företag använder platina för att producera deras begränsade upplaga watch serien. Urmakare uppskattar platinas unika egenskaper, eftersom den varken försämrar eller slits (den senare kvaliteten i förhållande till guld).
Under perioder med ihållande ekonomisk stabilitet och tillväxt tenderar platinapriset att vara så mycket som dubbelt så mycket som guldpriset, medan under perioder med ekonomisk osäkerhet tenderar platinapriset att sjunka på grund av minskad industriell efterfrågan och falla under priset på guld. Guldpriserna är mer stabila under långsam ekonomisk tid, eftersom guld anses vara en säker fristad. Även om guld också används i industriella applikationer, särskilt inom elektronik på grund av dess användning som ledare, är dess efterfrågan inte så driven av industriell användning. På 1700 -talet fick platinas sällsynthet att kung Louis XV i Frankrike förklarade att den var den enda metall som passar för en kung.
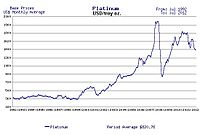
Genomsnittligt pris på platina från 1992 till 2012 i US $ per troy ounce
Andra användningsområden
I laboratoriet används platinatråd för elektroder; platina kokkärl och stöd används i termogravimetrisk analys på grund av de stränga kraven på kemisk inertitet vid uppvärmning till höga temperaturer (~ 1000 ° C). Platina används som legeringsmedel för olika metallprodukter, inklusive fina trådar, icke -korrosiva laboratoriebehållare, medicinska instrument, tandproteser, elektriska kontakter och termoelement. Platina-kobolt, en legering av ungefär tre delar platina och en del kobolt, används för att göra relativt starka permanentmagneter . Platinumbaserade anoder används i fartyg, rörledningar och stålbryggor. Platinumläkemedel används för att behandla en mängd olika cancerformer, inklusive testikel- och äggstockscancer, melanom, småcellig och icke-småcellig lungcancer, myelom och lymfom.
Symbol för prestige inom marknadsföring
Platinas sällsynthet som metall har fått annonsörer att associera det med exklusivitet och rikedom. "Platinum" -debet- och kreditkort har större privilegier än " guld " -kort. " Platinum awards " är den näst högsta möjliga, rankad över "guld", " silver " och " brons ", men under diamant . Till exempel i USA krediteras ett musikalbum som har sålt mer än 1 miljon exemplar som "platina", medan ett album som har sålt mer än 10 miljoner exemplar kommer att certifieras som "diamant". Vissa produkter, som blandare och fordon, med en silverfärgad färg identifieras som "platina". Platina anses vara en ädelmetall, även om användningen inte är lika vanlig som att använda guld eller silver. Ramen för kronan av drottning Elizabeth Drottningmodern , tillverkad för hennes kröning som konsort av kung George VI , är gjord av platina. Det var den första brittiska kronan som gjordes av just denna metall.
Hälsoproblem
Enligt Centers for Disease Control and Prevention kan kortvarig exponering för platinasalter orsaka irritation i ögon, näsa och svalg, och långvarig exponering kan orsaka både luftvägs- och hudallergi. Den nuvarande OSHA- standarden är 2 mikrogram per kubikmeter luft i genomsnitt under ett 8-timmars arbetspass. Den NIOSH har satt en rekommenderat exponeringsgräns (REL) för platina som en mg / m 3 över en 8-timmars arbetsdag.
Eftersom platina är en katalysator vid tillverkning av silikongummi och gelkomponenter i flera typer av medicinska implantat (bröstimplantat, ledersättande proteser, konstgjorda ländryggskivor, vaskulära åtkomstportar, etc.), är det möjligt att platina kan komma in i kroppen och orsaka negativa effekter har förtjänat studier. Den Food and Drug Administration och andra institutioner har granskat frågan och fann inga bevis som tyder på toxicitet in vivo . Kemiskt obegränsad platina har identifierats av FDA som en "falsk cancer" bot ". Missförståndet skapas av vårdpersonal som olämpligt använder metallens namn som ett slangbegrepp för platinabaserade kemoterapimedicin som cisplatin. De är platina föreningar, inte själva metallen.
Se även
Referenser
Vidare läsning
- Young, Gordon (november 1983). "The Miracle Metal — Platinum". National Geographic . Vol. 164 nr. 5. s. 686–706. ISSN 0027-9358 . OCLC 643483454 .
externa länkar
- Platina vid The Periodic Table of Videos (University of Nottingham)
- Nuclides and Isotopes Fourteenth Edition: Chart of the Nuclides , General Electric Company, 1989.
- NIOSH Pocket Guide to Chemical Hazards - Platinum Centers for Disease Control and Prevention
- "PGM -databasen" .
- "En balanserad historisk redogörelse för sekvensen av upptäckter av platina; illustrerad" .
- "Johnson Matthey Technology Review: En gratis kvartalsvis tidskrift för forskning som utforskar vetenskap och teknik i industriella tillämpningar (tidigare publicerad som Platinum Metals Review)" .
- "Platinum-Group Metals Statistics and Information" . USA: s geologiska undersökning.
- "International Platinum Group Metals Association" .