Hepatisk encefalopati - Hepatic encephalopathy
| Hepatisk encefalopati | |
|---|---|
| Andra namn | Portosystemisk encefalopati, hepatisk koma, koma hepaticum |
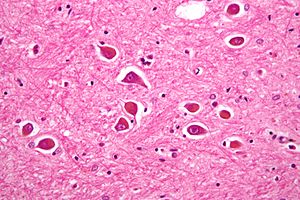 | |
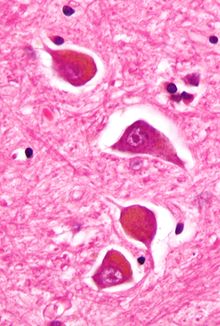
| Mikrograf av astrocyter av typ Alzheimer typ II , vilket kan ses vid hepatisk encefalopati. | |
| Specialitet | Gastroenterologi |
| Symtom | Förändrad medvetenhetsnivå , humörförändringar, personlighetsförändringar, rörelseproblem |
| Typer | Akut, återkommande, ihållande |
| Orsaker | Leversvikt |
| Riskfaktorer | Infektioner , gastrointestinal blödning , förstoppning , elektrolytproblem , vissa mediciner |
| Diagnostisk metod | Baserat på symptom efter att ha uteslutit andra möjliga orsaker |
| Differentialdiagnos | Wernicke – Korsakoffs syndrom , delirium tremens , hypoglykemi , subduralt hematom , hyponatremi |
| Behandling | Stödjande vård , behandling av triggers, laktulosa , levertransplantation |
| Prognos | Genomsnittlig livslängd mindre än ett år hos patienter med allvarlig sjukdom |
| Frekvens | Påverkar> 40% med cirros |
Hepatisk encefalopati ( HE ) är en förändrad medvetenhetsnivå till följd av leversvikt . Dess början kan vara gradvis eller plötslig. Andra symtom kan vara rörelseproblem, humörförändringar eller personlighetsförändringar . I avancerade skeden kan det resultera i koma .
Leverencefalopati kan förekomma hos personer med akut eller kronisk leversjukdom. Episoder kan utlösas av infektioner , gastrointestinal blödning , förstoppning , elektrolytproblem eller vissa mediciner. Den bakomliggande mekanismen antas innebära uppbyggnad av ammoniak i blodet, ett ämne som normalt avlägsnas av levern . Diagnosen baseras vanligtvis på symptom efter att andra potentiella orsaker har uteslutits. Det kan stödjas av ammoniaknivåer i blodet, ett elektroencefalogram eller en CT -skanning av hjärnan.
Hepatisk encefalopati är möjligen reversibel med behandling. Detta innebär vanligtvis stödjande vård och adressering av händelserna. Laktulosa används ofta för att minska ammoniakhalten. Vissa antibiotika (t.ex. rifaximin ) och probiotika är andra möjliga alternativ. En levertransplantation kan förbättra resultaten hos dem med svår sjukdom.
Mer än 40% av personer med cirros utvecklar hepatisk encefalopati. Mer än hälften av dem med cirros och signifikant HE lever mindre än ett år. Hos dem som kan få levertransplantation är risken för död mindre än 30% under de följande fem åren. Tillståndet har beskrivits sedan minst 1860.
tecken och symtom
Den mildaste formen av hepatisk encefalopati är svår att upptäcka kliniskt, men kan påvisas vid neuropsykologisk testning . Det upplevs som glömska, mild förvirring och irritabilitet. Den första etappen av hepatisk encefalopati kännetecknas av ett inverterat sömn-vaknande mönster (sover om dagen, är vaken på natten). Det andra steget präglas av slöhet och personlighetsförändringar. Det tredje steget präglas av förvärrad förvirring. Den fjärde etappen kännetecknas av en progression till koma.
Mer allvarliga former av hepatisk encefalopati leder till en försämrad medvetenhet, från slöhet till somnolens och så småningom koma. I mellanstadierna observeras en karakteristisk ryckrörelse av lemmarna ( asterixis , "leverflik" på grund av dess flaxande karaktär); detta försvinner när somnolensen förvärras. Det finns desorientering och amnesi, och oinhiberat beteende kan förekomma. I det tredje stadiet kan neurologisk undersökning avslöja klonus och positivt Babinski -tecken . Koma och anfall representerar det mest avancerade stadiet; hjärnödem (svullnad i hjärnvävnaden) leder till döden.
Encefalopati uppträder ofta tillsammans med andra symptom och tecken på leversvikt. Dessa kan inkludera gulsot (gul missfärgning av huden och ögonvitorna), ascites (vätskeansamling i bukhålan) och perifert ödem (svullnad i benen på grund av vätskeansamling i huden). De senreflexer kan vara överdriven, och plantar reflex kan vara onormal, nämligen sträcker snarare än böjning (Babinskis tecken) i svår encefalopati. En särskild lukt på en drabbad persons andedräkt ( foetor hepaticus ) kan detekteras.
Orsaker
I en liten del av fallen orsakas encefalopati direkt av leversvikt; detta är mer sannolikt vid akut leversvikt. Mer vanligt, särskilt vid kronisk leversjukdom, utlöses hepatisk encefalopati av ytterligare en orsak, och att identifiera dessa utlösare kan vara viktigt för att behandla episoden effektivt.
| Typ | Orsaker |
|---|---|
| Överdriven kvävebelastning |
Förbrukning av stora mängder protein , gastrointestinal blödning t.ex. från esofagusvarier (blod är högt i protein, som återabsorberas från tarmen), njursvikt (oförmåga att utsöndra kvävehaltiga avfallsprodukter som urea ), förstoppning |
|
Elektrolyt eller metabolisk störning |
Hyponatremi (låg natriumnivå i blodet) och hypokalemi (låga kaliumnivåer ) - dessa är båda vanliga hos dem som tar diuretika , som ofta används för behandling av ascites; dessutom alkalos (minskad syranivå), hypoxi (otillräckliga syrenivåer), uttorkning |
| Läkemedel och mediciner |
Lugnande medel som bensodiazepiner (används ofta för att undertrycka alkoholabstinens eller ångestsyndrom ), narkotika (används som smärtstillande eller missbrukande läkemedel), antipsykotika , alkoholförgiftning |
| Infektion | Lunginflammation , urinvägsinfektion , spontan bakteriell peritonit , andra infektioner |
| Andra | Kirurgi , progression av leversjukdomen, ytterligare orsak till leverskada (t.ex. alkoholisk hepatit , hepatit A ) |
| Okänd | I 20–30% av fallen kan ingen tydlig orsak till ett angrepp hittas |
Hepatisk encefalopati kan också uppstå efter skapandet av en transjugulär intrahepatisk portosystemisk shunt (TIPS). Detta används vid behandling av eldfasta ascites , blödning från esofagusvaricer och hepatorenalt syndrom . TIPS-relaterad encefalopati förekommer i cirka 30% av fallen, med risken högre hos dem med tidigare episoder av encefalopati, högre ålder, kvinnligt kön och leversjukdom på grund av andra orsaker än alkohol.
Patogenes

Det finns olika förklaringar till varför leversvikt eller portosystemisk shuntning kan leda till encefalopati. Hos friska försökspersoner, kväve -innehållande föreningar från tarmen , genererad av tarmbakterier från mat, transporteras av portvenen till levern, där 80-90% är metaboliseras genom ureacykeln och / eller utsöndras omedelbart. Denna process försämras i alla typer av hepatisk encefalopati, antingen för att hepatocyterna (levercellerna) inte kan metabolisera avfallsprodukterna eller för att portalvenöst blod kringgår levern genom säkerhetscirkulation eller en medicinskt konstruerad shunt. Kväveavfallsprodukter ackumuleras i systemcirkulationen (därav den äldre termen "portosystemisk encefalopati"). Den viktigaste avfallsprodukten är ammoniak (NH 3 ). Denna lilla molekyl passerar blod -hjärnbarriären och absorberas och metaboliseras av astrocyterna , en population av celler i hjärnan som utgör 30% av hjärnbarken . Astrocyter använder ammoniak vid syntetisering av glutamin från glutamat . De ökade halterna av glutamin leder till ett ökat osmotiskt tryck i astrocyterna, som blir svullna. Det finns ökad aktivitet för det hämmande γ-aminosmörsyra (GABA) -systemet och energitillförseln till andra hjärnceller minskar. Detta kan ses som ett exempel på hjärnödem av typen "cytotoxisk".
Trots många studier som visar ammoniaks centrala roll, korrelerar ammoniakhalterna inte alltid med svårighetsgraden av encefalopati; det misstänks att detta innebär att mer ammoniak redan har absorberats i hjärnan hos personer med svåra symptom vars serumhalter är relativt låga. Andra avfallsprodukter som är involverade i hepatisk encefalopati inkluderar merkaptaner (ämnen som innehåller en tiolgrupp), kortkedjiga fettsyror och fenol .
Många andra abnormiteter har beskrivits vid hepatisk encefalopati, även om deras relativa bidrag till sjukdomstillståndet är osäkert. Förlust av glutamattransportörgenuttryck (särskilt EAAT 2) har tillskrivits akut leversvikt. Bensodiazepinliknande föreningar har detekterats vid ökade nivåer såväl som avvikelser i GABA -neurotransmissionssystemet . En obalans mellan aromatiska aminosyror (fenylalanin, tryptofan och tyrosin) och grenade aminosyror (leucin, isoleucin och valin) har beskrivits; detta skulle leda till generering av falska signalsubstanser (t.ex. oktopamin och 2-hydroxifenetylamin ). Dysreglering av serotoninsystemet har också rapporterats. Förtäring av zink och ackumulering av mangan kan spela en roll. Inflammation någon annanstans i kroppen kan utlösa encefalopati genom verkan av cytokiner och bakteriell lipopolysackarid på astrocyter.
Diagnos
Undersökningar
Diagnosen hepatisk encefalopati kan endast ställas i närvaro av bekräftad leversjukdom (typ A och C) eller en portosystemisk shunt (typ B), eftersom dess symtom liknar de som uppträder vid andra encefalopatier . För att göra skillnaden krävs onormala leverfunktionstester och/eller ultraljud som tyder på leversjukdom, och helst en leverbiopsi . Symtomen på hepatisk encefalopati kan också uppstå från andra tillstånd, såsom blödning i hjärnan och anfall (som båda är vanligare vid kronisk leversjukdom). En CT -skanning av hjärnan kan krävas för att utesluta blödning i hjärnan, och om anfallsaktivitet misstänks kan en elektroencefalograf (EEG) -studie utföras. Sällsyntare efterlikningar av encefalopati är meningit , encefalit , Wernickes encefalopati och Wilsons sjukdom ; dessa kan misstänkas av kliniska skäl och bekräftas med undersökningar.
Diagnosen hepatisk encefalopati är klinisk, när andra orsaker till förvirring eller koma har uteslutits; inget test diagnostiserar helt eller utesluter det. Serum ammoniakhalter är förhöjda hos 90% av människorna, men inte all hyperammonemi (höga ammoniaknivåer i blodet) är associerad med encefalopati. En CT -skanning av hjärnan visar vanligtvis ingen abnormitet utom i steg IV -encefalopati, när hjärnsvullnad (cerebralt ödem) kan vara synlig. Andra metoder för neuroimaging , såsom magnetisk resonansavbildning (MRI), anses för närvarande inte vara användbara, även om de kan visa avvikelser. Elektroencefalografi visar inga tydliga abnormiteter i steg 0, även om minimal HE är närvarande; i steg I, II och III finns det trefasvågor över frontalloberna som pendlar vid 5 Hz, och i steg IV sker långsam deltavågsaktivitet . Ändringarna i EEG är emellertid inte tillräckligt typiska för att kunna skilja hepatisk encefalopati från andra tillstånd.
När diagnosen encefalopati har ställts, försöker man utesluta bakomliggande orsaker (som de som anges ovan i " orsaker "). Detta kräver blodprov (urea och elektrolyter, fullt blodtal, leverfunktionstester), vanligtvis en röntgenstråle och urinanalys . Om det finns ascites kan en diagnostisk paracentes (avlägsnande av ett vätskeprov med en nål) krävas för att identifiera spontan bakteriell peritonit (SBP).
Klassificering
West Haven kriterier
Svårighetsgraden av hepatisk encefalopati graderas med West Haven Criteria; detta baseras på graden av försämring av autonomi, förändringar i medvetande, intellektuell funktion, beteende och beroende av terapi.
- Grad 0 - Inga uppenbara förändringar än en potentiellt mild minskning av intellektuell förmåga och koordination
- Grad 1 - Trivial brist på medvetenhet; eufori eller ångest; förkortad uppmärksamhet; försämrad prestanda för addition eller subtraktion
- Grad 2 - Slöhet eller apati ; minimal desorientering för tid eller plats; subtil personlighetsförändring; olämpligt beteende
- Grade 3 - Sömnighet till semi stupor , men svarar på verbala stimuli; förvirring; grov desorientering
- Klass 4 - Koma
Typer
En klassificering av hepatisk encefalopati introducerades vid World Congress of Gastroenterology 1998 i Wien. Enligt denna klassificering är hepatisk encefalopati indelad i typ A, B och C beroende på den bakomliggande orsaken.
- Typ A (= akut) beskriver hepatisk encefalopati associerad med akut leversvikt , vanligtvis associerat med cerebralt ödem
- Typ B (= bypass ) orsakas av portal-systemisk shuntning utan tillhörande inneboende leversjukdom
- Typ C (= cirros ) förekommer hos personer med cirros - denna typ är indelad i episodisk , ihållande och minimal encefalopati
Termen minimal encefalopati (MHE) definieras som encefalopati som inte leder till kliniskt öppen kognitiv dysfunktion, men kan demonstreras med neuropsykologiska studier. Detta är fortfarande ett viktigt fynd, eftersom minimal encefalopati har visat sig försämra livskvaliteten och öka risken för inblandning i vägtrafikolyckor .
Minimal HE
Diagnosen minimal hepatisk encefalopati kräver neuropsykologisk testning per definition. Äldre tester inkluderar "siffror som ansluter testet" A och B (mäter den hastighet med vilken man kan ansluta slumpmässigt spridda nummer 1–20), "blockdesigntestet" och "siffrorsymboltestet". År 2009 drog en expertpanel slutsatsen att neuropsykologiska testbatterier som syftar till att mäta flera kognitiva funktionsområden i allmänhet är mer tillförlitliga än enstaka tester och tenderar att vara starkare korrelerade med funktionell status. Både det repeterbara batteriet för bedömning av neuropsykologisk status (RBANS) och PSE-syndromtest kan användas för detta ändamål. PSE-Syndrom-testet, utvecklat i Tyskland och validerat i flera andra europeiska länder, innehåller äldre bedömningsverktyg, såsom nummeranslutningstest.
Behandling
De med svår encefalopati (stadier 3 och 4) är i riskzonen för att hindra deras luftvägar på grund av minskad skyddsreflexer såsom kräkreflexen . Detta kan leda till andningsstopp . Det är nödvändigt att överföra personen till en högre sjukvård, till exempel en intensivvårdsenhet , och intubation av luftvägarna är ofta nödvändig för att förhindra livshotande komplikationer (t.ex. aspiration eller andningssvikt). Placering av ett nasogastriskt rör tillåter säker administration av näringsämnen och medicinering.
Behandlingen av hepatisk encefalopati beror på den misstänkta bakomliggande orsaken (typ A, B eller C) och närvaron eller frånvaron av underliggande orsaker. Om encefalopati utvecklas vid akut leversvikt (typ A), även i en mild form (grad 1–2), indikerar det att en levertransplantation kan krävas och överföring till ett specialistcenter rekommenderas. Hepatisk encefalopati typ B kan uppstå hos dem som har genomgått ett TIPS -förfarande; i de flesta fall löser detta spontant eller med de medicinska behandlingar som diskuteras nedan, men i en liten andel på cirka 5% krävs ocklusion av shunten för att hantera symptomen.
Vid hepatisk encefalopati typ C är identifiering och behandling av alternativa eller underliggande orsaker central för den första behandlingen. Med tanke på infektionsfrekvensen som den bakomliggande orsaken administreras antibiotika ofta empiriskt (utan kunskap om den exakta källan och infektionens art). När en episod av encefalopati har behandlats effektivt kan det behöva fattas ett beslut om huruvida man ska förbereda sig för en levertransplantation.
Diet
Tidigare trodde man att konsumtion av protein även vid normala nivåer ökade risken för hepatisk encefalopati. Detta har visat sig vara felaktigt. Många med kronisk leversjukdom är dessutom undernärda och behöver tillräckligt med protein för att bibehålla en stabil kroppsvikt. En kost med tillräckligt med protein och energi rekommenderas därför.
Kosttillskott med grenade aminosyror har visat förbättring av encefalopati och andra komplikationer av cirros. Vissa studier har visat nytta av administrering av probiotika ("friska bakterier").
Laktulos/laktitol
Laktulos och laktitol är disackarider som inte absorberas från matsmältningskanalen. Man tror att de minskar ammoniakgenerering av bakterier, gör ammoniaken oabsorberbar genom att omvandla den till ammonium (NH 4 + ) joner och ökar transitering av tarminnehåll genom tarmen. Doser på 15-30 ml administreras vanligtvis tre gånger om dagen; resultatet syftar till att vara 3–5 mjuka avföringar om dagen, eller (i vissa inställningar) ett avförings -pH på <6,0. Laktulos kan också ges av lavemang , särskilt om encefalopati är allvarlig. Oftare, fosfat är lavemang används. Detta kan lindra förstoppning, en av orsakerna till encefalopati, och öka tarmpassagen.
Laktulos och laktitol är fördelaktiga för behandling av hepatisk encefalopati och är den rekommenderade förstahandsbehandlingen. Laktulosa verkar inte vara mer effektiv än laktitol för behandling av personer med hepatisk encefalopati. Biverkningar av laktulos och laktitol inkluderar möjligheten till diarré , uppblåsthet i buken , gasighet och illamående . Vid akut leversvikt är det oklart om laktulos är fördelaktigt. Den möjliga biverkningen av uppblåsthet kan störa en levertransplantation om det behövs.
Antibiotika
Antibiotikumet rifaximin kan rekommenderas utöver laktulos för dem med återkommande sjukdom. Det är ett icke -absorberbart antibiotikum från rifamycinklassen . Detta antas fungera på liknande sätt som andra antibiotika men utan de komplikationer som är knutna till neomycin eller metronidazol . På grund av den långa historien och lägre kostnaden för laktulosanvändning används rifaximin i allmänhet bara som en andrahandsbehandling om laktulos tolereras dåligt eller inte är effektivt. När rifaximin tillsätts till laktulosa kan kombinationen av de två vara effektivare än varje komponent separat. Rifaximin är dyrare än laktulosa, men kostnaden kan kompenseras av färre sjukhusinläggningar för encefalopati.
Antibiotika neomycin och metronidazol är andra antibiotika som används för att behandla hepatisk encefalopati. Motivet för deras användning var det faktum att ammoniak och andra avfallsprodukter genereras och omvandlas av tarmbakterier, och att döda dessa bakterier skulle minska genereringen av dessa avfallsprodukter. Neomycin valdes på grund av dess låga tarmabsorption , eftersom neomycin och liknande aminoglykosidantibiotika kan orsaka hörselnedsättning och njursvikt om de används genom injektion . Senare studier visade att neomycin verkligen absorberades när det togs i munnen , med följdkomplikationer. Metronidazol används på samma sätt mindre eftersom långvarig användning kan orsaka nervskada , förutom gastrointestinala biverkningar.
L -ornitin och L -aspartat
Kombinationen L -ornitin och L -aspartat (LOLA) sänker ammoniakhalten i en persons blod. Mycket svaga bevis från kliniska prövningar tyder på att LOLA -behandling kan gynna personer med leverencefalopati. LOLA sänker ammoniaknivåerna genom att öka bildningen av urea genom ureacykeln , en metabolisk väg som tar bort ammoniak genom att förvandla den till den neutrala substansen urea . LOLA kan kombineras med laktulosa och/eller rifaximin om dessa enbart är ineffektiva för att kontrollera symtomen.
Epidemiologi och prognos
Hos personer med cirros är risken att utveckla hepatisk encefalopati 20% per år, och när som helst uppvisar cirka 30-45% av personer med cirros tecken på öppen encefalopati. Förekomsten av minimal hepatisk encefalopati som kan påvisas vid formell neuropsykologisk testning är 60–80%; detta ökar sannolikheten för att utveckla öppen encefalopati i framtiden. När hepatisk encefalopati har utvecklats bestäms prognosen till stor del av andra markörer för leversvikt, såsom nivåerna av albumin (ett protein som produceras av levern), protrombintiden (ett koagulationstest , som bygger på proteiner som produceras i levern ), förekomst av ascites och nivån av bilirubin (en nedbrytningsprodukt av hemoglobin som konjugeras och utsöndras av levern). Tillsammans med svårighetsgraden av encefalopati har dessa markörer införlivats i Child-Pugh-poängen ; denna poäng bestämmer överlevnaden på ett och två år och kan hjälpa till med ett beslut att erbjuda levertransplantation.
Vid akut leversvikt förutsäger utvecklingen av svår encefalopati starkt kortvarig dödlighet och är nästan lika viktig som arten av den bakomliggande orsaken till leversvikt vid bestämning av prognosen. Historiskt sett används mycket använda kriterier för att erbjuda levertransplantation, såsom King's College Criteria , begränsad användning och de senaste riktlinjerna avskräcker alltför mycket från dessa kriterier. Förekomsten av hepatisk encefalopati hos personer med Wilsons sjukdom (ärftlig kopparackumulering) och svampförgiftning indikerar ett akut behov av levertransplantation.
Historia
Förekomsten av stört beteende hos personer med gulsot kan ha beskrivits i antiken av Hippokrates of Cos (ca 460–370 fvt). Celsus och Galen (första respektive tredje århundradet) erkände båda tillståndet. Många moderna beskrivningar av sambandet mellan leversjukdom och neuropsykiatriska symtom gjordes på arton- och artonhundratalet; till exempel rapporterade Giovanni Battista Morgagni (1682–1771) 1761 att det var ett progressivt tillstånd.
På 1950-talet räknade flera rapporter upp de många abnormiteter som rapporterats tidigare och bekräftade den tidigare uttalade teorin om att metabolisk försämring och portosystemisk shuntning är de bakomliggande mekanismerna bakom hepatisk encefalopati och att de kväverika föreningarna härrör från tarmen. Professor Dame Sheila Sherlock (1918–2001) utförde många av dessa studier vid Royal Postgraduate Medical School i London och därefter på Royal Free Hospital . Samma grupp undersökte proteinbegränsning och neomycin.
Den West Haven klassificering formulerades av professor Harold Conn (1925-2011) och hans kollegor vid Yale University samtidigt undersöka den terapeutiska effekten av laktulos.
Referenser
externa länkar
| Klassificering | |
|---|---|
| Externa resurser |