Alkoholfri fet leversjukdom - Non-alcoholic fatty liver disease
| Alkoholfri fettleversjukdom | |
|---|---|
| Andra namn | NAFLD, metabolisk (dysfunktion) associerad fet leversjukdom, MAFLD |
 | |
| Stadier av alkoholfri fettleversjukdom, som går från friska till steatos (fettackumulering), inflammation, fibros och cirros. | |
| Specialitet | Hepatologi |
| Symtom | Asymptomatisk , leversvikt |
| Komplikationer | Skrumplever , levercancer , leversvikt , hjärt -kärlsjukdom |
| Varaktighet | Långsiktigt |
| Typer | Alkoholfri fettlever (NAFL), alkoholfri steatohepatit (NASH) |
| Orsaker | Genetiskt, miljömässigt |
| Riskfaktorer | Fetma , metabolt syndrom , typ 2 -diabetes , leversjukdom |
| Diagnostisk metod | Leverbiopsi |
| Behandling | Viktminskning (kost och träning) |
| Prognos | Beror på typ |
| Frekvens | 24% i världens befolkning, 80% i fetma, 20% i normalvikt |
| Dödsfall | NASH: 2,6% risk för dödsfall per år |
Alkoholfri fettlever ( NAFLD ), även känd som metaboliskt (dysfunktion) associerad fettlever ( MAFLD ), är överdriven fet uppbyggnad i levern utan annan tydlig orsak såsom alkohol . Det finns två typer; alkoholfri fettlever ( NAFL ) och alkoholfri steatohepatit ( NASH ), med den senare även leverinflammation . Alkoholfri fet leversjukdom är mindre farlig än NASH och utvecklas vanligtvis inte till NASH eller levercirros . När NAFLD utvecklas till NASH kan det så småningom leda till komplikationer som cirros, levercancer , leversvikt eller hjärt -kärlsjukdom .
Fetma och typ 2 -diabetes är starka riskfaktorer för NAFLD. Andra risker inkluderar övervikt , metaboliskt syndrom (definierat som minst tre av de fem följande medicinska tillstånden: bukfetma, högt blodtryck , högt blodsocker , högt serumtriglycerider och lågt serum HDL -kolesterol ), en kost med hög fruktoshalt och äldre ålder. NAFLD och alkoholisk leversjukdom är typer av fet leversjukdom . Att få ett prov av levern efter att ha uteslutit andra potentiella orsaker till fettlever kan bekräfta diagnosen.
Behandling för NAFLD är viktminskning genom kostförändringar och träning. Det finns preliminära bevis för pioglitazon och vitamin E ; bariatrisk kirurgi kan förbättra eller lösa allvarliga fall. De med NASH har en 2,6% ökad risk att dö per år.
NAFLD är den vanligaste leversjukdomen i världen och finns i cirka 25% av världens befolkning. Det är också mycket vanligt i utvecklade länder, till exempel USA, och drabbade cirka 75 till 100 miljoner amerikaner 2017. Över 90% av feta, 60% av diabetiker och upp till 20% normalviktiga människor utvecklar det. NAFLD är den främsta orsaken till kronisk leversjukdom och den näst vanligaste orsaken till levertransplantation i USA och Europa från och med 2017. NAFLD drabbar cirka 20 till 25% av människorna i Europa. I USA tyder uppskattningar mellan 30 och 40% av vuxna har NAFLD, och cirka 3 till 12% av vuxna har NASH. Den årliga ekonomiska bördan var cirka 103 miljarder dollar i USA 2016.
Definition
En onormal ansamling av fett i levern i avsaknad av sekundära orsaker till fettlever, såsom betydande alkoholanvändning , viral hepatit eller mediciner som kan framkalla fettlever karakteriserar alkoholfri fettleversjukdom (NAFLD). Termen NAFLD omfattar ett kontinuum av leverabnormaliteter, från alkoholfri fettlever (NAFL, enkel steatos) till alkoholfri steatohepatit (NASH). Dessa sjukdomar börjar med fettackumulering i levern (hepatisk steatos ). En lever kan förbli fet utan att störa leverfunktionen (NAFL), men genom olika mekanismer och möjliga förolämpningar av levern kan den också utvecklas till alkoholfri steatohepatit (NASH), ett tillstånd där steatos kombineras med inflammation och ibland fibros ( steatohepatit). NASH kan sedan leda till komplikationer som cirros och hepatocellulärt karcinom .
Ett nytt namn, metabolisk dysfunktion associerad fet leversjukdom, föreslogs efter att 70% av en panel av experter uttryckte stöd för detta namn.
tecken och symtom
Personer med NAFLD har ofta inga märkbara symtom , och NAFLD upptäcks ofta endast under rutinmässiga blodprov eller orelaterad bukavbildning eller leverbiopsi . I vissa fall kan NAFLD orsaka symptom relaterade till nedsatt leverfunktion som trötthet, sjukdomskänsla , och tråkig höger övre kvadrant magbesvär . Mild gul missfärgning av huden kan förekomma, även om detta är sällsynt. NASH kan allvarligt försämra leverfunktionen, vilket leder till cirros , leversvikt och levercancer .
Komorbiditeter
NAFLD är starkt associerad med eller orsakad av typ 2 -diabetes, insulinresistens och metaboliskt syndrom (definieras som minst tre av de fem följande medicinska tillstånden: bukfetma, högt blodtryck, högt blodsocker, höga serumtriglycerider och lågt serumhögt -densitetslipoprotein). Det är också associerat med hormonella störningar ( panhypopituitarism , hypotyreos , hypogonadism , polycystiskt ovariesyndrom ), ihållande förhöjda transaminaser , ökande ålder och hypoxi orsakad av obstruktiv sömnapné , med några av dessa tillstånd som förutsäger sjukdomsprogression.
Majoriteten av normalviktiga personer som drabbas av NAFLD ("lean NAFLD") har nedsatt insulinkänslighet, är stillasittande och har ökad risk för hjärt-kärlsjukdom och ökade lipidnivåer i levern. Detta är konsekvenserna av en minskad kapacitet för lagring av fett och minskad mitokondriell funktion i fettvävnad och ökad hepatisk de novo lipogenes . En ny systematisk översyn har rapporterat en ökad risk för allvarlig COVID-19-infektion hos NAFLD-patienter; emellertid observerades ingen skillnad i dödlighet mellan NAFLD- och icke-NAFLD-patienter.
Riskfaktorer
Genetik
Två tredjedelar av familjer med tidigare diabetes typ 2 rapporterar att mer än en familjemedlem har NAFLD. Det finns en högre risk för fibros för familjemedlemmar där någon diagnostiserats med NASH. Asiatiska populationer är mer mottagliga för metaboliskt syndrom och NAFLD än deras västerländska motsvarigheter. Spanska personer har en högre prevalens av NAFLD än vita individer, medan den lägsta prevalensen observeras hos svarta individer. NAFLD är dubbelt så vanligt hos män jämfört med kvinnor, vilket kan förklaras av lägre nivåer av östrogen hos män.
Genetiska variationer i två gener är associerade med NAFLD: icke-synonyma enkelnukleotidpolymorfismer (SNP) i PNPLA3 och TM6SF2 . Båda korrelerar med NAFLD -närvaro och svårighetsgrad, men deras roller för diagnos är fortfarande oklara. Även om NAFLD har en genetisk komponent, rekommenderar American Association for the Study of Liver Diseases (AASLD) inte att screena familjemedlemmar eftersom det inte finns tillräckligt med bekräftelse på ärftlighet, även om det finns vissa bevis från familjeaggregering och tvillingstudier .
Diet
Enligt Asia-Pacific Working Group (APWG) om NAFLD är övernäring en viktig faktor för NAFLD och NASH, särskilt för lean NAFLD. Kostkomposition och kvantitet, i synnerhet omega-6-fettsyror och fruktos , har viktiga roller för sjukdomsprogression från NAFL till NASH och fibros. Kolinbrist kan leda till utveckling av NAFLD.
Livsstil
Vanlig snarkning kan vara en riskfaktor för NAFLD, även efter redovisning av etablerade riskfaktorer hos individer. Svåra fall av snarkning leder till blockering av luftvägarna eller andningssvårigheter vid sömn och signalerar vanligtvis förekomsten av obstruktiv sömnapné (OSAS), ett mycket allvarligare andningstillstånd. Blockering eller förträngning av luftvägarna, även tillfälligt, kan få kroppen att uppleva sänkta syrenivåer i blodet, och dessa tillstånd av hypoxi återkommer hos personer med obstruktiv sömnapné (OSAS). Konstant hypoxi kan orsaka olika förändringar i kroppen, såsom vävnadsinflammation, ökad insulinresistens och leverskada. En prospektiv kohortstudie fann att sambandet mellan vanligt snarkning och NAFLD -utveckling var signifikant, och trenden noterades vara mest framträdande hos magra individer.
Patofysiologi
Det primära kännetecknet för NAFLD är ackumulering av lipider i levern, till stor del i form av triglycerider . Mekanismerna för triglycerider ackumuleras och orsakerna till att ackumulering kan leda till leversvikt är komplexa och ofullständigt förstådda. NAFLD kan inkludera steatos tillsammans med olika tecken på leverskada: antingen lobulär eller portalinflammation (en form av leverskada) eller ballongförfall . På liknande sätt kan NASH inkludera histologiska funktioner såsom portalinflammation, polymorfonukleära cellinfiltrat, Mallory -kroppar , apoptotiska kroppar, tydliga vakuolerade kärnor, mikrovesikulär steatos , megamitokondrier och perisinusoidal fibros . NASH ökar hepatocytdöd via apoptos eller nekroptos ökar i NASH jämfört med enkel steatos, och inflammation är ett kännetecken för NASH.
En debatterad mekanism föreslår att hepatisk steatos utvecklas till steatos med inflammation efter ytterligare skada eller andra träff . Oxidativ stress , hormonell obalans och mitokondriella abnormiteter är potentiella orsaker till detta "andra träff" -fenomen. En ytterligare nutrigenomics -modell som heter multipel träff förlänger den andra träffmodellen , vilket tyder på att flera sjukdomsbiomarkörer och faktorer som gener och näring påverkar NAFLD och NASH -progression. Denna modell försöker använda dessa faktorer för att förutsäga effekterna av livsstilsförändringar och genetik för utvecklingen av NAFLD -patologin. Många forskare beskriver NAFLD som en multisystemsjukdom , eftersom den påverkar och påverkas av andra organ och andra regleringsvägar än levern.
Ackumulering av senescenta celler i levern ses hos personer med NAFLD. Hos möss resulterar lever senescerande hepatocyter i ökad leverfettavsättning. Behandling av NAFLD -möss med senolytiska medel har visat sig minska hepatisk steatos.
Baserat på genutslagningsstudier i murina modeller har det föreslagits att bland många andra patogena faktorer kan TGF -betasignaler vara avgörande för att främja utvecklingen av NASH.
Fruktosförbrukning
Alkoholfri och alkoholisk fet leversjukdom delar liknande histologiska egenskaper, vilket tyder på att de kan dela vanliga patogena vägar. Fruktos kan orsaka leverinflammation och beroende på samma sätt som etanol genom att använda liknande metaboliska vägar, till skillnad från glukos. Därför hävdar vissa forskare att alkoholfria och alkoholhaltiga fettleversjukdomar är mer lika än man tidigare trott. Dessutom främjar hög fruktosförbrukning fettackumulering i levern genom att stimulera de novo lipogenes i levern och minska beta-oxidationen av fett. Till skillnad från socker glukos , enzymet fructokinase metaboliserar snabbt fruktos. Detta leder till en minskad nivå av intracellulärt adenosintrifosfat (ATP). Minskningen av ATP ökar oxidativ stress och försämringar av korrekt proteinsyntes och mitokondriell funktion i levern.
Insulinresistens
Insulinresistens bidrar till ackumulering av giftigt fett i levern på flera sätt. För det första främjar det frisättning av fria fettsyror (FFA) från fettvävnad i blodet. Vanligtvis lagrar fettvävnaden lipider i form av triglycerider , vilket långsamt släpper ut dem i blodet när insulin är lågt. I insulinresistent fettvävnad, till exempel hos personer med fetma och typ 2-diabetes, bryts fler triglycerider ned i FFA och släpps ut i blodomloppet, vilket främjar upptag i levern. För det andra främjar insulin produktionen av nya FFA i levern via de novo lipogenes ; denna produktion av leverfetter fortsätter att stimuleras av insulin, även när andra vävnader är insulinresistenta. Dessa FFA kombineras tillbaka till triglycerider i levern och utgör den viktigaste beståndsdelen i det ackumulerade fettet i levern. De tre källorna till fria fettsyror som bidrar till ackumulering av levertriglycerider inkluderar FFA som cirkulerar i blodomloppet (59%), FFA som härrör från kolhydrater som fruktos och glukos (26%) och kost (14%). Trots ackumulering av triglycerider i levern är de inte direkt giftiga för levervävnad. Istället har förändring av profilen för de andra lipidsubtyperna som finns i levern, såsom diacylglyceroler , fosfolipider , ceramider och fritt kolesterol , en mer betydelsefull roll i patogenesen av NAFLD.
När NAFLD har utvecklats i svårighetsgrad till NASH, främjar detta ytterligare insulinresistens i fettvävnaden och levern, vilket resulterar i en skadlig cykel av insulinresistens, ackumulering av leverfett och inflammation. Fettvävnad dysfunktion minskar också utsöndring av insulin-sensibiliserande adipokin adiponectin hos personer med NAFLD. Adiponectin har flera egenskaper som skyddar levern. Dessa egenskaper inkluderar förbättrad leverfettmetabolism, minskad de novo lipogenes, minskad glukosproduktion i levern , antiinflammatoriska egenskaper och anti-fibrotiska egenskaper. Skelettmuskelinsulinresistens kan också spela en roll vid NAFLD. Insulinresistent skelettmuskel är inte lika effektiv för att ta upp glukos från blodomloppet efter en måltid. Detta ineffektiva glukosupptag främjar omfördelning av förbrukade kolhydrater från glukos avsedd att användas i glykogenlager i skelettmusklerna till att användas som ett substrat för de novo lipogenes i levern.
Dysbios
Störningar i tarmmikrobioten verkar påverka NAFLD -risken på flera sätt. Personer med NASH kan ha förhöjda nivåer av etanol i blodet och proteobakterier (som producerar alkohol), med dysbios som föreslås som en mekanism för denna förhöjning. Förändringar i tarmmikrobiotas sammansättning kan påverka NAFLD -risken på flera sätt. Dessa förändringar tycks öka permeabiliteten hos tarmvävnad och därigenom underlätta ökad leverexponering för skadliga ämnen (t.ex. translokerade bakterier, bakterietoxiner och inflammatoriska kemiska signaler ). Den ökade transporten av dessa skadliga ämnen till levern främjar leverinflammation, förbättrar närings- och kaloriupptagning och förändrar kolinmetabolismen . Högre nivåer av tarmbakterier som producerar butyrat kan vara skyddande.
Överdrivet intag av makronäringsämnen bidrar till tarminflammation och störning av homeostas, och mikronäringsämnen kan också vara inblandade. Förutom att minska vikt och riskfaktorer kan livsstilsförändringar leda till positiva förändringar i tarmmikrobioten. I synnerhet kan kostdiversitet spela en roll som förbises i djurstudier, eftersom de ofta jämför en västerrik diet med låg fetthalt och låg mångfald mot en låg fetthalt men med högre mångfald. Hälsofördelarna efter bariatrisk kirurgi kan också innebära förändringar i tarmmikrobioten genom att öka tarmpermeabiliteten.
Diagnos
NAFLD definieras av bevis på fet lever utan en annan faktor som kan förklara leverfettansamlingen, såsom överdriven alkoholanvändning (> 21 standarddrycker /vecka för män och> 14 för kvinnor i USA;> 30 g dagligen för män och> 20 g för kvinnor i Storbritannien och EU,> 140 g/vecka för män och> 70 g/vecka för kvinnor i Asien-Stillahavsområdet och de flesta NIH- kliniska studier), läkemedelsinducerad steatos , kronisk hepatit C, ärftlighet eller brister i parenteral näring som kolin och endokrina tillstånd. Om någon av dessa faktorer observeras rekommenderas en undersökning av alternativa orsaker till fettlever som inte är relaterad till NAFLD. En historia av kronisk alkoholanvändning är en viktig faktor.
NAFLD består av två histologiska kategorier: NAFL och den mer aggressiva formen NASH. Förekomsten av minst 5% fettlever är gemensam för både NAFL och NASH, men egenskaperna hos betydande lobulär inflammation och hepatocytskador som ballong eller Mallory hyaline förekommer bara i NASH. Majoriteten av NAFL -fallen visar minimal eller ingen inflammation. Pericentral och perisinusoidal fibros förekommer oftare vid NASH hos vuxna, medan portalfibros är vanligare hos barn med sjukdomen. NASH representerar ett mer avancerat stadium av NAFL och är associerat med dåliga resultat som kardiovaskulära händelser, cirros eller hepatocellulärt karcinom. ICD-11 använder inte termen NAFL eftersom det ansågs vara förvirrande med familjen av sjukdomar NAFLD. De föredragna beskrivningarna är istället: NAFLD utan NASH eller enkel steatos och "NASH". Modifieraren med eller utan fibros eller cirros kompletterar också diagnosbeskrivningen.
Blodprov
Förhöjda leverenzymer är vanliga. Enligt National Institute for Health and Care Excellence (NICE) riktlinjer är det avrådd att testa enzymenivåer för att utesluta NAFLD, eftersom de ofta ligger inom det normala intervallet även vid avancerad sjukdom.
Blodprov som är användbara för att bekräfta diagnosen eller utesluta andra inkluderar erytrocytsedimenteringshastighet , glukos , albumin och njurfunktion . Eftersom levern är viktig för att tillverka proteiner som används vid blodproppar , utförs ofta koagulationsrelaterade studier, särskilt INR ( internationellt normaliserat förhållande ). Hos personer med fet lever med associerad inflammatorisk skada (steatohepatit) används vanligtvis blodprov för att utesluta viral hepatit (hepatit A, B, C och herpesvirus som Epstein-Barr-virus eller cytomegalovirus ), röda hund och autoimmuna sjukdomar. Låg sköldkörtelaktivitet är vanligare hos personer med NASH, vilket skulle upptäckas genom att bestämma det sköldkörtelstimulerande hormonet . Vissa biomarkörbaserade blodprov har utvecklats och kan vara användbara för diagnos.
Även om blodprov inte kan diagnostisera NAFLD, kan cirkulerande serumbiomarkörer för leverfibros ge måttliga uppskattningar vid diagnos av leverfibros och cirros. Förhållandet av transaminas leverenzymet aspartataminotransferas (AST) till blodplättar i blodet, känd som AST / trombocyt-förhållandet index (APRI poäng), och Fibrotest rekommenderas som de föredragna icke-invasiva tester för cirros av den asiatiska-Pacific Association for Study av levern (APASL). Flera andra poäng som FIB-4-poäng och NAFLD-fibrospoäng kan också återspegla fibrosens börda i levern, och tidigare studier har bekräftat att dessa poäng kan förutsäga framtida utveckling av dödlighet och levercancer.
Imaging

En lever ultraljudsundersökning eller magnetisk resonansavbildning (MRI) kan diagnostisera steatos, men inte fibros och bekräftelse av tidig cirrosdetektering med ultraljud med andra diagnostiska metoder rekommenderas. Den europeiska anslutningen för studien av levern (EASL) rekommenderar screening för steatosis när misstänks NAFLD är eftersom detta är en stark prediktor för sjukdomsutvecklingen och förutspår framtiden typ 2-diabetes, kardiovaskulära händelser, och högt blodtryck . Dessa icke-invasiva metoder kan användas för NAFLD-screening men accepteras inte som ett substitut för leverbiopsi i NAFLD eller NASH-kliniska prövningar, eftersom endast en leverbiopsi kan definiera leverpatologi.
CT -skanningar och MRT är mer exakta vid upptäckt av cirros än konventionellt ultraljud. Övergående elastografi rekommenderas för den första bedömningen av leverfibros och cirros och hjälper till att förutsäga komplikationer och prognos, men tolkningen av resultaten vägs noggrant i närvaro av begränsande faktorer, såsom steatos, högt BMI, lägre grader av leverfibros och smal mellanrum mellan revbenen (interkostalrum). Emellertid kan övergående elastografi misslyckas för personer med pre-hepatisk portalhypertension . Övergående elastografi anses inte vara en ersättning för leverbiopsi.
Magnetisk resonanselastografi (MRE) är en framväxande metod som exakt kan bedöma leverfibros och rekommenderas av APASL. MRE har en bra känslighet för att kvantifiera leverfett och utmärkt noggrannhet för att upptäcka fibros i NAFLD oavsett BMI och inflammation och föreslås som ett mer pålitligt alternativ för att diagnostisera NAFLD och dess utveckling till NASH jämfört med ultraljud och blodprov.
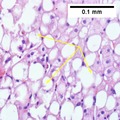
Leverbiopsi
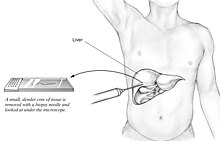

En leverbiopsi (vävnadsundersökning) är det enda allmänt accepterade testet (guldstandard) som definitivt diagnostiserar och skiljer NAFLD (inklusive NAFL och NASH) från andra former av leversjukdom och kan användas för att bedöma svårighetsgraden av inflammationen och resulterande fibros. Men eftersom de flesta som drabbats av NAFLD sannolikt kommer att vara asymptomatiska, utgör leverbiopsi en alltför hög risk för rutinmässig diagnos, så andra metoder är att föredra, till exempel lever -ultraljud eller lever -MR . För unga rekommenderar riktlinjer lever ultraljud, men biopsi är fortfarande det bästa beviset. Leverbiopsi är också guldstandarden för att upptäcka leverfibros och bedöma dess utveckling. Rutinmässiga leverfunktionsblodprov är inte tillräckligt känsliga för att upptäcka NAFLD, och biopsi är det enda förfarandet som på ett tillförlitligt sätt kan skilja NAFL från NASH.
Det finns flera leverbiopsitekniker tillgängliga för att få levervävnad. Perkutan leverbiopsi är fortfarande den vanligaste praxisen. Biopsier kan också utföras via den transvenösa vägen, antingen under operation eller laparoskopi , särskilt för personer med kontraindikationer mot ett perkutant tillvägagångssätt. Leverbiopsin kan också vara bildstyrd, i realtid eller inte, vilket rekommenderas för vissa kliniska situationer, till exempel personer med kända intrahepatiska skador, tidigare intra-abdominal kirurgi som kan ha vidhäftningar, en liten lever som är svår för att slå på, överviktiga människor och personer med tydliga ascites. Livstecken måste övervakas ofta efteråt (minst var 15: e minut i timmen efter biopsin).
Enligt AASLD -riktlinjer kan en leverbiopsi övervägas hos personer med NAFLD som löper ökad risk att få steatohepatit med eller utan avancerad fibros, men endast när alla andra konkurrerande kroniska leversjukdomar är uteslutna (t.ex. alkoholisk leversjukdom). Närvaron av metabolt syndrom, NAFLD Fibrosis Score (FIB-4) eller leverstelhet (mätt med vibrationskontrollerad transient elastografi eller MRE ) kan identifiera individer som löper högre risk för steatohepatit eller avancerad fibros.
AASLD och ICD-11 anser att kliniskt användbar patologirapportering skiljer "mellan NAFL (steatos), NAFL med inflammation och NASH (steatos med lobulär och portalinflammation och hepatocellulär ballong)" med närvaro eller frånvaro av fibros som beskrivs och eventuellt kommentera Allvarlighetsgrad. EASL rekommenderar algoritmen Fatty Liver Inhibition of Progression (FLIP) för att betygsätta ballongen och klassificera NAFLD-associerad leverskada och användningen av NAFLD Activity Score (NAS) för att betygsätta svårighetsgraden av NASH snarare än för dess diagnos. De anser också att steatos, aktivitet och fibros (SAF) är ett korrekt och reproducerbart poängsystem. AASLD rekommenderar användning av NAS -poängsystemet med eller utan SAF -poäng om det anses lämpligt. Asia-Pacific Working Group on NAFLD avvisar användningen av NAS, eftersom det anses vara informativt för NAFLD och olämpligt att diagnostisera NASH.
För bedömning av leverfibros är perkutan leverbiopsi, med eller utan bildguide, kontraindicerad hos icke -samarbetsvilliga personer. Transjugulär leverbiopsi är indicerad för alla personer med diffus leversjukdom som behöver en biopsi men har en kontraindikation mot perkutan biopsi eller behöver en hemodynamisk utvärdering för diagnostiska ändamål. En transvenös leverbiopsi rekommenderas istället för ett perkutant tillvägagångssätt hos personer med kliniskt tydliga ascites, även om perkutan biopsi är ett acceptabelt alternativt sätt efter borttagning av ascites.
Förvaltning
NAFLD garanterar behandling oavsett om den drabbade personen är överviktig eller inte. NAFLD är en dödsorsak som kan förebyggas . Riktlinjer finns tillgängliga från American Association for the Study of Liver Diseases (AASLD), American Association of Clinical Endocrinologists (AACE) National Institute for Health and Care Excellence (NICE), European Association for the Study of the Liver (EASL) och Asien-Stillahavsgruppen för NAFLD.
Livsstil
Viktminskning är den mest effektiva behandlingen för NAFLD. En förlust på 4% till 10% kroppsvikt rekommenderas, med 10% till 40% viktminskning som helt reverserar NASH utan cirros. Ett strukturerat viktminskningsprogram hjälper människor med NAFLD att gå ner i vikt jämfört med råd ensam. Denna typ av program leder också till förbättringar i NAFLD mätt med blodprov, ultraljud, avbildning eller leverbiopsier. Även om fibros förbättras med livsstilsinterventioner och viktminskning, finns det begränsade bevis för cirrosförbättring.
En kombination av förbättrad kost och träning, snarare än antingen ensam, verkar bäst hjälpa till att hantera NAFLD och minska insulinresistensen. Motivationsstöd, till exempel med kognitiv beteendeterapi , är till hjälp, eftersom de flesta med NAFLD inte uppfattar sitt tillstånd som en sjukdom och därmed har en låg motivation att förändras.
Beteendebaserade viktminskningsterapier med högre intensitet (kost och träning kombinerat) kan ge mer viktminskning än behandlingar med lägre intensitet. Viktminskning är förknippad med förbättringar av biomarkörer, NAFLD-kvalitet och minskade chanser att få NASH, men deras inverkan på långsiktig hälsa är ännu okänd. En systematisk granskning från 2019 föreslår således en ändring av riktlinjer för att rekommendera dessa behandlingar för NAFLD -hantering.
Diet
Behandling av NAFLD innebär vanligtvis rådgivning för att förbättra näring och kaloribegränsning . Personer med NAFLD kan dra nytta av en måttlig till lågkolhydratkost och en fettsnål kost. Medelhavsdieten visade också lovande resultat i en 6-veckors studie med en minskning av NASH-inducerad inflammation och fibros, oberoende av viktminskning. Preliminära bevis stöder kostinterventioner hos personer med fet lever som inte är överviktiga.
EASL rekommenderar energibegränsning på 500–1000 kcal per vecka mindre än den normala dagliga kosten (en mycket kalorifattig diet ), ett mål på 7–10% viktminskning för överviktiga/överviktiga NAFLD, en låg till måttlig fett , och måttlig till högkolhydratkost, eller en lågkolhydratisk ketogen eller högproteinrik diet, såsom medelhavskosten, och undvika alla drycker och livsmedel som innehåller fruktos.
Alkohol är en försvårande faktor, och AASLD rekommenderar att personer med NAFLD eller NASH undviker alkoholkonsumtion. EASL tillåter alkoholkonsumtion under 30g/dag för män och 20g/dag för kvinnor. Den roll som kaffekonsumtion för NAFLD behandling är oklart om vissa studier tyder på att regelbunden kaffekonsumtion kan ha skyddande effekter.
E -vitamin förbättrar inte etablerad leverfibros hos personer med NAFLD men verkar förbättra vissa markörer för leverfunktion och minskar inflammation och fethet i levern hos vissa personer med NAFLD. Asia-Pacific Work Group rekommenderar att E-vitamin kan förbättra levers tillstånd och aminotransferasnivåer, men bara hos vuxna utan diabetes eller cirros som har NASH. NICE -riktlinjerna rekommenderar E -vitamin som ett alternativ för barn och vuxna med NAFLD med avancerad leverfibros, oavsett om personen har diabetes mellitus.
Växtbaserade föreningar som silymarin (ett extrakt av mjölktistel ), curcumin, ett gurkmejaxtrakt och grönt te verkar förbättra NAFLD -biomarkörer och minska NAFLD -graden. Studier tyder på en koppling mellan mikroskopiska organismer som bor i tarmen (mikrobiota) och NAFLD. Recensioner rapporterade användningen av probiotika och synbiotika (kombinationer av probiotika och prebiotika ) var associerade med förbättring av leverspecifika markörer för leverinflammation, mätningar av leverstelhet och steatos hos personer med NAFLD.
Fysisk aktivitet
Viktminskning kan förbättra NAFLD och rekommenderas särskilt för överviktiga eller överviktiga; liknande fysiska aktiviteter och dieter rekommenderas för överviktiga personer med NAFLD som för andra överviktiga och överviktiga. Även om fysisk aktivitet är mindre viktigt för viktminskning än kostanpassningar (för att minska kaloriintaget), rekommenderar NICE fysisk aktivitet att minska leverfett även om det inte finns någon total kroppsviktminskning. Viktminskning, genom träning eller kost, är det mest effektiva sättet att minska leverfett och hjälpa NASH och fibros remission. Träning ensam kan förhindra eller minska leverstatos, men det är fortfarande okänt om det kan förbättra alla andra aspekter av levern; därför rekommenderas ett kombinerat tillvägagångssätt med kost och träning. Aerob träning kan vara mer effektiv än motståndsträning, även om det finns motstridiga resultat. Kraftig träning är att föredra framför måttlig träning, eftersom endast högintensiv träning minskar risken för att NAFLD utvecklas till NASH eller avancerad fibros. EASL rekommenderar mellan 150 och 200 minuter/vecka i 3 till 5 sessioner med måttlig intensitet aerob fysisk aktivitet eller motståndsträning. Eftersom båda effektivt reducerar leverfett, föredras ett pragmatiskt förhållningssätt till valet av fysisk aktivitet som står för individens preferenser för vad de kan behålla på lång sikt. Varje engagemang i fysisk aktivitet eller ökning jämfört med tidigare nivåer är bättre än att vara stillasittande.
Medicin
Behandling med mediciner syftar främst till att förbättra leversjukdom och är i allmänhet begränsad till dem med biopsi-bevisad NASH och fibros.
Inga läkemedel specifikt för NAFLD eller NASH hade fått godkännande från och med 2018, även om mediciner mot diabetes kan hjälpa till med fettförlust. Även om många behandlingar verkar förbättra biokemiska markörer som alanintransaminasnivåer , vänder de flesta inte histologiska avvikelser eller förbättrar resultaten.
Insulinsensibilisatorer ( metformin och tiazolidindioner , såsom pioglitazon ) och liraglutid rekommenderas inte specifikt för NAFLD eftersom de inte direkt förbättrar levers tillstånd. De kan indikeras för diabetiker efter en noggrann riskbedömning för att minska insulinresistens och risker för komplikationer. De biverkningar som är förknippade med tiazolidindionmedicin, som inkluderar osteopeni , ökad frakturerisk, vätskeretention, hjärtsvikt , blåscancer och långsiktig viktökning, har begränsat deras antagande. På grund av dessa biverkningar rekommenderar AASLD användningen av pioglitazon endast för personer med biopsi-bevisad NASH, och Asia-Pacific Work Group rekommenderar dem endast för personer med NAFLD med kända diabetesproblem. AASLD avråder dock från användning av metformin, eftersom studier inte var avgörande om förbättringen av leverens histologiska tillstånd. Även om det skedde en förbättring av insulinresistens och serumaminotransferaser, ledde detta inte till NASH -förbättringar. NICE ger liknande riktlinjer till AASLD angående pioglitazon och rekommenderar att det ges i sekundärvård till vuxna med avancerad leverfibros oavsett om de har diabetes eller inte.
Statinläkemedel verkar förbättra leverhistologi och markörer för leverbiokemi hos personer med NAFLD. Eftersom personer med NAFLD löper högre risk för hjärt -kärlsjukdom, är statinbehandling indikerad. Personer med NAFLD löper inte högre risk för allvarlig leverskada från statiner, enligt AASLD och EASL. Men även om statiner är säkra att använda hos personer med NASH -cirros, föreslår AASLD att man undviker dem hos personer med dekompenserad cirros. Riktlinjer rekommenderar statiner för att behandla dyslipidemi för personer med NAFLD. Enligt NICE -riktlinjer kan statiner fortsätta om inte leverenzymnivåerna fördubblas inom tre månader efter att statiner startats. Behandling med pentoxifyllin rekommenderas inte.
Från och med 2018 rekommenderar varken AASLD eller Asia-Pacific Working Group obetikolsyra eller elafibranor på grund av inkonsekventa resultat för NASH-behandling och oro för säkerheten.
Omega-3 fettsyror kan minska leverfett och förbättra lipidprofilen i blodet men verkar inte förbättra leverhistologin (fibros, cirros, cancer). NICE rekommenderar inte omega-3-fettsyratillskott eftersom randomiserade studier inte var avgörande. Tidigare systematiska granskningar visade att omega-3-fettsyratillskott hos dem med NAFLD/NASH som använder doser på ett gram dagligen eller mer (median dos fyra gram/dag med median behandlingstid sex månader) har associerats med förbättringar av leverfett. Enligt AASLD-riktlinjer ska "omega-3-fettsyror inte användas som en specifik behandling av NAFLD eller NASH, men de kan övervägas att behandla hypertriglyceridemi för patienter med NAFLD".
Kirurgi

Bariatrisk kirurgi är en effektiv metod för överviktiga och diabetiker med NAFLD för att inducera viktminskning och minska eller lösa NASH -inflammation, inklusive fibros, och förbättra livslängden. För AASLD kan bariatrisk kirurgi endast övervägas för NASH från fall till fall av ett erfaren bariatrisk kirurgiprogram. Vissa individer kan faktiskt utveckla nya eller förvärrade funktioner i NAFLD.
Omkring 92% av personer med NAFLD såg en förbättring av steatos och 70% av en fullständig upplösning efter bariatrisk kirurgi.
En kost före operationen, till exempel en kalorifattig diet eller en mycket kalorifattig diet, brukar rekommenderas för att minska levervolymen med 16–20%. Viktminskning före operation är den enda faktorn som är associerad med postoperativ viktminskning. Viktminskning före operationen kan minska den operativa tiden och sjukhusvistelsen, även om det inte finns tillräckligt med bevis på om viktminskning före operation minskar långvarig sjuklighet eller komplikationer. Viktminskning och minskning av leverstorleken kan vara oberoende av kaloribegränsningen.
APWG på NAFLD rekommenderar bariatrisk kirurgi som ett behandlingsalternativ för personer med fetma i klass II ( BMI > 32,5 kg/m 2 för asiater, 35 kg/m 2 för kaukasier). De anser att dess effekter på att förbättra leverrelaterade komplikationer ännu inte är bevisade, men det ökar effektivt livslängden genom att förbättra kardiovaskulära faktorer.
Kirurgi innebär större risker för personer med NASH -cirros, med en översyn som uppskattar den totala sjukligheten till 21%. För personer med NAFLD som har odifferentierad cirros, rekommenderar APWG en undersökning för att fastställa orsaken till cirros såväl som personens leverfunktion och om de har portalhypertoni.
Undersökning
Screening av kardiovaskulärt system anses vara obligatoriskt av EASL, eftersom NAFLD-resultat ofta resulterar i kardiovaskulära komplikationer , vilket kan manifestera sig som subklinisk ateroskleros , orsaken till majoriteten av NAFLD-relaterade dödsfall. Personer med NAFLD löper stor risk för kardiovaskulär morbiditet och dödlighet, och "aggressiv modifiering av riskfaktorer för kardiovaskulär sjukdom är motiverad hos alla patienter med NAFLD", enligt AASLD.
AASLD rekommenderar vidare för personer med cirrotisk NASH att systematiskt screenas för gastriska och esofageala varicer och levercancer . De rekommenderar inte rutinmässiga leverbiopsier och screening för levercancer för icke-cirrotiska personer med NASH, men sådan screening sker ibland från fall till fall.
Personer med NAFLD kan också övervägas för screening för hepatocellulärt karcinom (levercancer) och gastroesofageal varicer. NICE rekommenderar regelbunden screening av NAFLD för avancerad leverfibros vart tredje år till vuxna och vartannat år för barn som använder det förbättrade leverfibros (ELF) blodprovet. Uppföljning rekommenderas för personer med fetma och insulinresistens med hjälp av homeostasmodellbedömningen av insulinresistens (HOMA-IR). Personer med NASH med fibros och högt blodtryck förtjänar noggrannare övervakning eftersom det finns en högre risk för sjukdomsprogression.
Transplantation
NAFLD är den näst vanligaste indikationen för levertransplantation i USA och Europa från och med 2017. NAFLD/NASH förväntas bli den främsta orsaken till levertransplantation år 2020.
För personer med NASH och leversjukdom i slutstadiet, leversvikt eller levercancer är levertransplantation ett accepterat förfarande enligt EASL. Personer med NASH -cirros NASH som övervägs för levertransplantation motiverar systematisk utvärdering av hjärt -kärlsjukdomar (oavsett om symtomen är uppenbara eller inte).
Den övergripande överlevnaden är jämförbar med transplantation efter andra sjukdomar. Personer med NASH-cirros som genomgår levertransplantation är mer benägna att dö efter transplantationen på grund av hjärt-kärlsjukdom eller kronisk njursjukdom . Dessa människor med NASH är ofta äldre och är därför mer benägna att dessa komplikationer. Av dessa skäl och andra kan personer med sjuklig fetma ( BMI ≥ 40 kg/m 2 ) och NASH med cirros anses olämpliga för levertransplantation tills de följer livsstilsförändringar för att minska kroppsvikten. Diabetiker med dålig glykemisk kontroll löper liknande risker, och optimal glykemisk kontroll är avgörande innan transplantation.
Arbetsgruppens riktlinjer för Asien och Stillahavsområdet rekommenderar vårdgivare att diskutera livsstilsförändringar före och efter transplantation för att minska potentiella kirurgirisker och för att hjälpa till med NAFLD -hantering efter transplantationen.
Samtidig bariatrisk kirurgi och levertransplantation utfördes under exceptionella omständigheter.
Efter transplantation är leverbiopsi den bästa metoden för att övervaka utvecklingen av fibros efter transplantation, med signifikant fibros eller portalhypertension ett år efter transplantation som förutsäger snabb progression och transplantatförlust och indikerar behovet av akut ingripande.
Relaterade komplikationer
Det finns ingen särskild behandling för levercancer i samband med NAFLD/NASH och behandlas enligt allmänna riktlinjer för levercancer.
Prognos
Den genomsnittliga progressionshastigheten från ett stadium av leverfibros till nästa hos människor med NASH uppskattas vara sju år, jämfört med 14 år med NAFLD. Progressionsförloppet varierar med olika kliniska manifestationer hos individer. Fibros hos människor med NASH utvecklades snabbare än hos människor med NAFLD. Fetma förutsäger ett sämre långsiktigt resultat än för magra individer. I Asien-Stillahavsområdet utvecklas cirka 25% av NAFLD-fallen till NASH under tre år, men endast en låg andel (3,7%) utvecklar avancerad leverfibros. En internationell studie visade att personer med NAFLD hade en 10-årig överlevnad på 81,5%.
NAFLD är en riskfaktor för fibros, högt blodtryck, kronisk njursjukdom, förmaksflimmer , hjärtinfarkt, ischemisk stroke och död av kardiovaskulära orsaker baserat på mycket låga till lågkvalitativa bevis från observationsstudier. Även om NAFLD kan orsaka cirros och leversvikt och levercancer, är de flesta dödsfall bland personer med NAFLD hänförliga till hjärt -kärlsjukdom. Enligt en metaanalys av 34 000 personer med NAFLD under sju år har dessa individer en 65% ökad risk att utveckla dödliga eller icke-dödliga kardiovaskulära händelser jämfört med dem utan NAFLD.
NAFLD och NASH ökar risken för levercancer. Skrumplever och levercancer inducerad av NAFLD var den andra orsaken till levertransplantation i USA 2017. Levercancer utvecklas i NASH i frånvaro av cirros i 45% i fallen, och personer med NASH -cirros har ökad risk för levercancer. Levercancer i samband med NASH ökade fyra gånger mellan 2002 och 2012 i USA, vilket är mer än någon annan orsak till levercancer. NAFLD utgör den tredje vanligaste riskfaktorn för levercancer. NAFLD och NASH visade sig förvärras med cirros hos 2–3% respektive 15–20% av människorna under en 10–20 års period. Skrumplever finns bara hos cirka 50% av personer med NAFLD och levercancer, så att levercancer och cirros inte alltid är kopplade.
NAFLD kan vara en föregångare till metaboliskt syndrom, även om en dubbelriktad påverkan är möjlig. Förekomst och stadium av fibros är de starkaste prognostiska faktorerna för leverrelaterade händelser och dödlighet, särskilt för NAFLD.
Epidemiologi
NAFLD -incidensen ökar snabbt, tillsammans med fetma och diabetes, och har blivit den vanligaste orsaken till leversjukdom i utvecklade länder, för vuxna, tonåringar och barn. Andelen människor med NAFLD varierar från 9 till 36,9% i olika delar av världen. Cirka 20% av USA och 25% av befolkningen i Asien-Stillahavsområdet har alkoholfri fettlever. Liknande förekomst kan hittas i Europa, även om mindre data finns tillgänglig. NAFLD är det vanligaste i Mellanöstern (32%) och Sydamerika (30%), medan Afrika har de lägsta priserna (13%). Jämfört med 2000-talet ökade NAFL respektive NASH 2-faldigt respektive 2,5-faldigt under 2010-talet i USA.
NAFLD och NASH är vanligare i latinamerikaner - vilket kan hänföras till höga fetma och typ 2 -diabetes i latinamerikanska befolkningar, mellan i vita och lägst i svarta. NAFLD observerades vara dubbelt så vanligt hos män som kvinnor. För personer med svår fetma ökar prevalensen av NAFLD med över 90%och för personer med diabetes över 60%och upp till 20%för personer med normal vikt. NAFLD finns hos 65% till 90% av personer som hade bariatrisk kirurgi, och upp till 75% av dem har NASH. Ultraljuds- och proton -NMR -spektroskopistudier tyder på att cirka 25% av befolkningen verkar påverkas av NAFLD eller NASH.
Även om sjukdomen ofta är förknippad med fetma, är en betydande andel av de drabbade normalviktiga eller mager. Mager NAFLD drabbar mellan 10 och 20% av amerikanerna och européerna och cirka 25% av asiaterna, även om vissa länder har en högre förekomst (t.ex. har Indien en mycket hög andel magert NAFLD och nästan ingen fet NAFLD). PNPLA3 kan vara relevant för utvecklingen av NAFLD hos magra människor. Således förtjänar människor som lider av NAFLD behandling för behandling oavsett förekomst eller frånvaro av fetma.
Hos barn i åldrarna 1 till 19 befanns prevalensen vara cirka 8% i den allmänna befolkningen upp till 34% i studier med data från barnfetma kliniker.
Majoriteten av kryptogen cirros tros bero på NASH. NAFLD -prevalens förväntas öka stadigt, från 25% år 2018 till uppskattningsvis 33,5% av människor med NAFLD globalt 2030, och från 20% till beräknade 27% av dem med NAFLD kommer att gå vidare till NASH.
Historia
Det första erkända fallet av fetma-relaterad alkoholfri fettlever observerades 1952 av Samuel Zelman. Zelman började undersöka efter att ha observerat en fet lever på en sjukhusanställd som drack mer än tjugo flaskor Coca-Cola om dagen. Han fortsatte sedan med att utforma en rättegång i ett och ett halvt år på 20 överviktiga personer som inte var alkoholiserade och fann att ungefär hälften av dem hade väsentligen fet lever. Fettlever var dock kopplad till diabetes sedan minst 1784 - en observation togs upp igen på 1930 -talet. Studier på försöksdjur innebar kolinbrist på 1920 -talet och överdriven sockerkonsumtion 1949.
Namnet "alkoholfri steatohepatit" (NASH) definierades senare 1980 av Jurgen Ludwig och hans kollegor från Mayo Clinic för att öka medvetenheten om förekomsten av denna patologi, eftersom liknande rapporter tidigare avfärdades som "patienters lögner". Det här dokumentet ignorerades mestadels vid den tiden men kom så småningom att ses som ett landmärke, och från mitten av 1990-talet började tillståndet studeras intensivt, med en rad internationella möten som hölls om ämnet sedan 1998. bredare NAFLD -term började användas runt 2002. Diagnostiska kriterier började utarbetas och 2005 föreslog patologikommittén för NIH NASH Clinical Research Network NAS -poängsystemet.
Samhälle och kultur
Politiska rekommendationer
EASL rekommenderar Europas folkhälsomyndigheter att "begränsa reklam och marknadsföring av sockersötade drycker och industriellt bearbetade livsmedel med mycket mättat fett, socker och salt", samt "skatteåtgärder för att avskräcka konsumtion av sockersötade drycker och lagstiftning till se till att livsmedelsindustrin förbättrar märkningen och sammansättningen av bearbetade livsmedel ", liksom" allmänhetens medvetenhetskampanjer om leversjukdomar, vilket betonar att det inte bara är kopplat till överdriven alkoholkonsumtion ".
Lobbying
I Frankrike fördömdes det franska syndikatet för alkoholfria drycker "Boissons Rafraîchissantes de France" (som inkluderade läskproducenter som Coca-Cola France, Orangina, PepsiCo France) av den franska tidskriften fr: Canard Enchainé för att vilseleda konsumenter med en kommunikation på deras webbplats med titeln "Bättre förståelse för NASH-patologin", som förklarar att "NASH-patologi ibland kallas läsksjukan genom språkmissbruk eller en olycklig semantisk genväg, eftersom den inte är direkt kopplad till konsumtion av alkoholfria drycker". Denna sida och andra på samma webbplats, till exempel en med titeln "Säg nej till desinformation", har sedan tagits bort.
Barn
Pediatrisk NAFLD rapporterades första gången 1983. Det är den vanligaste kroniska leversjukdomen bland barn och ungdomar sedan minst 2007 och drabbar 10 till 20% av dem i USA 2016. NAFLD är associerat med metabolt syndrom , som är en grupp av riskfaktorer som bidrar till utvecklingen av hjärt -kärlsjukdomar och typ 2 -diabetes. Studier har visat att fetma i buken och insulinresistens i synnerhet är viktiga bidragande faktorer till utvecklingen av NAFLD. Samexisterande leversjukdomar, såsom hepatit C och hjärt -kärlsjukdomar som åderförkalkning, är också förknippade med en ökad risk för NAFLD. Vissa barn diagnostiserades redan vid två års ålder, med en genomsnittlig diagnosålder mellan 11 och 13 år. Medelåldern är vanligtvis över 10 år, eftersom barn också kan rapportera ospecifika symptom och därmed är svåra att diagnostisera för NAFLD.
Pojkar är mer benägna att få diagnosen NAFLD än flickor. Övervikt, eller till och med viktökning, i barndomen och tonåren, är förknippad med en ökad risk för NAFLD senare i livet, med vuxen NAFLD förutspådd i en 31-årig uppföljningsstudie av riskfaktorer under barndomen inklusive BMI, plasmainsulinnivåer, manliga kön, genetisk bakgrund (PNPLA3- och TM6SF2 -varianter) och låg födelsevikt, en framväxande riskfaktor för vuxenlivet NAFLD. I en studie fanns enkel steatos hos upp till 45% hos barn med klinisk misstanke om NAFLD. Barn med enkel steatos har en sämre prognos än vuxna, med betydligt fler av dem som går från NAFLD till NASH jämfört med vuxna. Faktum är att 17-25% av barnen med NAFLD utvecklar en NASH i allmänhet och upp till 83% för barn med svår fetma (mot 29% för vuxna), vilket ytterligare tyder på att hepatisk fibros verkar följa en mer aggressiv klinisk kurs hos barn jämfört till vuxna.
Tidig diagnos av NAFLD hos barn kan hjälpa till att förhindra utvecklingen av leversjukdom under vuxen ålder. Detta är utmanande eftersom de flesta barn med NAFLD är asymptomatiska, med endast 42-59% som uppvisar buksmärtor. Andra symtom kan vara närvarande, såsom höger övre kvadrant smärta eller acanthosis nigricans , varav den senare ofta förekommer hos barn med NASH. En förstorad lever förekommer hos 30-40% av barnen med NAFLD.
AASLD rekommenderar en diagnostisk leverbiopsi hos barn när diagnosen är oklar eller innan en potentiellt hepatotoxisk medicinsk behandling påbörjas. EASL föreslår att man använder fibros tester som elastografi , akustisk strålningskraftsimpulsavbildning och serumbiomarkörer för att minska antalet biopsier. I uppföljningen rekommenderar NICE riktlinjer att vårdgivare erbjuder barn regelbunden NAFLD -screening för avancerad leverfibros vartannat år med hjälp av det förbättrade leverfibros (ELF) blodprovet. Flera studier tyder också på magnetresonanselastografi som ett alternativ till den mindre tillförlitliga ultraljudet.
Intensiva livsstilsförändringar, inklusive fysisk aktivitet och kostförändringar, är den första behandlingslinjen enligt AASLD och EASL eftersom det förbättrar leverhistologin och aminotransferasnivåerna. När det gäller farmakologisk behandling rekommenderar AASLD och EASL inte metformin, men E -vitamin kan förbättra leverhälsan för vissa barn. NICE rekommenderar användning av E -vitamin för barn med avancerad leverfibros, oavsett om de har diabetes eller inte. Den enda behandlingen som visat sig vara effektiv i barndomen NAFLD är viktminskning.
Vissa bevis tyder på att moderns undernäring eller övernäring ökar ett barns mottaglighet för NASH och påskyndar dess utveckling.
Forskning
Diagnos och biomarkörer
Eftersom en NAFLD -diagnos baserad på en leverbiopsi är invasiv och gör det svårt att uppskatta epidemiologi är det hög forskningsprioritet att hitta exakta, billiga och icke -invasiva metoder för att diagnostisera och övervaka NAFLD -sjukdom och dess progression. Sökandet efter dessa biomarkörer för NAFLD, NAFL och NASH involverar lipidomik , medicinsk bildbehandling , proteomik , blodprov och poängsystem.
Enligt en granskning kan uppskattning av fettfraktioner av protondensitet genom magnetisk resonansavbildning (MRI-PDFF) anses vara det mest exakta och jämna guldstandardtestet för att kvantifiera hepatisk steatos. De rekommenderar ultraljudsbaserad övergående elastografi för att exakt diagnostisera både fibros och cirros i en rutinmässig klinisk miljö, med mer objektivitet än ultraljud men med lägre noggrannhet än magnetresonanselastografi; och plasmacytokeratin 18 (CK18) fragmentnivåer för att vara en måttligt noggrann biomarkör för steatohepatit. Emellertid kan övergående elastografi misslyckas för personer med pre-hepatisk portalhypertension.
Läkemedelsutveckling
Läkemedelsutveckling för NASH är mycket aktiv och går snabbt framåt. Nya läkemedel är utformade för att målsöka olika intrahepatiska platser, från att reglera lipider och glukoshomeostas till oxidant stress och mitokondriella mål i hepatocyter, inflammatoriska signaler på hepatocyter, och intracellulära mål relaterade till leverstellate cell aktivering och fibrogenes. Från och med 2021 pågår avgörande försök med obeticholsyra ( FXR- agonist), Resmetirom ( THRβ- agonist), belapektin ( Galectin-3- hämmare) och Aramchol ( SCD1- hämmare).
Se även
- Foie gras , fettlever inducerad hos fjäderfä, med patofysiologi homolog med NAFLD hos människor
Referenser
externa länkar
- NIH- sida om alkoholfri steatohepatit
- Mayo Clinic -sida på NAFLD
| Klassificering | |
|---|---|
| Externa resurser |