Diffus panbronchiolitis - Diffuse panbronchiolitis
| Diffus panbronchiolitis | |
|---|---|
 | |
| Högupplösta datortomografibilder av nedre bröstkorgen hos en 16-årig pojke med diffus panbronchiolitis | |
| Specialitet | Pulmonologi |
Diffus panbronchiolitis ( DPB ) är en inflammatorisk lungsjukdom av okänd orsak. Det är en allvarlig, progressiv form av bronkiolit , ett inflammatoriskt tillstånd i bronkiolerna (små luftpassager i lungorna). Termen diffus betyder att lesioner uppträder i båda lungorna, medan panbronchiolitis avser inflammation som finns i alla lager i andningsbronkiolerna (de som är involverade i gasutbyte ). DPB orsakar allvarlig inflammation och knölliknande lesioner av terminala bronkioler , kronisk bihåleinflammation och intensiv hosta med stora mängder sputumproduktion .
Man tror att sjukdomen inträffar när det finns känslighet eller brist på immunsystemsresistens mot DPB-orsakande bakterier eller virus orsakade av flera gener som huvudsakligen finns hos individer av östasiatisk härkomst. Den högsta förekomsten förekommer bland japanerna , följt av koreaner . DPB förekommer oftare hos män och börjar vanligtvis runt 40 års ålder. Det erkändes som en distinkt ny sjukdom i början av 1960-talet och namngavs formellt diffus panbronchiolitis 1969.
Om den lämnas obehandlad, fortsätter DPB till bronkiektas , ett irreversibelt lungsjukdom som involverar förstoring av bronkiolerna och poolning av slem i bronkiola passager. Daglig behandling av DPB med makrolida antibiotika såsom erytromycin lindrar symptom och ökar överlevnadstiden, men sjukdomen har för närvarande inget känt botemedel. Det slutliga resultatet av DPB kan vara andningssvikt och hjärtproblem.
Klassificering
Uttrycket "bronkiolit" hänför sig i allmänhet till inflammation i bronkiolerna. DPB klassificeras som en form av "primär bronkiolit", vilket innebär att den bakomliggande orsaken till bronkiolit härstammar från eller är begränsad till bronkiolerna. Tillsammans med DPB inkluderar ytterligare former av primär bronkiolit bronchiolitis obliterans , follikulär bronkiolit, respiratorisk bronkiolit , mineral damm luftvägssjukdom och ett antal andra. Till skillnad från DPB skulle bronkiolit som inte anses vara "primär" associeras med sjukdomar i de större luftvägarna, såsom kronisk bronkit .
tecken och symtom
Symtom på DPB inkluderar kronisk bihåleinflammation (inflammerad paranasal bihålor ), väsande andning, krakningar ( andningsljud från hinder som slem och utsöndringar i lungorna), dyspné (andfåddhet) och svår hosta som ger stora mängder sputum (hostad -upp slem). Det kan finnas pus i sputum, och drabbade individer kan ha feber. Typiska tecken på DPB-progression inkluderar utvidgning (utvidgning) av bronkiola passager och hypoxemi (låga nivåer av syre i blodet). Om DPB lämnas obehandlat kommer bronkiektas att inträffa; det kännetecknas av utvidgning och förtjockning av bronkiolernas väggar, inflammatorisk skada på luftvägs- och terminalbronkioler och sammanslagning av slem i lungorna. DPB är associerat med progressiv andningssvikt , hyperkapnia (ökade nivåer av koldioxid i blodet) och kan så småningom leda till pulmonell hypertension (högt blodtryck i lungvenen och artären ) och cor pulmonale (utvidgning av hjärtans högra kammare eller "höger hjärtsvikt").
Orsak
DPB är idiopatisk , vilket betyder att en exakt fysiologisk , miljömässig eller patogen orsak till sjukdomen är okänd. Flera faktorer misstänks emellertid vara inblandade i dess patogenes (hur sjukdomen fungerar).
Det stora histokompatibilitetskomplexet (MHC) är en stor genomregion som finns i de flesta ryggradsdjur som är associerad med immunsystemet. Det ligger på kromosom 6 hos människor. En delmängd av MHC hos människor är human leukocytantigen (HLA), som kontrollerar det antigenpresenterande systemet , som en del av adaptiv immunitet mot patogener såsom bakterier och virus . När mänskliga celler infekteras av en patogen kan vissa av dem presentera delar av patogenens proteiner på deras ytor; detta kallas "antigenpresentation". De infekterade cellerna blir sedan mål för typer av cytotoxiska T-celler , som dödar de infekterade cellerna så att de kan tas bort från kroppen.
Genetisk predisposition för DPB-känslighet har lokaliserats till två HLA- haplotyper (en nukleotid- eller gensekvensskillnad mellan parade kromosomer , som är mer benägna att förekomma bland en vanlig etnicitet eller egenskap) som är vanliga för människor av östasiatisk härkomst. HLA-B54 är associerad med DPB på japanska, medan HLA-A11 är associerad med sjukdomen i koreaner. Flera gener inom denna region av klass I HLA antas vara ansvariga för DPB genom att tillåta ökad känslighet för sjukdomen. Den vanliga genetiska bakgrunden och likheter i HLA-profilen hos drabbade japanska och koreanska individer ansågs i sökandet efter en DPB-gen. Det föreslogs att en mutation av en misstänkt sjukdomskänslighetsgen lokaliserad någonstans mellan HLA-B och HLA-A hade inträffat på en förfäderlig kromosom som bar både HLA-B54 och HLA-A11. Vidare är det möjligt att ett antal genetisk rekombination händelser runt sjukdomen locus (plats på en kromosom) kunde ha resulterat i sjukdom som förknippas med HLA-B54 i den japanska och HLA-A11 i koreaner. Efter ytterligare studier drogs slutsatsen att en DPB-känslighetsgen är belägen nära HLA-B-locus vid kromosom 6p21.3. Inom detta område har sökandet efter en genetisk orsak till sjukdomen fortsatt.
Eftersom många gener som tillhör HLA förblir oidentifierade har positionskloning (en metod som används för att identifiera en specifik gen, när endast dess plats på en kromosom är känd) använts för att bestämma att en mucinlik gen är associerad med DPB. Dessutom har sjukdomar orsakade av identifierade HLA-gener i DPB-känslighetsregionen undersökts. Ett av dessa, bare lymfocytsyndrom I (BLS I), uppvisar ett antal likheter med DPB hos de drabbade, inklusive kronisk bihåleinflammation, bronkiolarinflammation och knölar och närvaron av H. influenzae . Liksom DPB reagerar BLS I positivt på erytromycinbehandling genom att visa en upplösning av symtom. Likheterna mellan dessa två sjukdomar, motsvarande framgång med samma behandlingssätt och det faktum att genen som är ansvarig för BLS I är lokaliserad inom det DPB-orsakande området av HLA, begränsar etableringen av en gen som är ansvarig för DPB. Miljöfaktorer som inandning av giftiga ångor och cigarettrökning antas inte spela någon roll i DPB, och okända miljö- och andra icke-genetiska orsaker - såsom oidentifierade bakterier eller virus - har inte uteslutits.
Cystisk fibros (CF), en progressiv multi-system lungsjukdom, har övervägs i sökandet efter en genetisk orsak till DPB. Detta beror på ett antal skäl. CF, som DPB, orsakar allvarlig lunginflammation, riklig slemproduktion, infektion och visar en genetisk övervägande bland kaukasier i en geografisk grupp till sällsynthet hos andra; medan DPB dominerar bland östra asiater, påverkar CF främst individer av europeisk härkomst. Medan ingen gen har varit inblandad som orsak till DPB, orsakar mutation i en specifik gen - mycket mer sannolikt att förekomma hos européer - CF. Denna mutation i den CF-orsakande genen är inte en faktor i DPB, men en unik polymorfism (variation) i denna gen är känd för att förekomma hos många asiater som inte nödvändigtvis påverkas av någon av sjukdomarna. Det undersöks om denna gen i något mutationstillstånd kan bidra till DPB.
Patofysiologi
Inflammation är en normal del av det humana immunsvaret, där leukocyter (vita blodkroppar), inklusive neutrofiler (vita blodkroppar som specialiserar sig på att orsaka inflammation), samlas och kemokiner (proteiner som frigörs från vissa celler, som aktiverar eller framkallar ett svar från andra celler) ackumuleras var som helst i kroppen där bakterie- eller virusinfektioner uppträder. Inflammation stör aktiviteten hos bakterier och virus och tjänar till att rensa dem från kroppen. I DPB kan bakterier som Haemophilus influenzae och Pseudomonas aeruginosa orsaka spridning av inflammatoriska celler i bronkiola vävnader. Men när ingen av bakterierna är närvarande med DPB fortsätter inflammationen av en ännu okänd anledning. I båda fallen kan inflammation i DPB vara så allvarlig att knölar som innehåller inflammatoriska celler bildas i bronkiolerna. Förekomsten av inflammation och infektion i luftvägarna resulterar också i produktion av överflödigt slem, som måste hostas upp som sputum. Kombinationen av inflammation, nodulutveckling, infektion, slem och frekvent hosta bidrar till andningssvårigheterna i DPB.
Det faktum att inflammation i DPB kvarstår med eller utan närvaron av P. aeruginosa och H. influenzae ger ett sätt att bestämma flera mekanismer för DPB-patogenes. Leukotriener är eikosanoider , signalmolekyler gjorda av essentiella fettsyror , som spelar en roll i många lungsjukdomar genom att orsaka spridning av inflammatoriska celler och överflödig slemproduktion i luftvägarna. I DPB och andra lungsjukdomar är den dominerande medlaren för neutrofilrelaterad inflammation leukotrien B4 , som specialiserar sig på neutrofilproliferation via kemotaxi (rörelse av vissa typer av celler mot eller bort från vissa molekyler).
Inflammation i DPB orsakas också av kemokinet MIP-1alpha och dess involvering med CD8 + T-celler . Betadefensiner , en familj av antimikrobiella peptider som finns i luftvägarna, är ansvariga för ytterligare inflammation i DPB när en patogen såsom P. aeruginosa är närvarande. Om det finns DPB, modifierar det humana T-lymfotropa viruset, typ I , ett retrovirus , DPB-patogenesen genom att infektera T-hjälparceller och ändra deras effektivitet när det gäller att känna igen närvaron av kända eller okända patogener som är involverade i DPB.
Diagnos
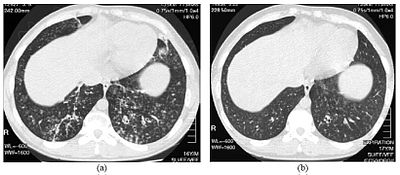
Diagnosen av DPB kräver analys av lungorna och bronkiola vävnader, vilket kan kräva en lungbiopsi , eller den mer föredragna högupplösta datortomografin (HRCT) av lungorna. De diagnostiska kriterierna inkluderar allvarlig inflammation i alla skikt i andningsbronkiolerna och lungvävnadsskador som uppträder som knölar i terminalen och andningsbronkioler i båda lungorna. Knölarna i DPB verkar som ogenomskinliga klumpar när de ses på röntgenstrålar i lungan och kan orsaka luftvägsobstruktion , vilket utvärderas av ett lungfunktionstest eller PFT. Lung-röntgenstrålar kan också avslöja utvidgning av bronchiolar passager, ett annat tecken på DPB. HRCT-skanningar visar ofta blockeringar av vissa bronkiola passager med slem, vilket kallas "träd-i-knopp" -mönstret. Hypoxemi, ett annat tecken på andningssvårigheter, avslöjas genom att mäta syre- och koldioxidhalten i blodet med hjälp av ett blodprov som kallas arteriell blodgas . Andra fynd som observerats med DPB inkluderar proliferationen av lymfocyter ( vita blodkroppar som bekämpar infektioner), neutrofiler, och foamy histiocyter (vävnadsmakrofager ) i lungan foder . Bakterier som H. influenzae och P. aeruginosa är också detekterbara, med den senare blir mer framträdande när sjukdomen fortskrider. Det vita blod-, bakterie- och andra cellulära innehållet i blodet kan mätas genom att man tar ett fullständigt blodtal (CBC). Förhöjda nivåer av IgG och IgA (klasser av immunglobuliner ) kan ses, liksom närvaron av reumatoid faktor (en indikator på autoimmunitet ). Hemagglutination , en hopklumpning av röda blodkroppar som svar på närvaron av antikroppar i blodet, kan också förekomma. Neutrofiler, beta-defensiner, leukotriener och kemokiner kan också detekteras i bronkoalveolär sköljvätska som injiceras och sedan avlägsnas från bronchiolar luftvägar hos individer med DPB, för utvärdering.
Differentiell diagnos
I differentiell diagnos (att hitta rätt diagnos mellan sjukdomar som har överlappande egenskaper) hos vissa obstruktiva lungsjukdomar, anses DPB ofta. Ett antal DPB-symtom liknar dem som finns med andra obstruktiva lungsjukdomar som astma , kronisk bronkit och emfysem . Väsande andning , hosta med sputumproduktion och andfåddhet är vanliga symtom vid sådana sjukdomar, och obstruktiv andningsfunktionsnedsättning återfinns vid lungfunktionstester . Cystisk fibros, som DPB, orsakar allvarlig lunginflammation, överdriven slemproduktion och infektion; men DPB orsakar inte störningar i bukspottkörteln eller elektrolyterna , liksom CF, så de två sjukdomarna är olika och troligen inte relaterade. DPB kännetecknas av närvaron av lesioner som uppträder på röntgen som knölar i bronkiolerna i båda lungorna; inflammation i alla vävnadsskikt i andningsbronkiolerna; och dess högre förekomst bland individer med östasiatisk härkomst.
DPB och bronchiolitis obliterans är två former av primär bronchiolitis. Specifika överlappande egenskaper hos båda sjukdomarna inkluderar stark hosta med stora mängder ofta pusfylld sputum; knölar synliga på röntgenstrålar i lungorna i det nedre bronkierna och bronkiolarområdet; och kronisk bihåleinflammation. I DPB är nodulerna mer begränsade till andningsbronkiolerna, medan de i OB ofta finns i membranbronkiolerna (den initiala icke-broskiga delen av bronchiolen, som skiljer sig från den tertiära bronchusen ) upp till den sekundära bronchusen . OB är en bronkiolar sjukdom med global prevalens, medan DPB har mer lokal prevalens, främst i Japan. Innan kliniskt erkännande av DPB under senare år diagnostiserades det ofta som bronkiektasi , KOL , IPF , phthisis miliaris , sarkoidos eller alveolär cellkarcinom .
Behandling
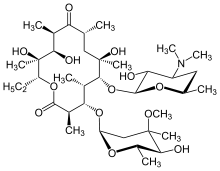
Makrolidantibiotika , såsom erytromycin , är en effektiv behandling för DPB när de tas regelbundet under en längre tid. Klaritromycin eller roxitromycin används också ofta. De framgångsrika resultaten av makrolider i DPB och liknande lungsjukdomar härrör från hantering av vissa symtom genom immunmodulering (justering av immunsvaret), vilket kan uppnås genom att ta antibiotika i låga doser . Behandlingen består av daglig oral administrering av erytromycin i två till tre år, en förlängd period som har visat sig dramatiskt förbättra effekterna av DPB. Detta är uppenbart när en individ som genomgår behandling för DPB, bland ett antal sjukdomsrelaterade remissionskriterier, har ett normalt neutrofilantal upptäckt i BAL-vätska och blodgas (ett arteriellt blodprov som mäter mängden syre och koldioxid i blodvärden visar att fritt syre i blodet ligger inom det normala området. Att tillåta en tillfällig paus från erytromycinbehandling i dessa fall har föreslagits för att minska bildningen av makrolidresistent P. aeruginosa . DPB-symtom återkommer vanligtvis och behandlingen måste återupptas. Även om det är mycket effektivt kan erytromycin inte visa sig vara framgångsrikt hos alla individer med sjukdomen, särskilt om makrolidresistent P. aeruginosa är närvarande eller tidigare obehandlad DPB har utvecklats till den punkt där andningsfel uppträder.
Med erytromycin terapi i DPB är stor minskning bronkiolära inflammation och skador uppnås genom undertryckande av inte bara neutrofila spridning, men också lymfocyter aktivitet och obstruktiv slem och vatten sekret i luftvägarna. De antibiotiska effekterna av makrolider är inte inblandade i deras fördelaktiga effekter mot att minska inflammation i DPB. Detta är uppenbart eftersom behandlingsdosen är alldeles för låg för att bekämpa infektioner, och i DPB-fall med förekomst av makrolidresistent P. aeruginosa minskar erytromycinbehandling fortfarande inflammation.
Ett antal faktorer är involverade i undertryckande av inflammation av erytromycin och andra makrolider. De är särskilt effektiva för att hämma proliferationen av neutrofiler genom att minska förmågan hos interleukin 8 och leukotrien B4 att attrahera dem. Makrolider minskar också effektiviteten hos vidhäftningsmolekyler som gör det möjligt för neutrofiler att hålla sig till bronkiola vävnadsfoder. Slemproduktion i luftvägarna är en stor skyldig till sjuklighet och dödlighet hos DPB och andra luftvägssjukdomar. Den signifikanta minskningen av inflammation i DPB tillskriven erytromycinbehandling hjälper också till att hämma produktionen av överflödigt slem.
Prognos
Obehandlad DPB leder till bronkiektas, andningssvikt och död. En journalrapport från 1983 visade att obehandlad DPB hade en femårsöverlevnad på 62,1%, medan den 10-åriga överlevnadsgraden var 33,2%. Med erytromycinbehandling har individer med DPB nu en mycket längre livslängd på grund av bättre symtomhantering, fördröjning av progression och förebyggande av associerade infektioner som P. aeruginosa . Den 10-åriga överlevnadsgraden för behandlad DPB är cirka 90%. I DPB-fall där behandlingen har resulterat i betydande förbättringar, som ibland inträffar efter ungefär två år, har behandlingen fått avslutas ett tag. Emellertid övervakas personer som får stoppa behandlingen under denna tid. Eftersom det har visat sig att DPB återkommer måste terapi med erytromycin omedelbart återupptas när sjukdomssymtomen börjar dyka upp igen. Trots den förbättrade prognosen vid behandling har DPB för närvarande inget känt botemedel.
Epidemiologi
DPB har sin högsta förekomst bland japanerna, 11 per 100.000 invånare. Koreanska, kinesiska och thailändska individer med sjukdomen har också rapporterats. En genetisk predisposition bland östra asiater föreslås. Sjukdomen är vanligare hos män, med förhållandet mellan man och kvinna vid 1,4–2: 1 (eller cirka 5 män till 3 kvinnor). Den genomsnittliga uppkomsten av sjukdomen är cirka 40 år, och två tredjedelar av de drabbade är icke-rökare, även om rökning inte tros vara en orsak. Närvaron av HLA-Bw54 ökar risken för diffus panbronchiolitis 13,3-faldigt.
I Europa och Amerika har ett relativt litet antal DPB-fall rapporterats hos asiatiska invandrare och invånare samt hos individer av icke-asiatiska anor. Feldiagnos har inträffat i väst på grund av mindre erkännande av sjukdomen än i asiatiska länder. I förhållande till det stora antalet asiater som bor i väst, antar det lilla antalet av dem som påverkas av DPB att icke-genetiska faktorer kan spela någon roll i dess orsak. Denna sällsynthet som ses i västra asiater kan också delvis förknippas med feldiagnos.
Historia
I början av 1960-talet observerades och beskrivs en relativt ny kronisk lungsjukdom av läkare i Japan. 1969 introducerades namnet "diffus panbronchiolitis" för att skilja det från kronisk bronkit, emfysem, alveolit och annan obstruktiv lungsjukdom med inflammation. Mellan 1978 och 1980 avslöjade resultaten av en rikstäckande undersökning initierad av Japans hälso- och välfärdsministerium mer än 1000 sannolika fall av DPB, med 82 histologiskt bekräftade. Vid 1980-talet erkändes det internationellt som en distinkt lungsjukdom.
Före 1980-talet var prognosen eller det förväntade resultatet av DPB dålig, särskilt i fall med superinfektion (uppkomsten av en ny virus- eller bakterieinfektion, utöver den nuvarande infektionen) av P. aeruginosa . DPB fortsatte att ha en mycket hög dödlighet innan generaliserad antibiotikabehandling och syrebehandling började användas rutinmässigt för att hantera symtomen. Omkring 1985, då långvarig behandling med antibiotikum erytromycin blev standarden för att hantera DPB, förbättrades prognosen avsevärt. År 1990 hävdades ursprungligen DPB: s anslutning till HLA.
Referenser
externa länkar
| Klassificering | |
|---|---|
| Externa resurser |