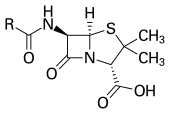
Antibiotikum -Antibiotic
| Antibiotikum | |
|---|---|
| Läkemedelsklass | |
 Testa känsligheten hos Staphylococcus aureus för antibiotika med Kirby-Bauer diskdiffusionsmetoden – antibiotika diffunderar från skivor som innehåller antibiotika och hämmar tillväxten av S. aureus , vilket resulterar i en hämningszon.
| |
| I Wikidata |
Ett antibiotikum är en typ av antimikrobiell substans som är aktiv mot bakterier . Det är den viktigaste typen av antibakteriella medel för att bekämpa bakteriella infektioner , och antibiotikamediciner används i stor utsträckning vid behandling och förebyggande av sådana infektioner. De kan antingen döda eller hämma tillväxten av bakterier. Ett begränsat antal antibiotika har också antiprotozoal aktivitet. Antibiotika är inte effektiva mot virus som förkylning eller influensa; läkemedel som hämmar virus kallas antivirala läkemedel eller antivirala medel snarare än antibiotika.
Ibland används termen antibiotika – bokstavligen "motsatt liv", från de grekiska rötterna ἀντι anti , "mot" och βίος bios , "liv" – allmänt för att hänvisa till alla substanser som används mot mikrober , men i vanlig medicinsk användning, antibiotika (som penicillin ) är de som produceras naturligt (av en mikroorganism som bekämpar en annan), medan icke-antibiotiska antibakteriella medel (som sulfonamider och antiseptika ) är helt syntetiska . Men båda klasserna har samma mål att döda eller förhindra tillväxt av mikroorganismer, och båda ingår i antimikrobiell kemoterapi . "Antibakterier" inkluderar antiseptiska läkemedel, antibakteriella tvålar och kemiska desinfektionsmedel , medan antibiotika är en viktig klass av antibakteriella medel som används mer specifikt inom medicin och ibland i djurfoder .
Antibiotika har använts sedan urminnes tider. Många civilisationer använde lokal applicering av mögligt bröd, med många hänvisningar till dess fördelaktiga effekter som härrör från det forntida Egypten, Nubien, Kina , Serbien , Grekland och Rom. Den första personen som direkt dokumenterade användningen av mögelsvamp för att behandla infektioner var John Parkinson (1567–1650). Antibiotika revolutionerade medicinen på 1900-talet. Alexander Fleming (1881–1955) upptäckte dagens penicillin 1928, vars utbredda användning visade sig vara avsevärt fördelaktigt under krigstid. Effektiviteten och den lätta tillgången till antibiotika har dock också lett till överanvändning och vissa bakterier har utvecklat resistens mot dem. Världshälsoorganisationen har klassificerat antimikrobiell resistens som ett utbrett "allvarligt hot [som] inte längre är en förutsägelse för framtiden, det händer just nu i alla regioner i världen och har potential att påverka vem som helst, oavsett ålder, i vilket land som helst". Globala dödsfall hänförliga till antimikrobiell resistens uppgick till 1,27 miljoner 2019.
Etymologi
Termen "antibios", som betyder "mot livet", introducerades av den franske bakteriologen Jean Paul Vuillemin som ett beskrivande namn på fenomenet som dessa tidiga antibakteriella läkemedel uppvisar. Antibios beskrevs första gången 1877 i bakterier när Louis Pasteur och Robert Koch observerade att en luftburen bacillus kunde hämma tillväxten av Bacillus anthracis . Dessa läkemedel döptes senare om till antibiotika av Selman Waksman , en amerikansk mikrobiolog, 1947.
Termen antibiotika användes första gången 1942 av Selman Waksman och hans medarbetare i tidskriftsartiklar för att beskriva alla substanser som produceras av en mikroorganism som är antagonistiska mot tillväxten av andra mikroorganismer i hög utspädning. Denna definition uteslöt ämnen som dödar bakterier men som inte produceras av mikroorganismer (som magsaft och väteperoxid ). Det uteslöt också syntetiska antibakteriella föreningar som sulfonamiderna . I nuvarande användning tillämpas termen "antibiotikum" på alla läkemedel som dödar bakterier eller hämmar deras tillväxt, oavsett om läkemedlet produceras av en mikroorganism eller inte.
Termen "antibiotikum" härrör från anti + βιωτικός ( biōtikos ), "passad för livet, livlig", som kommer från βίωσις ( biōsis ), "livssätt", och det från βίος ( bios ), "liv". Termen "antibakteriell" härstammar från grekiska ἀντί ( anti ), "mot" + βακτήριον ( baktērion ), diminutiv av βακτηρία ( baktēria ), "personal, var sockerrör", för att vara den första upptäckta bakterierna.
Användande
Medicinsk användning
Antibiotika används för att behandla eller förebygga bakterieinfektioner, och ibland protozoinfektioner . ( Metronidazol är effektivt mot ett antal parasitsjukdomar ). När en infektion misstänks vara ansvarig för en sjukdom men den ansvariga patogenen inte har identifierats, antas en empirisk terapi . Detta innebär administrering av ett bredspektrumantibiotikum baserat på de tecken och symtom som presenteras och påbörjas i väntan på laboratorieresultat som kan ta flera dagar.
När den ansvariga patogena mikroorganismen redan är känd eller har identifierats kan definitiv behandling påbörjas. Detta kommer vanligtvis att involvera användningen av ett smalspektrumantibiotikum. Valet av antibiotika som ges kommer också att baseras på dess kostnad. Identifiering är avgörande eftersom det kan minska kostnaderna och toxiciteten för antibiotikabehandlingen och även minska möjligheten för uppkomsten av antimikrobiell resistens. För att undvika operation kan antibiotika ges för icke-komplicerad akut blindtarmsinflammation .
Antibiotika kan ges som en förebyggande åtgärd och detta är vanligtvis begränsat till riskgrupper som de med ett försvagat immunförsvar (särskilt i HIV- fall för att förhindra lunginflammation ), de som tar immunsuppressiva läkemedel , cancerpatienter och de som opereras . Deras användning i kirurgiska ingrepp är att hjälpa till att förhindra infektion av snitt . De har en viktig roll i dental antibiotikaprofylax där deras användning kan förhindra bakteriemi och därav följande infektiös endokardit . Antibiotika används också för att förhindra infektion i fall av neutropeni , särskilt cancerrelaterad.
Användningen av antibiotika för sekundär prevention av kranskärlssjukdom stöds inte av aktuella vetenskapliga bevis och kan faktiskt öka kardiovaskulär dödlighet, dödlighet av alla orsaker och förekomsten av stroke.
Administreringsvägar
Det finns många olika administreringsvägar för antibiotikabehandling. Antibiotika tas vanligtvis genom munnen . I svårare fall, särskilt djupt liggande systemiska infektioner , kan antibiotika ges intravenöst eller genom injektion. Där infektionsplatsen är lättillgänglig kan antibiotika ges topiskt i form av ögondroppar på bindhinnan för konjunktivit eller örondroppar för öroninfektioner och akuta fall av simmaröra . Lokal användning är också ett av behandlingsalternativen för vissa hudåkommor, inklusive akne och cellulit . Fördelarna med topisk applicering inkluderar att uppnå hög och ihållande koncentration av antibiotika vid infektionsstället; minskar risken för systemisk absorption och toxicitet, och totala mängder antibiotika som krävs minskas, vilket också minskar risken för missbruk av antibiotika. Aktuella antibiotika applicerade på vissa typer av operationssår har rapporterats minska risken för infektioner på operationsstället. Det finns dock vissa allmänna orsaker till oro vid topikal administrering av antibiotika. Viss systemisk absorption av antibiotikan kan förekomma; mängden antibiotika som appliceras är svår att dosera exakt, och det finns också möjlighet att lokala överkänslighetsreaktioner eller kontakteksem uppstår. Det rekommenderas att administrera antibiotika så snart som möjligt, särskilt vid livshotande infektioner. Många akutmottagningar har antibiotika för detta ändamål.
Global konsumtion
Antibiotikakonsumtionen varierar kraftigt mellan länderna. WHO : s rapport om övervakning av antibiotikakonsumtion som publicerades 2018 analyserade 2015 års data från 65 länder. Mätt i definierade dagliga doser per 1 000 invånare per dag. Mongoliet hade den högsta konsumtionen med en takt på 64,4. Burundi hade lägst på 4,4. Amoxicillin och amoxicillin/klavulansyra var de som konsumerades mest.
Bieffekter
Antibiotika screenas för eventuella negativa effekter innan de godkänns för klinisk användning och anses vanligtvis vara säkra och väl tolererade. Vissa antibiotika har dock förknippats med en stor omfattning av negativa biverkningar , allt från milda till mycket allvarliga beroende på vilken typ av antibiotika som används, vilka mikrober som riktas mot och den individuella patienten. Biverkningar kan återspegla de farmakologiska eller toxikologiska egenskaperna hos antibiotikan eller kan involvera överkänslighet eller allergiska reaktioner. Biverkningarna sträcker sig från feber och illamående till allvarliga allergiska reaktioner, inklusive fotodermatit och anafylaxi .
Vanliga biverkningar av orala antibiotika inkluderar diarré , till följd av störningar av artsammansättningen i tarmfloran , vilket till exempel resulterar i överväxt av patogena bakterier, såsom Clostridium difficile . Att ta probiotika under antibiotikabehandlingen kan hjälpa till att förhindra antibiotikarelaterad diarré. Antibakteriella medel kan också påverka den vaginala floran och kan leda till överväxt av jästarter av släktet Candida i vulvo-vaginalområdet. Ytterligare biverkningar kan uppstå från interaktion med andra läkemedel, såsom risken för senskador från administrering av ett kinolonantibiotikum med en systemisk kortikosteroid .
Vissa antibiotika kan också skada mitokondrien , en bakteriehärledd organell som finns i eukaryota, inklusive mänskliga, celler. Mitokondriell skada orsakar oxidativ stress i celler och har föreslagits som en mekanism för biverkningar från fluorokinoloner . De är också kända för att påverka kloroplaster .
Interaktioner
P-piller
Det finns få välkontrollerade studier om huruvida antibiotikaanvändning ökar risken för misslyckande av p-piller . Majoriteten av studierna indikerar att antibiotika inte stör p-piller , såsom kliniska studier som tyder på att misslyckandefrekvensen för p-piller orsakade av antibiotika är mycket låg (cirka 1%). Situationer som kan öka risken för misslyckande med p -piller inkluderar bristande efterlevnad (missar att ta p-piller), kräkningar eller diarré. Gastrointestinala störningar eller variationer mellan patienter i absorption av orala preventivmedel som påverkar serumnivåerna av etinylestradiol i blodet. Kvinnor med oregelbunden menstruation kan löpa högre risk att misslyckas och bör rekommenderas att använda reservpreventivmedel under antibiotikabehandling och i en vecka efter avslutad behandling. Om patientspecifika riskfaktorer för minskad effekt av p-piller misstänks rekommenderas reservpreventivmedel.
I fall där antibiotika har föreslagits påverka effektiviteten av p-piller, såsom för det bredspektrumantibiotikum rifampicin , kan dessa fall bero på en ökning av aktiviteten hos leverenzymer som orsakar ökad nedbrytning av p-pillrets aktiva ingredienser. . Effekter på tarmfloran , som kan resultera i minskad absorption av östrogener i tjocktarmen, har också föreslagits, men sådana förslag har varit ofullständiga och kontroversiella. Läkare har rekommenderat att extra preventivmedel vidtas under terapier med antibiotika som misstänks interagera med orala preventivmedel . Fler studier om möjliga interaktioner mellan antibiotika och p-piller (perorala preventivmedel) krävs liksom noggrann bedömning av patientspecifika riskfaktorer för potentiellt misslyckande med p-piller innan man avfärdar behovet av reservpreventivmedel.
Alkohol
Interaktioner mellan alkohol och vissa antibiotika kan förekomma och kan orsaka biverkningar och minskad effektivitet av antibiotikabehandling. Medan måttlig alkoholkonsumtion sannolikt inte kommer att störa många vanliga antibiotika, finns det specifika typer av antibiotika, med vilka alkoholkonsumtion kan orsaka allvarliga biverkningar. Därför beror potentiella risker för biverkningar och effektivitet på vilken typ av antibiotika som administreras.
Antibiotika som metronidazol , tinidazol , cefamandole , latamoxef , cefoperazon , cefmenoxim och furazolidon , orsakar en disulfiramliknande kemisk reaktion med alkohol genom att hämma dess nedbrytning av acetaldehyddehydrogenas , vilket kan resultera i andfåddhet och kräkningar, kräkningar. Dessutom kan effekten av doxycyklin och erytromycinsuccinat minskas av alkoholkonsumtion. Andra effekter av alkohol på antibiotikaaktiviteten inkluderar förändrad aktivitet hos leverenzymer som bryter ner den antibiotiska föreningen.
Farmakodynamik
Det framgångsrika resultatet av antimikrobiell terapi med antibakteriella föreningar beror på flera faktorer. Dessa inkluderar värdförsvarsmekanismer , platsen för infektion och de farmakokinetiska och farmakodynamiska egenskaperna hos det antibakteriella medlet. Den bakteriedödande aktiviteten hos antibakteriella medel kan bero på den bakteriella tillväxtfasen, och den kräver ofta pågående metabolisk aktivitet och delning av bakterieceller. Dessa fynd är baserade på laboratoriestudier och har i kliniska miljöer också visat sig eliminera bakterieinfektioner. Eftersom aktiviteten av antibakteriella medel ofta beror på dess koncentration, inkluderar in vitro karakterisering av antibakteriell aktivitet vanligen bestämning av den minsta inhiberande koncentrationen och den minsta bakteriedödande koncentrationen av ett antibakteriellt medel. För att förutsäga kliniska utfall kombineras vanligtvis den antimikrobiella aktiviteten hos ett antibakteriellt medel med dess farmakokinetiska profil, och flera farmakologiska parametrar används som markörer för läkemedelseffekt.
Kombinationsterapi
Vid viktiga infektionssjukdomar, inklusive tuberkulos, har kombinationsterapi (dvs. samtidig applicering av två eller flera antibiotika) använts för att fördröja eller förhindra uppkomsten av resistens. Vid akuta bakterieinfektioner ordineras antibiotika som en del av kombinationsbehandlingen för sina synergistiska effekter för att förbättra behandlingsresultatet eftersom den kombinerade effekten av båda antibiotika är bättre än deras individuella effekt. Meticillinresistenta Staphylococcus aureus - infektioner kan behandlas med en kombinationsbehandling av fusidinsyra och rifampicin. Antibiotika som används i kombination kan också vara antagonistiska och den kombinerade effekten av de två antibiotikana kan vara mindre än om en av antibiotikana gavs som monoterapi . Till exempel är kloramfenikol och tetracykliner antagonister till penicilliner . Detta kan dock variera beroende på arten av bakterier. I allmänhet är kombinationer av ett bakteriostatiskt antibiotikum och ett bakteriedödande antibiotikum antagonistiska.
Förutom att kombinera ett antibiotikum med ett annat, administreras antibiotika ibland tillsammans med resistensmodifierande medel. Till exempel kan β-laktamantibiotika användas i kombination med β-laktamasinhibitorer , såsom klavulansyra eller sulbactam , när en patient är infekterad med en β-laktamasproducerande bakteriestam.
Klasser
Antibiotika klassificeras vanligtvis baserat på deras verkningsmekanism , kemiska struktur eller aktivitetsspektrum. De flesta riktar sig mot bakteriefunktioner eller tillväxtprocesser. De som riktar sig mot bakteriecellsväggen ( penicilliner och cefalosporiner ) eller cellmembranet ( polymyxiner ), eller stör essentiella bakteriella enzymer ( rifamyciner , lipiarmyciner , kinoloner och sulfonamider ) har bakteriedödande aktiviteter. Proteinsyntesinhibitorer ( makrolider , linkosamider och tetracykliner ) är vanligtvis bakteriostatiska (med undantag för bakteriedödande aminoglykosider ). Ytterligare kategorisering baseras på deras målspecificitet. "Smalspektrum" antibiotika riktar sig mot specifika typer av bakterier, såsom gramnegativa eller grampositiva , medan bredspektrumantibiotika påverkar ett brett spektrum av bakterier. Efter ett 40-årigt uppehåll i upptäckten av klasser av antibakteriella föreningar, introducerades fyra nya klasser av antibiotika för klinisk användning i slutet av 2000-talet och början av 2010-talet: cykliska lipopeptider (som daptomycin ), glycylcykliner (som tigecyklin ), oxazolidinoner (t.ex. linezolid ) och lipiarmyciner (såsom fidaxomicin ).
Produktion
Med framsteg inom medicinsk kemi är de flesta moderna antibakteriella medel semisyntetiska modifieringar av olika naturliga föreningar. Dessa inkluderar till exempel betalaktamantibiotika , som inkluderar penicilliner (producerade av svampar i släktet Penicillium ), cefalosporiner och karbapenemer . Föreningar som fortfarande är isolerade från levande organismer är aminoglykosiderna , medan andra antibakteriella medel - till exempel sulfonamiderna , kinolonerna och oxazolidinonerna - produceras enbart genom kemisk syntes . Många antibakteriella föreningar är relativt små molekyler med en molekylvikt på mindre än 1000 dalton .
Sedan de första pionjärinsatserna av Howard Florey och Chain 1939, har betydelsen av antibiotika, inklusive antibakteriella, för medicinen lett till intensiv forskning för att producera antibakteriella medel i stor skala. Efter screening av antibakteriella medel mot ett brett spektrum av bakterier , utförs produktionen av de aktiva föreningarna med fermentering , vanligtvis under starkt aeroba förhållanden.
Motstånd
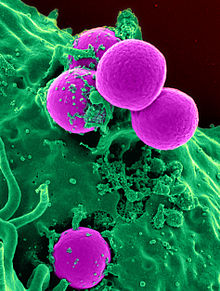
Uppkomsten av antibiotikaresistenta bakterier är ett vanligt fenomen. Uppkomsten av resistens återspeglar ofta evolutionära processer som äger rum under antibiotikabehandling. Antibiotikabehandlingen kan välja för bakteriestammar med fysiologiskt eller genetiskt förbättrad förmåga att överleva höga doser av antibiotika. Under vissa förhållanden kan det resultera i preferentiell tillväxt av resistenta bakterier, medan tillväxt av känsliga bakterier hämmas av läkemedlet. Till exempel demonstrerades antibakteriell selektion för stammar som tidigare förvärvat gener för antibakteriell resistens 1943 av Luria–Delbrück-experimentet . Antibiotika som penicillin och erytromycin, som tidigare hade en hög effekt mot många bakteriearter och stammar, har blivit mindre effektiva på grund av den ökade resistensen hos många bakteriestammar.
Resistens kan ta formen av biologisk nedbrytning av läkemedel, såsom sulfametazinnedbrytande jordbakterier som introduceras till sulfametazin genom medicinerad grisavföring. Bakteriers överlevnad beror ofta på en ärftlig resistens, men tillväxten av resistens mot antibakteriella medel sker också genom horisontell genöverföring . Horisontell överföring är mer sannolikt att ske på platser med frekvent antibiotikaanvändning.
Antibakteriell resistens kan medföra en biologisk kostnad och därigenom minska konditionen hos resistenta stammar, vilket kan begränsa spridningen av antibakteriellt resistenta bakterier, till exempel i frånvaro av antibakteriella föreningar. Ytterligare mutationer kan dock kompensera för denna träningskostnad och kan hjälpa dessa bakteriers överlevnad.
Paleontologiska data visar att både antibiotika och antibiotikaresistens är uråldriga föreningar och mekanismer. Användbara antibiotikamål är de för vilka mutationer negativt påverkar bakteriell reproduktion eller livsduglighet.
Det finns flera molekylära mekanismer för antibakteriell resistens. Inneboende antibakteriell resistens kan vara en del av den genetiska sammansättningen av bakteriestammar. Till exempel kan ett antibiotikamål saknas från bakteriegenomet . Förvärvad resistens är resultatet av en mutation i den bakteriella kromosomen eller förvärvet av extrakromosomalt DNA. Antibakteriellt producerande bakterier har utvecklat resistensmekanismer som har visat sig likna, och kan ha överförts till, antibakteriellt resistenta stammar. Spridningen av antibakteriell resistens sker ofta genom vertikal överföring av mutationer under tillväxt och genom genetisk rekombination av DNA genom horisontellt genetiskt utbyte . Till exempel kan antibakteriella resistensgener bytas ut mellan olika bakteriestammar eller arter via plasmider som bär dessa resistensgener. Plasmider som bär flera olika resistensgener kan ge resistens mot flera antibakteriella medel. Korsresistens mot flera antibakteriella medel kan också uppstå när en resistensmekanism som kodas av en enda gen förmedlar resistens mot mer än en antibakteriell förening.
Antibakteriellt resistenta stammar och arter, ibland kallade "superbugs", bidrar nu till uppkomsten av sjukdomar som under en tid var väl kontrollerade. Till exempel, framväxande bakteriestammar som orsakar tuberkulos som är resistenta mot tidigare effektiva antibakteriella behandlingar utgör många terapeutiska utmaningar. Varje år beräknas nästan en halv miljon nya fall av multiresistent tuberkulos (MDR-TB) inträffa över hela världen. Till exempel är NDM-1 ett nyligen identifierat enzym som förmedlar bakteriell resistens mot ett brett spektrum av beta-laktam antibakteriella medel. Storbritanniens Health Protection Agency har uttalat att "de flesta isolat med NDM-1-enzym är resistenta mot alla vanliga intravenösa antibiotika för behandling av allvarliga infektioner." Den 26 maj 2016 identifierades en E. coli " superbug " i USA som var resistent mot colistin , "den sista försvarslinjen"-antibiotikum .
Missbruka
Per The ICU Book "Den första regeln för antibiotika är att försöka att inte använda dem, och den andra regeln är att försöka att inte använda för många av dem." Olämplig antibiotikabehandling och överanvändning av antibiotika har bidragit till uppkomsten av antibiotikaresistenta bakterier. Potentiella skador från antibiotika sträcker sig dock bortom urvalet av antimikrobiell resistens och deras överanvändning är förknippad med negativa effekter för patienterna själva, som tydligast ses hos kritiskt sjuka patienter på intensivvårdsavdelningar . Självförskrivning av antibiotika är ett exempel på missbruk. Många antibiotika ordineras ofta för att behandla symtom eller sjukdomar som inte svarar på antibiotika eller som sannolikt kommer att försvinna utan behandling. Dessutom ordineras felaktiga eller suboptimala antibiotika för vissa bakterieinfektioner. Överanvändning av antibiotika, som penicillin och erytromycin, har associerats med framväxande antibiotikaresistens sedan 1950-talet. Utbredd användning av antibiotika på sjukhus har också förknippats med ökningar av bakteriestammar och arter som inte längre svarar på behandling med de vanligaste antibiotika.
Vanliga former av missbruk av antibiotika inkluderar överdriven användning av profylaktisk antibiotika hos resenärer och underlåtenhet hos medicinsk personal att förskriva korrekt dosering av antibiotika baserat på patientens vikt och tidigare användning. Andra former av missbruk inkluderar underlåtenhet att ta hela den föreskrivna kuren av antibiotikan, felaktig dosering och administrering eller underlåtenhet att vila för tillräcklig återhämtning. Olämplig antibiotikabehandling, till exempel, är deras recept för att behandla virusinfektioner som förkylning . En studie om luftvägsinfektioner fann att "läkare var mer benägna att förskriva antibiotika till patienter som verkade förvänta sig dem". Multifaktoriella insatser riktade till både läkare och patienter kan minska olämplig förskrivning av antibiotika. Bristen på snabba diagnostiska tester, särskilt i resursbegränsade miljöer, anses vara en av drivkrafterna för missbruk av antibiotika.
Flera organisationer som sysslar med antimikrobiell resistens lobbar för att eliminera onödig användning av antibiotika. Frågorna om missbruk och överanvändning av antibiotika har tagits upp genom bildandet av US Interagency Task Force on Antimicrobial Resistance. Denna arbetsgrupp syftar till att aktivt ta itu med antimikrobiell resistens och koordineras av US Centers for Disease Control and Prevention , Food and Drug Administration (FDA) och National Institutes of Health , samt andra amerikanska myndigheter. En kampanjgrupp för icke-statlig organisation är Keep Antibiotics Working . I Frankrike startade en regeringskampanj "Antibiotika är inte automatiskt" 2002 och ledde till en markant minskning av onödiga antibiotikarecept, särskilt hos barn.
Uppkomsten av antibiotikaresistens har föranlett begränsningar av deras användning i Storbritannien 1970 (Swann-rapporten 1969), och Europeiska unionen har förbjudit användningen av antibiotika som tillväxtfrämjande medel sedan 2003. Dessutom har flera organisationer (inklusive Världshälsoorganisationen) , National Academy of Sciences och US Food and Drug Administration ) har förespråkat att begränsa mängden antibiotikaanvändning i djurproduktionen. Det är dock vanligt att det förekommer förseningar i reglerings- och lagstiftningsåtgärder för att begränsa användningen av antibiotika, delvis hänförlig till resistens mot sådan reglering av industrier som använder eller säljer antibiotika, och till den tid som krävs för forskning för att testa orsakssamband mellan användning och resistens mot dem. . Två federala lagförslag (S.742 och HR 2562) som syftar till att fasa ut icke-terapeutisk användning av antibiotika hos amerikanska matdjur föreslogs, men har inte godkänts. Dessa lagförslag godkändes av folkhälso- och medicinska organisationer, inklusive American Holistic Nurses' Association, American Medical Association och American Public Health Association .
Trots löften från livsmedelsföretag och restauranger att minska eller eliminera kött som kommer från djur som behandlats med antibiotika, har inköpen av antibiotika för användning på husdjur ökat varje år.
Det har förekommit omfattande användning av antibiotika i djurhållningen. I USA togs frågan om uppkomsten av antibiotikaresistenta bakteriestammar på grund av användning av antibiotika i boskap upp av US Food and Drug Administration (FDA) 1977. I mars 2012, USA:s distriktsdomstol för Southern District i New York, som avgjorde i en talan väckt av Natural Resources Defense Council och andra, beordrade FDA att återkalla godkännanden för användning av antibiotika i boskap, vilket bröt mot FDA:s bestämmelser.
Studier har visat att vanliga missuppfattningar om effektiviteten och nödvändigheten av antibiotika för att behandla vanliga lindriga sjukdomar bidrar till deras överanvändning.
Andra former av antibiotikarelaterade skador inkluderar anafylaxi , läkemedelstoxicitet , framför allt njur- och leverskador, och superinfektioner med resistenta organismer. Antibiotika är också kända för att påverka mitokondriell funktion, och detta kan bidra till det bioenergetiska misslyckandet hos immunceller som ses vid sepsis . De förändrar också mikrobiomet i tarmen, lungorna och huden, vilket kan vara associerat med biverkningar som Clostridium difficile associerad diarré . Även om antibiotika helt klart kan vara livräddande hos patienter med bakterieinfektioner, kan överanvändning av dem, särskilt hos patienter där infektioner är svåra att diagnostisera, leda till skada via flera mekanismer.
Historia
Före det tidiga 1900-talet baserades behandlingar för infektioner främst på medicinsk folklore . Blandningar med antimikrobiella egenskaper som användes vid behandling av infektioner beskrevs för över 2 000 år sedan. Många forntida kulturer, inklusive de forntida egyptierna och de gamla grekerna , använde speciellt utvalda mögel- och växtmaterial för att behandla infektioner . Nubiska mumier som studerades på 1990-talet visade sig innehålla betydande halter av tetracyklin . Det öl som bryggdes vid den tiden antogs ha varit källan.
Användningen av antibiotika i modern medicin började med upptäckten av syntetiska antibiotika som härrör från färgämnen.
Syntetiska antibiotika framställda av färgämnen
Syntetisk antibiotikakemoterapi som vetenskap och utveckling av antibakteriella medel började i Tyskland med Paul Ehrlich i slutet av 1880-talet. Ehrlich noterade att vissa färgämnen skulle färga mänskliga, djur- eller bakterieceller, medan andra inte gjorde det. Han föreslog sedan idén att det skulle vara möjligt att skapa kemikalier som skulle fungera som ett selektivt läkemedel som skulle binda till och döda bakterier utan att skada den mänskliga värden. Efter att ha screenat hundratals färgämnen mot olika organismer, 1907, upptäckte han ett medicinskt användbart läkemedel, den första syntetiska antibakteriella organoarsenikföreningen salvarsan , nu kallad arsfenamin.
Detta förebådade eran av antibakteriell behandling som inleddes med upptäckten av en serie syntetiska antibiotika från arsenik av både Alfred Bertheim och Ehrlich 1907. Ehrlich och Bertheim hade experimenterat med olika kemikalier från färgämnen för att behandla trypanosomiasis hos möss och spirochaeta- infektion hos kaniner. Medan deras tidiga föreningar var för giftiga, nådde Ehrlich och Sahachiro Hata , en japansk bakteriolog som arbetade med Erlich i jakten på ett läkemedel för att behandla syfilis , framgång med den 606:e substansen i sin serie av experiment. 1910 tillkännagav Ehrlich och Hata sin upptäckt, som de kallade drogen "606", vid kongressen för internmedicin i Wiesbaden . Företaget Hoechst började marknadsföra föreningen mot slutet av 1910 under namnet Salvarsan, nu känt som arsfenamin . Läkemedlet användes för att behandla syfilis under första hälften av 1900-talet. 1908 fick Ehrlich Nobelpriset i fysiologi eller medicin för sina bidrag till immunologi . Hata nominerades till Nobelpriset i kemi 1911 och till Nobelpriset i fysiologi eller medicin 1912 och 1913.
Den första sulfonamiden och det första systemiskt aktiva antibakteriella läkemedlet, Prontosil , utvecklades av en forskargrupp ledd av Gerhard Domagk 1932 eller 1933 vid Bayer Laboratories i IG Farben- konglomeratet i Tyskland, för vilket Domagk fick 1939 års Nobelpris i fysiologi eller Medicin. Sulfanilamid, det aktiva läkemedlet från Prontosil, var inte patenterbart eftersom det redan hade använts i färgämnesindustrin i några år. Prontosil hade en relativt bred effekt mot grampositiva kocker , men inte mot enterobakterier . Forskningen stimulerades snabbt av dess framgång. Upptäckten och utvecklingen av detta sulfonamidläkemedel öppnade antibakteriella era.
Penicillin och andra naturliga antibiotika
Observationer om tillväxt av vissa mikroorganismer som hämmar tillväxten av andra mikroorganismer har rapporterats sedan slutet av 1800-talet. Dessa observationer av antibiotika mellan mikroorganismer ledde till upptäckten av naturliga antibakteriella medel. Louis Pasteur observerade, "om vi kunde ingripa i den antagonism som observeras mellan vissa bakterier, skulle det erbjuda kanske de största förhoppningarna om terapeutiska medel".
1874 noterade läkaren Sir William Roberts att kulturer av mögeln Penicillium glaucum som används vid tillverkning av vissa typer av ädelost inte uppvisade bakteriell kontaminering. 1876 bidrog fysikern John Tyndall till detta område.
År 1895 publicerade Vincenzo Tiberio , italiensk läkare, en artikel om den antibakteriella kraften hos vissa extrakt av mögel.
1897 lämnade doktoranden Ernest Duchesne in en avhandling, " Contribution à l'étude de la concurrence vitale chez les micro-organismes: antagonisme entre les moisissures et les microbes " (Bidrag till studiet av vital konkurrens i mikroorganismer: antagonism mellan mögel och mikrober), det första kända vetenskapliga arbetet för att överväga mögelsvampens terapeutiska förmåga till följd av deras antimikrobiella aktivitet. I sin avhandling föreslog Duchesne att bakterier och mögel engagerar sig i en evig kamp för överlevnad. Duchesne observerade att E. coli eliminerades av Penicillium glaucum när de båda odlades i samma kultur. Han observerade också att när han inokulerade laboratoriedjur med dödliga doser av tyfoidbaciller tillsammans med Penicillium glaucum , fick djuren inte tyfus. Tyvärr hindrade Duchesnes armétjänst efter att ha fått sin examen honom från att göra någon ytterligare forskning. Duchesne dog av tuberkulos , en sjukdom som nu behandlas med antibiotika.
1928 postulerade Sir Alexander Fleming existensen av penicillin , en molekyl som produceras av vissa mögelsvampar som dödar eller stoppar tillväxten av vissa typer av bakterier. Fleming arbetade på en kultur av sjukdomsframkallande bakterier när han lade märke till sporerna av en grönmögel, Penicillium rubens , i en av sina odlingsplattor . Han observerade att närvaron av mögel dödade eller förhindrade tillväxten av bakterierna. Fleming postulerade att mögelsvampen måste utsöndra en antibakteriell substans, som han döpte till penicillin 1928. Fleming trodde att dess antibakteriella egenskaper kunde utnyttjas för kemoterapi. Han karakteriserade till en början några av dess biologiska egenskaper och försökte använda ett grovt preparat för att behandla vissa infektioner, men han kunde inte fortsätta dess vidare utveckling utan hjälp av utbildade kemister.
Ernst Chain , Howard Florey och Edward Abraham lyckades rena det första penicillinet, penicillin G , 1942, men det blev inte allmänt tillgängligt utanför den allierade militären före 1945. Senare utvecklade Norman Heatley tekniken för ryggextraktion för att effektivt rena penicillin i bulk . Den kemiska strukturen hos penicillin föreslogs först av Abraham 1942 och bekräftades senare av Dorothy Crowfoot Hodgkin 1945. Renat penicillin visade potent antibakteriell aktivitet mot ett brett spektrum av bakterier och hade låg toxicitet hos människor. Dessutom hämmades dess aktivitet inte av biologiska beståndsdelar såsom pus, till skillnad från de syntetiska sulfonamiderna . (se nedan) Utvecklingen av penicillin ledde till förnyat intresse för sökandet efter antibiotikaföreningar med liknande effekt och säkerhet. För sin framgångsrika utveckling av penicillin, som Fleming av misstag hade upptäckt men inte kunde utveckla själv, som ett terapeutiskt läkemedel, delade Chain och Florey 1945 års Nobelpris i medicin med Fleming.
Florey krediterade René Dubos med banbrytande tillvägagångssätt att medvetet och systematiskt söka efter antibakteriella föreningar, vilket hade lett till upptäckten av gramicidin och hade återupplivat Floreys forskning inom penicillin. I 1939, sammanfallande med början av andra världskriget , hade Dubos rapporterat upptäckten av det första naturligt härledda antibiotikumet, tyrotricin , en förening av 20% gramicidin och 80% tyrocidin , från Bacillus brevis . Det var en av de första kommersiellt tillverkade antibiotika och var mycket effektiv vid behandling av sår och sår under andra världskriget. Gramicidin kunde emellertid inte användas systemiskt på grund av toxicitet. Tyrocidin visade sig också vara för giftigt för systemisk användning. Forskningsresultat som erhölls under den perioden delades inte mellan axeln och de allierade makterna under andra världskriget och begränsad tillgång under det kalla kriget .
Sent 1900-tal
Under mitten av 1900-talet ökade antalet nya antibiotika som introducerades för medicinskt bruk avsevärt. Från 1935 till 1968 lanserades 12 nya klasser. Men efter detta minskade antalet nya klasser markant, med endast två nya klasser som introducerades mellan 1969 och 2003.
Antibiotikapipeline
Både WHO och Infectious Disease Society of America rapporterar att den svaga antibiotikapipelinen inte matchar bakteriers ökande förmåga att utveckla resistens. Infectious Disease Society of America-rapporten noterade att antalet nya antibiotika som godkänts för marknadsföring per år hade minskat och identifierade sju antibiotika mot de gramnegativa bacillerna som för närvarande befinner sig i fas 2 eller fas 3 kliniska prövningar. Dessa läkemedel behandlade dock inte hela spektrumet av resistens hos gramnegativa baciller. Enligt WHO befinner sig femtioen nya terapeutiska enheter - antibiotika (inklusive kombinationer), i fas 1-3 kliniska prövningar från och med maj 2017. Antibiotika som riktar sig mot multiresistenta grampositiva patogener är fortfarande hög prioritet.
Ett fåtal antibiotika har fått försäljningstillstånd under de senaste sju åren. Cefalosporinet ceftarolin och lipoglykopeptiderna oritavancin och telavancin för behandling av akut bakteriell hud- och hudstrukturinfektion och samhällsförvärvad bakteriell lunginflammation. Lipoglykopeptiden dalbavancin och oxazolidinon tedizolid har också godkänts för behandling av akut bakteriell hud- och hudstrukturinfektion. Den första i en ny klass av smalspektrum makrocykliska antibiotika, fidaxomicin, har godkänts för behandling av C. difficile kolit. Nya kombinationer av cefalosporin-laktamasinhibitorer som också godkänts inkluderar ceftazidim-avibactam och ceftolozane-avibactam för komplicerad urinvägsinfektion och intraabdominal infektion.
- Ceftolozane / tazobactam (CXA-201; CXA-101/tazobactam): Kombination av antipseudomonal cefalosporin / β-laktamasinhibitor (cellväggssynteshämmare). FDA godkände den 19 december 2014.
- Ceftazidim / avibactam (ceftazidim/NXL104): kombination av antipseudomonal cefalosporin/β-laktamasinhibitor (cellväggssynteshämmare). FDA godkände den 25 februari 2015.
- Ceftarolin /avibactam (CPT-avibactam; ceftarolin/NXL104): Kombination av anti- MRSA cefalosporin/β-laktamasinhibitor (hämmare av cellväggssyntes).
- Cefiderocol : cefalosporinsiderofor . FDA godkände den 14 november 2019.
- Imipenem /relebactam: kombination av karbapenem /β-laktamasinhibitor (hämmare av cellväggssyntes). FDA godkände den 16 juli 2019.
- Meropenem/vaborbaktam : kombination av karbapenem /β-laktamasinhibitor (hämmare av cellväggssyntes). FDA godkände den 29 augusti 2017.
- Delafloxacin : kinolon (hämmare av DNA-syntes). FDA godkände den 19 juni 2017.
- Plazomicin (ACHN-490): semisyntetiskt aminoglykosidderivat ( proteinsynteshämmare ). FDA godkänd 25 juni 2018.
- Eravacyklin (TP-434): syntetiskt tetracyklinderivat (proteinsyntesinhibitor som riktar sig mot bakteriella ribosomer). FDA godkände den 27 augusti 2018.
- Omadacyklin : semisyntetiskt tetracyklinderivat (proteinsynteshämmare riktad mot bakteriella ribosomer). FDA godkände den 2 oktober 2018.
- Lefamulin : pleuromutilin antibiotikum. FDA godkände den 19 augusti 2019.
- Brilacidin (PMX-30063): peptidförsvarsproteinhärmare (cellmembranstörning). I fas 2.
Möjliga förbättringar inkluderar förtydligande av FDA:s regler för kliniska prövningar. Dessutom skulle lämpliga ekonomiska incitament kunna övertala läkemedelsföretag att investera i denna strävan. I USA infördes Antibiotic Development to Advance Patient Treatment (ADAPT) Act med syftet att snabba upp läkemedelsutvecklingen av antibiotika för att bekämpa det växande hotet från "superbugs". Enligt denna lag kan FDA godkänna antibiotika och svampdödande medel som behandlar livshotande infektioner baserat på mindre kliniska prövningar. CDC kommer att övervaka användningen av antibiotika och den framväxande resistensen och publicera data. FDA:s antibiotikamärkningsprocess, "Susceptibility Test Interpretive Criteria for Microbial Organisms" eller "brytpunkter", kommer att tillhandahålla korrekta data till vårdpersonal. Enligt Allan Coukell, senior chef för hälsoprogram på The Pew Charitable Trusts, "Genom att tillåta läkemedelsutvecklare att förlita sig på mindre datauppsättningar och förtydliga FDA:s befogenhet att tolerera en högre nivå av osäkerhet för dessa läkemedel när man gör en risk/nytta-beräkning, ADAPT skulle göra de kliniska prövningarna mer genomförbara."
Fylla på antibiotikapipeline och utveckla andra nya terapier
Eftersom antibiotikaresistenta bakteriestammar fortsätter att dyka upp och spridas finns det ett ständigt behov av att utveckla nya antibakteriella behandlingar. Aktuella strategier inkluderar traditionella kemibaserade tillvägagångssätt som naturproduktbaserad läkemedelsupptäckt , nyare kemibaserade tillvägagångssätt som läkemedelsdesign , traditionella biologibaserade tillvägagångssätt som immunoglobulinterapi och experimentella biologibaserade tillvägagångssätt som fagterapi , fekal mikrobiota transplantationer , antisens-RNA- baserade behandlingar och CRISPR-Cas9- baserade behandlingar.
Naturlig produktbaserad antibiotikaupptäckt
De flesta antibiotika som används för närvarande är naturliga produkter eller naturliga produktderivat, och bakterie- , svamp- , växt- och djurextrakt screenas i sökandet efter nya antibiotika. Organismer kan väljas ut för testning baserat på ekologiska , etnomediska , genomiska eller historiska skäl. Medicinalväxter screenas till exempel utifrån att de används av traditionella healers för att förebygga eller bota infektioner och därför kan innehålla antibakteriella föreningar. Jordbakterier screenas också på grundval av att de historiskt sett har varit en mycket rik källa till antibiotika (med 70 till 80 % av antibiotika i nuvarande användning härrörande från actinomycetes ).
Förutom att screena naturliga produkter för direkt antibakteriell aktivitet, screenas de ibland för förmågan att undertrycka antibiotikaresistens och antibiotikatolerans . Till exempel hämmar vissa sekundära metaboliter läkemedelsutflödespumpar , vilket ökar koncentrationen av antibiotika som kan nå sitt cellulära mål och minskar bakteriell resistens mot antibiotikan. Naturliga produkter som är kända för att hämma bakteriella utflödespumpar inkluderar alkaloiden lysergol , karotenoiderna kapsantin och kapsorubin och flavonoiderna rotenon och krysin . Andra naturliga produkter, denna gång primära metaboliter snarare än sekundära metaboliter, har visat sig utrota antibiotikatolerans. Till exempel minskar glukos , mannitol och fruktos antibiotikatoleransen hos Escherichia coli och Staphylococcus aureus , vilket gör dem mer mottagliga för att dödas av aminoglykosidantibiotika .
Naturliga produkter kan också screenas för förmågan att undertrycka bakteriella virulensfaktorer . Virulensfaktorer är molekyler, cellulära strukturer och regulatoriska system som gör det möjligt för bakterier att undvika kroppens immunförsvar (t.ex. ureas , stafyloxantin ), röra sig mot, fästa till och/eller invadera mänskliga celler (t.ex. typ IV pili , adhesiner , internalins ), samordna aktivering av virulensgener (t.ex. kvorumavkänning ) och orsaka sjukdom (t.ex. exotoxiner ). Exempel på naturliga produkter med antivirulens aktivitet inkluderar flavonoiden epigallocatechin gallate (som hämmar listeriolysin O ), kinontetrangomycin (som hämmar stafyloxantin) och sesquiterpene zerumbone (som hämmar Acinetobacter baumannii motilitet ).
Immunoglobulinbehandling
Antikroppar ( anti-tetanus immunoglobulin ) har använts vid behandling och förebyggande av stelkramp sedan 1910-talet, och detta tillvägagångssätt fortsätter att vara ett användbart sätt att kontrollera bakteriella sjukdomar. Den monoklonala antikroppen bezlotoxumab , till exempel, har godkänts av US FDA och EMA för återkommande Clostridium difficile - infektion , och andra monoklonala antikroppar är under utveckling (t.ex. AR-301 för tilläggsbehandling av S. aureus ventilatorassocierad lunginflammation ). Antikroppsbehandlingar verkar genom att binda till och neutralisera bakteriella exotoxiner och andra virulensfaktorer.
Fagterapi
Fagterapi är under utredning som en metod för att behandla antibiotikaresistenta bakteriestammar. Fagterapi innebär att bakteriella patogener infekteras med virus . Bakteriofager och deras värdområden är extremt specifika för vissa bakterier, så, till skillnad från antibiotika, stör de inte värdorganismens tarmmikrobiota . Bakteriofager, även kända helt enkelt som fager, infekterar och dödar bakterier främst under lytiska cykler. Fager sätter in sitt DNA i bakterien, där det transkriberas och används för att skapa nya fager, varefter cellen lyser och frigör nya fager som kan infektera och förstöra ytterligare bakterier av samma stam. Den höga specificiteten hos fag skyddar "bra" bakterier från förstörelse.
Vissa nackdelar med användningen av bakteriofager finns dock också. Bakteriofager kan hysa virulensfaktorer eller toxiska gener i sina genom och före användning kan det vara klokt att identifiera gener med likhet med kända virulensfaktorer eller toxiner genom genomisk sekvensering. Dessutom utgör oral och IV administrering av fager för utrotning av bakteriella infektioner en mycket högre säkerhetsrisk än topisk applicering. Det finns också den ytterligare oro över osäkra immunsvar på dessa stora antigena cocktails.
Det finns betydande regulatoriska hinder som måste undanröjas för sådana terapier. Trots många utmaningar förblir användningen av bakteriofager som ersättning för antimikrobiella medel mot MDR-patogener som inte längre svarar på konventionella antibiotika ett attraktivt alternativ.
Fekal mikrobiotatransplantation
Fekal mikrobiotatransplantation innebär att hela tarmens mikrobiota överförs från en frisk mänsklig donator (i form av avföring ) till patienter med C. difficile- infektion . Även om denna procedur inte har godkänts officiellt av amerikanska FDA , är användningen tillåten under vissa förhållanden hos patienter med antibiotikaresistent C. difficile - infektion. Härdningsgraden är cirka 90 %, och arbete pågår för att utveckla avföringsbanker , standardiserade produkter och metoder för oral leverans .
Antisens RNA-baserade behandlingar
Antisens-RNA-baserad behandling (även känd som gentystnadsterapi) involverar (a) identifiering av bakteriegener som kodar för essentiella proteiner (t.ex. Pseudomonas aeruginosa - generna acpP , lpxC och rpsJ ), (b) syntetisera enkelsträngat RNA som är komplementärt till mRNA som kodar för dessa essentiella proteiner, och (c) levererar enkelsträngat RNA till infektionsstället med användning av cellpenetrerande peptider eller liposomer . Antisens-RNA :t hybridiserar sedan med det bakteriella mRNA:t och blockerar dess translation till det essentiella proteinet. Antisens-RNA-baserad behandling har visat sig vara effektiv i in vivo - modeller av P. aeruginosa pneumoni .
Förutom att tysta essentiella bakteriegener, kan antisens-RNA användas för att tysta bakteriegener som är ansvariga för antibiotikaresistens. Till exempel har antisens-RNA utvecklats som tystar S. aureus mecA -genen (genen som kodar för modifierat penicillinbindande protein 2a och gör S. aureus - stammar meticillinresistenta ). Antisens-RNA som riktar in sig på mecA- mRNA har visat sig återställa känsligheten hos meticillinresistenta stafylokocker för oxacillin i både in vitro- och in vivo - studier.
CRISPR-Cas9-baserade behandlingar
I början av 2000-talet upptäcktes ett system som gör det möjligt för bakterier att försvara sig mot invaderande virus. Systemet, känt som CRISPR-Cas9, består av (a) ett enzym som förstör DNA ( nukleaset Cas9 ) och (b) DNA-sekvenserna från tidigare påträffade virala inkräktare ( CRISPR ). Dessa virala DNA-sekvenser gör det möjligt för nukleaset att rikta in sig på främmande (viralt) snarare än eget (bakteriellt) DNA.
Även om funktionen för CRISPR-Cas9 i naturen är att skydda bakterier, kan DNA-sekvenserna i CRISPR-komponenten i systemet modifieras så att nukleaset Cas9 riktar sig mot bakterieresistensgener eller bakteriella virulensgener istället för virusgener. Det modifierade CRISPR-Cas9-systemet kan sedan administreras till bakteriella patogener med plasmider eller bakteriofager. Detta tillvägagångssätt har framgångsrikt använts för att tysta antibiotikaresistens och minska virulensen hos enterohemorragisk E. coli i en infektionsmodell in vivo .
Minska urvalstrycket för antibiotikaresistens
Förutom att utveckla nya antibakteriella behandlingar är det viktigt att minska urvalstrycket för uppkomst och spridning av antibiotikaresistens . Strategier för att åstadkomma detta inkluderar väletablerade infektionskontrollåtgärder som förbättring av infrastrukturen (t.ex. mindre trånga bostäder), bättre sanitet (t.ex. säkert dricksvatten och mat) och vaccinutveckling, andra tillvägagångssätt som antibiotikaförvaltning och experimentella metoder som användning av prebiotika och probiotika för att förhindra infektion. Antibiotikacykling, där antibiotika alterneras av läkare för att behandla mikrobiella sjukdomar, föreslås, men nyare studier visade att sådana strategier är ineffektiva mot antibiotikaresistens.
Vacciner
Vacciner är beroende av immunmodulering eller förstärkning. Vaccination antingen exciterar eller förstärker immunkompetensen hos en värd för att avvärja infektion, vilket leder till aktivering av makrofager , produktion av antikroppar , inflammation och andra klassiska immunreaktioner. Antibakteriella vacciner har varit ansvariga för en drastisk minskning av globala bakteriella sjukdomar. Vacciner gjorda av försvagade hela celler eller lysat har till stor del ersatts av mindre reaktogena, cellfria vacciner som består av renade komponenter, inklusive kapselpolysackarider och deras konjugat, till proteinbärare, såväl som inaktiverade toxiner (toxiner) och proteiner.
Se även
Referenser
Vidare läsning
- Gould K (mars 2016). "Antibiotika: från förhistoria till idag" . Journal of Antimicrobial Chemotherapy . 71 (3): 572–5. doi : 10.1093/jac/dkv484 . PMID 26851273 .
- Davies J, Davies D (september 2010). "Ursprung och utveckling av antibiotikaresistens" . Mikrobiologi och molekylärbiologi recensioner . 74 (3): 417–33. doi : 10.1128/MMBR.00016-10 . PMC 2937522 . PMID 20805405 .
- "Antibiotika: MedlinePlus" . nih.gov . Hämtad 19 juli 2016 .
- "WHO:s första globala rapport om antibiotikaresistens avslöjar ett allvarligt, globalt hot mot folkhälsan . " VEM . Arkiverad från originalet den 30 april 2014.
- Pugh R, Grant C, Cooke RP, Dempsey G (augusti 2015). "Kort-kurs kontra långvarig antibiotikabehandling för sjukhusförvärvad lunginflammation hos kritiskt sjuka vuxna" . The Cochrane Database of Systematic Reviews (8): CD007577. doi : 10.1002/14651858.CD007577.pub3 . PMC 7025798 . PMID 26301604 .
- Giedraitienė A, Vitkauskienė A, Naginienė R, Pavilonis A (1 januari 2011). "Antibiotikaresistensmekanismer för kliniskt viktiga bakterier" . Medicina . 47 (3): 137–46. doi : 10.3390/medicina47030019 . PMID 21822035 .
externa länkar
|
Bibliotekets resurser om antibiotika |
- Antibiotika hos Curlie