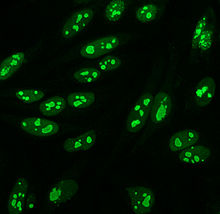
Anti-nukleär antikropp - Anti-nuclear antibody
Antinukleära antikroppar ( ANA , även känd som antinukleär faktor eller ANF ) är autoantikroppar som binder till innehållet i cellkärnan . Hos normala individer producerar immunsystemet antikroppar mot främmande proteiner ( antigener ) men inte mot humana proteiner ( autoantigener ). I vissa fall produceras antikroppar mot humana antigener.
Det finns många subtyper av ANA såsom anti-Ro antikroppar , anti-La antikroppar , anti-Sm antikroppar , anti-nRNP antikroppar , anti-Scl-70 antikroppar , anti-dsDNA antikroppar , anti-histon antikroppar , antikroppar mot kärnporekomplex , anti-centromerantikroppar och anti-sp100-antikroppar . Var och en av dessa antikroppssubtyper binder till olika proteiner eller proteinkomplex i kärnan. De finns i många sjukdomar inklusive autoimmunitet , cancer och infektion , med olika förekomst av antikroppar beroende på tillståndet. Detta möjliggör användning av ANA vid diagnos av vissa autoimmuna störningar, inklusive systemisk lupus erythematosus , Sjögrens syndrom , sklerodermi , blandad bindvävssjukdom , polymyosit , dermatomyosit , autoimmun hepatit och läkemedelsinducerad lupus .
ANA-testet upptäcker autoantikropparna som finns i en individs blodserum . De vanliga testerna som används för att detektera och kvantifiera ANA är indirekt immunfluorescens och enzymbunden immunosorbentanalys (ELISA). I immunfluorescens rapporteras nivån av autoantikroppar som en titer . Detta är den högsta utspädningen av serumet där autoantikroppar fortfarande är detekterbara. Positiva autoantikroppstitrar vid en utspädning lika med eller större än 1: 160 anses vanligtvis vara kliniskt signifikanta. Positiva titrar på mindre än 1: 160 finns hos upp till 20% av den friska befolkningen, särskilt äldre. Även om positiva titrar på 1: 160 eller högre är starkt associerade med autoimmuna störningar, finns de också hos 5% av friska individer. Autoantikroppsscreening är användbar vid diagnos av autoimmuna störningar och övervakningsnivåer hjälper till att förutsäga sjukdomsprogression. Ett positivt ANA-test är sällan användbart om andra kliniska data eller laboratoriedata som stöder en diagnos inte finns.
Immunitet och autoimmunitet
Människokroppen har många försvarsmekanismer mot patogener , varav en är humoristisk immunitet . Denna försvarsmekanism producerar antikroppar (stora glykoproteiner ) som svar på en immunstimulans. Många celler i immunsystemet krävs för denna process, inklusive lymfocyter ( T-celler och B-celler ) och antigenpresenterande celler . Dessa celler samordnar ett immunsvar vid detektering av främmande proteiner ( antigener ) och producerar antikroppar som binder till dessa antigener. I normal fysiologi genomgår lymfocyter som känner igen humana proteiner ( autoantigener ) antingen programmerad celldöd ( apoptos ) eller blir icke-funktionella. Denna självtolerans innebär att lymfocyter inte bör stimulera ett immunsvar mot humana cellulära antigener. Ibland produceras dock denna processfel och antikroppar produceras mot humana antigener, vilket kan leda till autoimmun sjukdom.
ANA-undertyper
ANA finns i många störningar, liksom hos vissa friska individer. Dessa störningar inkluderar: systemisk lupus erythematosus (SLE), reumatoid artrit , Sjögrens syndrom , skleroderma , polymyosit , dermatomyositis , primär biliär cirros , läkemedelsinducerad lupus , autoimmun hepatit , multipel skleros , diskoid lupus , sköldkörtelsjukdom , antifosfolipidsyndrom , juvenil idiopatisk artrit , psoriasisartrit , juvenil dermatomyosit , idiopatisk trombocytopenisk purpura , infektion och cancer . Dessa antikroppar kan delas upp efter deras specificitet, och varje delmängd har olika benägenheter för specifika störningar.
Extraherbara kärnantigener
Extraherbara kärnantigener (ENA) är en grupp autoantigener som ursprungligen identifierades som antikroppsmål hos personer med autoimmuna sjukdomar. De kallas ENA eftersom de kan extraheras från cellkärnan med saltlösning. ENA: erna består av ribonukleoproteiner och icke- histonproteiner , namngivna av antingen namnet på givaren som gav prototypserumet (Sm, Ro, La, Jo), eller namnet på sjukdomsinställningen där antikropparna hittades (SS- A, SS-B, Scl-70).
Anti-Ro / SS-A och anti-La / SS-B

Anti-Ro- och anti-La- antikroppar, även kända som SS-A respektive SS-B, finns ofta i primärt Sjögrens syndrom , en autoimmun sjukdom som påverkar de exokrina körtlarna . Närvaron av båda antikropparna finns i 30-60% av Sjögrens syndrom, enbart anti-Ro-antikroppar finns i 50-70% av Sjögrens syndrom och 30% av SLE med kutan involvering, och anti-La-antikroppar finns sällan i isolering . Anti-La-antikroppar finns också i SLE; Sjögrens syndrom är dock normalt också närvarande. Anti-Ro-antikroppar finns också mindre ofta i andra sjukdomar inklusive autoimmuna leversjukdomar, celiaki , autoimmuna reumatiska sjukdomar, hjärtsjukdomar, neonatal lupus erythematosus och polymyosit . Under graviditeten kan anti-Ro-antikroppar korsa moderkakan och orsaka hjärtsvikt och neonatal lupus hos spädbarn. I Sjögrens syndrom korrelerar anti-Ro- och anti-La-antikroppar med tidig debut, ökad sjukdomsvaraktighet, förstoring av parotisk körtel , sjukdom utanför körtlarna och infiltration av körtlar genom lymfocyter. Anti-Ro-antikroppar är specifika för komponenter i Ro-RNP-komplexet, innefattande 45 kDa, 52 kDa, 54 kDa och 60 kDa proteiner och RNA . Det 60 kDa DNA / RNA-bindande proteinet och 52 kDa T- cellreglerande protein är de bäst karakteriserade antigenerna av anti-Ro-antikroppar. Sammantaget är dessa proteiner en del av ett ribonukleoprotein (RNP) -komplex som associeras med hyRNA, hY1-hY5. La-antigenet är en 48 kDa- transkriptionsavslutningsfaktor för RNA-polymeras III , som associeras med Ro-RNP-komplexet.
Mekanismen för antikroppsproduktion i Sjögrens syndrom är inte helt klarlagd, men apoptos (programmerad celldöd) och molekylär mimik kan spela en roll. Ro- och La-antigenerna uttrycks på ytan av celler som genomgår apoptos och kan orsaka inflammation i spottkörteln genom interaktion med celler i immunsystemet. Antikropparna kan också produceras genom molekylär mimik, där korsreaktiva antikroppar binder till både virus och humana proteiner. Detta kan inträffa med ett av antigenerna, Ro eller La, och kan därefter producera antikroppar mot andra proteiner genom en process som kallas epitopspridning . Det retrovirala gag-proteinet visar likhet med La-proteinet och föreslås som ett möjligt exempel för molekylär mimik vid Sjögrens syndrom.
Anti-Sm
Anti-Smith (Anti-Sm) antikroppar är en mycket specifik markör för SLE. Cirka 99% av individer utan SLE saknar anti-Sm-antikroppar, men endast 20% av personer med SLE har antikropparna. De är associerade med centrala nervsystemet , njursjukdom , lungfibros och perikardit i SLE, men de är inte associerade med sjukdomsaktivitet. Antigenerna i anti-Sm-antikropparna är kärnenheterna för de små nukleära ribonukleoproteinerna (snRNP), benämnda A till G, och kommer att binda till U1, U2, U4, U5 och U6 snRNP. Vanligtvis är antikropparna specifika för B-, B'- och D-enheterna. Molekylära och epidemiologiska studier antyder att anti-Sm-antikroppar kan induceras genom molekylär mimik eftersom proteinet visar en viss likhet med Epstein-Barr-virusproteiner .
Anti-nRNP / anti-U1-RNP
Anti-nukleära ribonukleoprotein (anti-nRNP) antikroppar , även kända som anti-U1-RNP antikroppar, finns i 30-40% av SLE. De finns ofta med anti-Sm-antikroppar, men de kan associeras med olika kliniska föreningar. Förutom SLE är dessa antikroppar starkt associerade med blandad bindvävssjukdom . Anti-nRNP-antikroppar känner igen A- och C-kärnenheterna i snRNP: erna och på grund av detta binder de främst till U1-snRNP. Immunsvaret mot RNP kan orsakas av presentationen av kärnkomponenterna på cellmembranet i apoptotiska blåsor. Molekylär efterlikning har också föreslagits som en möjlig mekanism för produktion av antikroppar mot dessa proteiner på grund av likheten mellan U1-RNP-polypeptider och Epstein-Barr-viruspolypeptider.
Anti-Scl-70 / anti-topoisomeras I
Anti-Scl-70-antikroppar är kopplade till sklerodermi . Känsligheten hos antikropparna för sklerodermi är ungefär 34%, men är högre för fall med diffus kutan involvering (40%) och lägre för begränsad kutan involvering (10%). Antikropparnas specificitet är 98% respektive 99,6% vid andra reumatiska sjukdomar respektive hos normala individer. Förutom sklerodermi finns dessa antikroppar hos cirka 5% av individerna med SLE. Den antigena mål för anti-Scl-70 antikroppar är topoisomeras I .
Anti-Jo-1
Även om anti-Jo-1-antikroppar ofta ingår i ANA, är de faktiskt antikroppar mot det cytoplasmiska proteinet, Histidyl-tRNA-syntetas - ett aminoacyl-tRNA-syntetas som är viktigt för syntesen av histidinbelastat tRNA. De är starkt associerade med polymyosit och dermatomyosit och finns sällan i andra bindvävssjukdomar. Cirka 20–40% av polymyosit är positivt för Jo-1-antikroppar och de flesta kommer att ha interstitiell lungsjukdom, HLA-DR3 och HLA-DRw52 human leukocytantigen (HLA) markörer; kollektivt kallat Jo-1 syndrom.
Anti-dsDNA
Anti-dubbelsträngat DNA (anti-dsDNA) antikroppar är starkt associerade med SLE. De är en mycket specifik markör för sjukdomen, med vissa studier som citerar nästan 100%. Uppgifter om känslighet varierar från 25 till 85%. Anti-dsDNA-antikroppsnivåer, kända som titrar, korrelerar med sjukdomsaktivitet i SLE; höga nivåer indikerar mer aktiv lupus. Närvaron av anti-dsDNA-antikroppar är också kopplad till lupus nefrit och det finns bevis för att de är orsaken. Vissa anti-dsDNA-antikroppar är korsreaktiva med andra antigener som finns på glomerulärt källarmembran (GBM) i njuren, såsom heparansulfat , kollagen IV, fibronektin och laminin . Bindning till dessa antigener i njurarna kan orsaka inflammation och komplettera fixering , vilket resulterar i njurskador. Förekomst av höga DNA-bindande och låga C3- nivåer har visat sig ha extremt högt prediktivt värde (94%) för diagnos av SLE. Det är också möjligt att anti-dsDNA-antikropparna internaliseras av celler när de binder membranantigener och sedan visas på cellytan. Detta kan främja inflammatoriska reaktioner av T-celler i njuren. Det är viktigt att notera att inte alla anti-dsDNA-antikroppar är associerade med lupus nefrit och att andra faktorer kan orsaka detta symptom i frånvaro. Antigenet av anti-dsDNA-antikroppar är dubbelsträngat DNA .
Antihistonantikroppar
Antihistonantikroppar finns i serum hos upp till 75–95% av personer med läkemedelsinducerad lupus och 75% av idiopatisk SLE. Till skillnad från anti-dsDNA-antikroppar i SLE fixerar inte dessa antikroppar komplement. Även om de oftast finns i läkemedelsinducerad lupus, finns de också i vissa fall av SLE, sklerodermi , reumatoid artrit och odifferentierad bindvävssjukdom . Många läkemedel är kända för att orsaka läkemedelsinducerad lupus och de producerar olika antigena mål i nukleosomen som ofta är korsreaktiva med flera histonproteiner och DNA. Prokainamid orsakar en form av läkemedelsinducerad lupus som producerar antikroppar mot histon H2A och H2B-komplexet.
Anti-gp210 och anti-p62
Både anti-glykoprotein-210 (anti-gp210) och anti-nukleoporin 62 (anti-p62) antikroppar är antikroppar mot komponenter i kärnmembranet och finns i primär gallcirros (PBC). Varje antikropp finns i cirka 25-30% av PBC. Antigenerna i båda antikropparna är beståndsdelar i kärnmembranet . gp210 är ett 200 kDa protein involverat i förankring av komponenter i kärnporer till kärnmembranet. P62-antigenet är ett kärnporekomplex på 60 kDa.
Anticentromerantikroppar
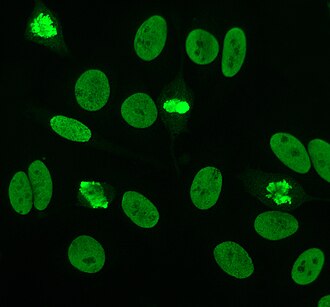
Anticentromerantikroppar är associerade med begränsad kutan systemisk skleros, även känd som CREST-syndrom , primär biliär cirros och proximal sklerodermi. Det finns sex kända antigener, som alla är associerade med centromeren ; CENP-A till CENP-F. CENP-A är ett 17 kDa histon H3- liknande protein. CENP-B är ett 80 kDa DNA-bindande protein involverat i vikningen av heterokromatin . CENP-C är ett 140 kDa protein involverat i kinetochore- montering. CENP-D är ett 50 kDa-protein med okänd funktion, men kan vara homologt med ett annat protein som är involverat i kromatinkondensation , RCC1 . CENP-E är ett 312 kDa-protein från kinesinmotorproteinfamiljen . CENP-F är ett 367 kDa-protein från kärnmatrisen som associeras med kinetokoren i sen G2-fas under mitos. CENP-A-, B- och C-antikroppar finns oftast (16–42% av systemisk skleros) och är associerade med Raynauds fenomen, telangiektasier , lunginvolvering och tidig debut vid systemisk skleros.
Anti-sp100
Anti-sp100-antikroppar finns i cirka 20–30% av den primära gallcirros (PBC). De finns hos få individer utan PBC och är därför en mycket specifik markör för sjukdomen. Sp100-antigenet finns i kärnkroppar; stora proteinkomplex i kärnan som kan ha en roll i celltillväxt och differentiering.
Anti-PM-Scl
Anti-PM-Scl-antikroppar finns i upp till 50% av polymyosit / systemisk skleros (PM / SSc) -överlappningssyndrom . Cirka 80% av individerna med antikroppar i blodserumet kommer att ha störningen. Närvaron av antikropparna är kopplad till begränsad kutan involvering av PM / SSc-överlappningssyndrom. De antigena målen för antikropparna är komponenter i det RNA- bearbetande exosomkomplexet i kärnan . Det finns tio proteiner i detta komplex och antikroppar mot åtta av dem finns med varierande frekvenser; PM / Scl-100 (70-80%), PM / Scl-75 (46-80%), hRrp4 (50%), hRrp42 (21%), hRrp46 (18%), hCs14 (14%), hRrp41 ( 10%) och hRrp40 (7%).
Anti-DFS70-antikroppar
Anti-DFS70-antikroppar genererar ett tätt fint fläckigt mönster i indirekt immunfluorescens och finns i normala och under olika förhållanden, men är inte associerade med en systemisk autoimmun patologi. Därför kan de användas för att hjälpa till att utesluta sådana tillstånd hos ANA-positiva individer. Ett betydande antal patienter diagnostiseras som systemisk lupus erythematosus eller odifferentierad bindvävssjukdom till stor del baserat på en positiv ANA. Om ingen definierad autoantikropp kan detekteras (t.ex. anti-ENA-antikroppar) rekommenderas testning av anti-DFS70-antikroppar för att verifiera diagnosen. Anti-DFS70-antikroppstest finns som CE-märkta tester. Hittills är ingen FDA-godkänd analys tillgänglig.
ANA-test

Närvaron av ANA i blod kan bekräftas med ett screeningtest. Även om det finns många tester för detektion av ANA, är de vanligaste testerna som används för screening indirekt immunfluorescens och enzymbunden immunosorbentanalys (ELISA). Efter detektering av ANA bestäms olika undertyper.
Indirekt immunfluorescens
Indirekt immunfluorescens är ett av de vanligaste testerna för ANA. Vanligtvis används HEp-2-celler som ett substrat för att detektera antikropparna i humant serum. Mikroskopglasen beläggs med HEp-2-celler och serumet inkuberas med cellerna. Om nämnda och riktade antikroppar är närvarande så kommer de att binda till antigenerna på cellerna; i fallet med ANA, kommer antikropparna att binda till kärnan. Dessa kan visualiseras genom att lägga till en fluorescerande märkt (vanligtvis FITC eller rodopsin B) anti-human antikropp som binder till antikropparna. Molekylen kommer att fluorescera när en specifik våglängd lyser på den, vilket kan ses under mikroskopet. Beroende på antikroppen som finns i det humana serumet och lokaliseringen av antigenet i cellen, kommer distinkta fluorescensmönster att ses på HEp-2-cellerna. Nivåerna av antikroppar analyseras genom att utföra utspädningar på blodserum. Ett ANA-test anses vara positivt om fluorescens ses vid en titer av 1: 40/1: 80. Högre titrar är mer kliniskt signifikanta eftersom låga positiva (≤1: 160) finns hos upp till 20% av friska individer, särskilt äldre. Endast cirka 5% av den friska befolkningen har ANA-titrar på 1: 160 eller högre.
HEp-2
Fram till omkring 1975, när HEp-2-celler introducerades, användes djurvävnad som standardsubstrat för immunfluorescens. HEp-2-celler är för närvarande ett av de vanligaste substraten för ANA-detektering genom immunfluorescens.
Ursprungligen startade en struphuvudstam, cellinjen förorenades och fördrevs av HeLa- celler och har nu identifierats som HeLa-celler.
De är överlägsna de tidigare använda djurvävnaderna på grund av sin stora storlek och den höga graden av mitos (celldelning) i cellinjen . Detta möjliggör detektering av antikroppar mot mitosspecifika antigener, såsom centromerantikroppar. De möjliggör också identifiering av anti-Ro-antikroppar, eftersom aceton används för fixering av cellerna (andra fixeringsmedel kan tvätta bort antigenet).
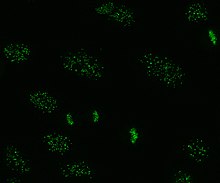
Det finns många kärnfärgningsmönster som ses på HEp-2-celler: homogena, prickade, nukleolära, kärnmembranösa, centromera, nukleära prickar och pleomorfa. Den homogena mönstret sett när de kondenserade kromosomer och interfas kromatin fläcken. Detta mönster är associerat med anti-dsDNA-antikroppar , antikroppar mot nukleosomala komponenter och anti-histonantikroppar. Det finns två prickade mönster: fina och grova. Den fina spräckliga mönstret har fin nukleär färgning med ofärgade metafas kromatin, som är associerad med anti-Ro och anti-La-antikroppar. Det grova färgningsmönstret har grov kornig kärnfärgning orsakad av anti-U1-RNP- och anti-Sm-antikroppar. Nukleolärt färgningsmönster är associerat med många antikroppar inklusive anti-Scl-70, anti-PM-Scl, anti-fibrillarin och anti-Th / To. Kärnmembranfärgning framträder som en fluorescerande ring runt cellkärnan och produceras av anti-gp210- och anti-p62-antikroppar. Centromermönstret visar flera nukleära punkter i interfas- och mitotiska celler, vilket motsvarar antalet kromosomer i cellen. Kärnprickmönster visar mellan 13 och 25 nukleära punkter i interfasceller och produceras av anti- sp100- antikroppar. Pleomorft mönster orsakas av antikroppar mot det prolifererande kärnantigenet . Indirekt immunfluorescens har visat sig vara något överlägsen jämfört med ELISA vid detektion av ANA från HEp-2-celler.
Crithidia luciliae
Crithidia luciliae är hemoflaggelat- encelliga protister . De används som ett substrat vid immunfluorescens för detektion av anti-dsDNA-antikroppar. De har en organell som kallas kinetoplasten som är en stor mitokondrion med ett nätverk av sammankopplade cirkulära dsDNA-molekyler. Efter inkubering med serum innehållande anti-dsDNA-antikroppar och fluorescerande märkta anti-humana antikroppar kommer kinetoplasten att fluorescera. Bristen på andra kärnantigener i denna organell innebär att användning av C.luciliae som substrat möjliggör specifik detektion av anti-dsDNA-antikroppar.
ELISA
Enzymkopplad immunosorbentanalys (ELISA) använder antigenbelagda mikrotiterplattor för detektion av ANA. Varje brunn i en mikrotiterplatta är belagd med antingen ett enda antigen eller flera antigener för att detektera specifika antikroppar eller för att screena för ANA. Antigenerna är antingen från cellextrakt eller rekombinanta. Blodserum inkuberas i plattans brunnar och tvättas ut. Om antikroppar som binder till antigen finns kvar kommer de att förbli efter tvätt. En sekundär anti-human antikropp konjugerad till ett enzym såsom pepparrotsperoxidas tillsättes. Enzymreaktionen kommer att ge en färgförändring av lösningen som är proportionell mot mängden antikropp bunden till antigenet. Det finns signifikanta skillnader i detektionen av ANA genom immunfluorescens och olika ELISA-kit och det finns bara en marginell överensstämmelse mellan dessa. En kliniker måste känna till skillnaderna för att kunna utvärdera resultaten av de olika analyserna.
Känslighet
Följande tabell listar känsligheten hos olika typer av ANA för olika sjukdomar.
| ANA-typ | Målantigen | Känslighet (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| SLE | Läkemedelsinducerad LE | Diffus systemisk skleros | Begränsad systemisk sklerodermi | Sjögrens syndrom | Inflammatorisk myopati | MCTD | ||
| Alla ANA: er (av indirekt IF ) |
Olika | 95 | 100 | 80 | 80 | 70 | 40–60 | 95 |
| Anti-dsDNA | DNA | 60 | - | - | - | 30 | - | - |
| Anti-Sm | Kärnproteiner av snRNP | 40 | - | - | - | - | - | - |
| Antihiston | Histoner | 60 | 90 | - | - | - | - | - |
| Anti Scl-70 | Typ I topoisomeras | - | - | 20 | 10 | - | - | - |
| Anticentromer | Centromera proteiner | - | - | 30 | 80 | - | - | - |
| SS-A (Ro) | RNP | 40 | - | - | - | 50 | 10 | - |
| SS-B (La) | RNP | 10–15 | - | - | - | 60–90 | - | |
| - = mindre än 5% känslighet | ||||||||
Vissa ANA förekommer i flera typer av sjukdomar, vilket resulterar i lägre specificitet av testet. Till exempel har IgM- reumatoid faktor (IgM-RF) visats korsreagera med ANA vilket ger falskt positiv immunfluorescens . Positiva ANA- och anti-DNA-antikroppar har rapporterats hos patienter med autoimmun sköldkörtelsjukdom . ANA kan ha ett positivt testresultat hos upp till 45% av personer med autoimmuna sköldkörtelförhållanden eller reumatoid artrit och upp till 15% av personer med HIV eller hepatit C . Enligt Lupus Foundation of America "kommer cirka 5% av befolkningen i allmänhet att ha en positiv ANA. Men minst 95% av de människor som har en positiv ANA har inte lupus. Ett positivt ANA-test kan ibland köras i familjer, även om familjemedlemmar inte har några bevis för lupus. " Å andra sidan säger de, även om 95% av patienterna som faktiskt har lupus testar positivt för ANA, "Bara en liten andel har en negativ ANA, och många av dem har andra antikroppar (såsom antifosfolipidantikroppar , anti- Ro, anti-SSA) eller deras ANA omvandlat från positivt till negativt från steroider , cytotoxiska läkemedel eller uremi (njursvikt). "
Historia
Den LE-cell upptäcktes i benmärgen i 1948 av Hargraves et al. 1957 Holborow et al. visade först ANA med indirekt immunfluorescens. Detta var den första indikationen på att processer som påverkar cellkärnan var ansvariga för SLE. 1959 upptäcktes att serum från individer med SLE innehöll antikroppar som fälldes ut med saltlösningsextrakt av kärnor, kända som extraherbara nukleära antigener (ENA). Detta ledde till karakterisering av ENA-antigener och deras respektive antikroppar. Således upptäcktes anti-Sm- och anti-RNP-antikroppar 1966 respektive 1971. På 1970-talet upptäcktes anti-Ro / anti-SS-A och anti-La / anti-SS-B antikroppar. Scl-70-antikroppen var känd för att vara en specifik antikropp mot sklerodermi 1979, men antigenet (topoisomeras-I) karakteriserades inte förrän 1986. Jo-1-antigenet och antikroppen karakteriserades 1980.
Se även
Referenser
externa länkar
- Autoimmunitetsblogg - HEp-2 ANA-sammanfattning
- Antinukleära + antikroppar på US National Library of Medicine Medical Subject Headings (MeSH)
- Greidinger, Eric L .; Hoffman, DO; Robert W. (31 januari 2003). "CE-uppdatering [kemi | immunologi]: Antinukleär antikroppstest: Metoder, indikationer och tolkning" . Laboratoriemedicin . 34 (2): 113–117. doi : 10.1309 / VUB90VTPMEWV3W0F .