Lymfangioleiomyomatos - Lymphangioleiomyomatosis
| Lymphangioleiomyomatosis (LAM) | |
|---|---|
| Andra namn | lymfangiomyomatos, LAM |
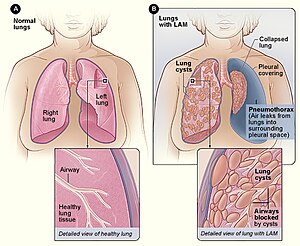 | |
| Figur A visar lungornas och luftvägarnas placering i kroppen. Den infällda bilden visar ett tvärsnitt av en frisk lunga. Figur B visar en vy av lungorna med LAM och en kollapsad lunga ( pneumothorax ). Den infällda bilden visar ett tvärsnitt av en lunga med LAM. | |
| Specialitet |
Pulmonologi |
Lymphangioleiomyomatosis ( LAM ) är en sällsynt, progressiv och systemisk sjukdom som vanligtvis leder till cystisk lungförstöring. Det drabbar främst kvinnor, särskilt under de fertila åren. Termen sporadisk LAM används för patienter med LAM som inte är associerade med tuberös skleroskomplex (TSC), medan TSC-LAM hänvisar till LAM som är associerat med TSC.
tecken och symtom
Medelåldern för början är tidigt till mitten av 30 -talet. Ansträngningsdyspné (andnöd) och spontan pneumotorax (lungkollaps) har rapporterats som den första presentationen av sjukdomen hos 49% respektive 46% av patienterna.
Diagnosen är vanligtvis försenad 5 till 6 år. Tillståndet diagnostiseras ofta som astma eller kronisk obstruktiv lungsjukdom . Den första pneumotoraxen , eller lungkollaps, föregår diagnosen LAM hos 82% av patienterna. Den kliniska konsensusdefinitionen av LAM innehåller flera symptom:
- Trötthet
- Hosta
- Hosta blod (sällan massivt)
- Bröstsmärta
- Chylouskomplikationer som härrör från lymfatisk obstruktion, inklusive
- Chylothorax
- Chylous ascites
- Kyloperikard
- Kyloptys
- Chyluria
- Chyle i vaginal urladdning
- Chyle i pallen.
- Angiomyolipom (feta njurtumörer) finns hos cirka 30% av patienterna med sporadiskt LAM och upp till 90% av patienterna med TSC-LAM. Angiomyolipom kan ibland spontant blöda och orsaka smärta eller lågt blodtryck .
- Cystiska lymfangiom eller lymfkörtlar med hypodenscentra som efterliknar nekrotiserande lymfom, äggstockscancer eller njurcancer eller andra maligniteter kan uppstå i retroperitoneum, bäcken eller mediastinum.
Lungdestruktion i LAM är en följd av diffus infiltrering av neoplastiska glattmuskelliknande celler som invaderar alla lungstrukturer inklusive lymfatik , luftväggar, blodkärl och interstitiella utrymmen . Konsekvenserna av kärl- och luftvägsobstruktion inkluderar ackumulering av chylousvätska, hemoptys , luftflödesobstruktion och pneumotorax . Det typiska sjukdomsförloppet uppvisar progressiv dyspné vid ansträngning, åtskilt av återkommande pneumotorace och hos vissa patienter, chylous pleural effusion eller ascites.
De flesta människor har dyspné vid ansträngning med dagliga aktiviteter med 10 år efter symtomdebut. Många patienter behöver kompletterande syre över det intervallet.
Genetik
LAM förekommer i två inställningar: i sjukdomen tuberös skleroskomplex (TSC-LAM) och i en sporadisk form, hos kvinnor som inte har TSC (sporadisk LAM). I båda inställningarna indikerar genetiska bevis på att LAM orsakas av inaktiverande eller "förlust av funktion" -mutationer i TSC1- eller TSC2 -generna, som klonades 1997 respektive 1993. TSC1 -genen finns på kromosom 9 (9q34) långa arm och TSC2 -genen är lokaliserad på den korta armen i kromosom 16 (16p13). TSC-LAM förekommer hos kvinnor som har könsmutationer i antingen TSC1- eller TSC2-genen.
Sporadiskt LAM är främst associerat med somatiska TSC2 -genmutationer. Germline och somatiska mutationer i LAM inkluderar många typer av mutationer spridda över generna, utan tydliga "hot spots", inklusive missense-förändringar, raderingar i ramen och nonsensmutationer. På grund av genernas stora storlek (tillsammans har de mer än 60 exoner) och eftersom mutationer kan lokaliseras praktiskt taget var som helst inom generna, är mutationsdetektering ofta utmanande.
På cellulär basis bär LAM-celler bi-allel inaktivering av TSC2-generna, i överensstämmelse med "två-träff" tumörsuppressorgenmodellen. Den andra träffhändelsen i LAM-celler är ofta förlust av den kromosomala regionen som innehåller vildtypskopian av TSC2-genen; detta kallas förlust av heterozygositet eller LOH. LOH kan detekteras i mikrodissekterade LAM -celler, i angiomyolipom och lymfkörtlar från kvinnor med LAM och i cirkulerande LAM -celler (celler i blod och urin).
Angiomyolipom och lung -LAM -celler från kvinnor med sporadisk form av LAM bär identiska mutationer i TSC2. Detta, tillsammans med det faktum att återkommande LAM efter lungtransplantation bär samma TSC2 -mutationer som det ursprungliga LAM, har lett till "godartad metastas" -hypotesen att LAM -celler kan migrera eller metastasera från en plats till en annan.
Patofysiologi
En variabel procentandel av celler i LAM -lesionen innehåller mutationsinaktivering av tumörsuppressorgener av tuberös skleroskomplex (TSC1 eller TSC2). TSC1 -mutationer orsakar en mindre allvarlig klinisk fenotyp än TSC2 -mutationer. Upptäckten av TSC1/2 -genfunktionen som negativ regulator av däggdjursmålet för rapamycinkomplex 1 (mTORC1) ledde till framgångsrik användning av rapamycinanalog sirolimus i kliniska prövningar och FDA -godkännande av sirolimus för behandling av LAM.
TSC1 och TSC2 bildar ett tumörsuppressorkomplex som reglerar däggdjursmål för rapamycin (mTOR) signaleringskomplex genom att direkt styra aktiviteten hos det lilla GTPase Rheb via GTPase -aktiverande protein (GAP) -domänen för TSC2. Rheb binder till Raptor och styr aktiviteten hos mTOR-komplex 1 (mTORC1) som direkt fosforylerar p70 S6- kinas (S6K1) och 4E-BP1. mTOR bildar två fysiskt och funktionellt distinkta multiproteinkomplex: det rapamycinkänsliga mTORC1 och det rapamycinokänsliga mTORC2. MTORC1 består av fem proteiner inklusive Raptor som positivt reglerar mTOR -aktivitet. MTORC2 består av sex proteiner inkluderande mTOR och Rictor , som definierar aktiveringsnivå av mTORC2 och modulerar hopsättningen av aktin cytoskelettet genom Rho GTPaser, och RAC1 krävs för mTOR aktivering. I TSC2-null och humana LAM-celler krävs Rho GTPas-aktivitet för celladhesion, motilitet, proliferation och överlevnad. Förlust av TSC1/TSC2 i LAM inducerar okontrollerad LAM -celltillväxt och ökar LAM -cellens livskraft. Uppreglering av STAT1 och STAT3 och autofagi är kända förmedlare av LAM -cellens livskraft och överlevnad.
LAM -celler beter sig på många sätt som metastatiska tumörceller. LAM -celler verkar uppstå från en extrapulmonell källa och migrerar till lungan. Ökad LAM-cellmigration och invasivitet räddas av TSC2-återuttryck. De cellulära och molekylära mekanismerna för neoplastisk transformation och lungparenkymdestruktion av LAM -celler är fortfarande okända. Lungreformering kan förmedlas av en obalans mellan matrisnedbrytande metalloproteinaser (MMP) och deras endogena hämmare TIMP. Den invasiva cellfenotypen i LAM är associerad med TIMP-3 nedreglering och TSC2-beroende uppreglering av MMP.
Kliniska och histopatologiska bevis visar det lymfatiska engagemanget i LAM. Den rådande hypotesen är att LAM -lesioner utsöndrar den lymfangiogena faktorn VEGF -D, rekryterar lymfatiska endotelceller (LEC) som bildar lymfkärl och inducerar lungcystor. Serumnivåerna i VEGF-D ökar i LAM jämfört med andra cystiska lungsjukdomar, inklusive lung-Langerhans cellhistiocytos , emfysem, Sjögrens syndrom eller Birt – Hogg – Dubé syndrom . VEGF-D-nivåer korrelerar med svårighetsgraden av LAM, utvärderat som ett mått på CT-kvalitet (överflöd av chylousutgjutningar och lymfatisk involvering). VEGF-D är ett utsöndrat homodimärt glykoprotein och en medlem av VEGF-familjen av tillväxtfaktorer, är känd för sin roll i cancerlymfangiogenes och metastasering . Proteolytisk bearbetning av VEGF-D påverkar kognitiv bindning till VEGFR3. Histopatologiskt omges LAM-lesioner av celler som färgas för VEGFR 3, lymfkärlets endoteliala hyaluronanreceptor 1 (LYVE-1) och podoplanin . VEGF-D binder till receptorprotein tyrosinkinaserna VEGFR-2 och VEGFR-349 hos människor och till VEGFR3 hos möss. Överraskande nog har knock-out av VEGF-D hos möss liten effekt på lymfsystemet. Under tumorigenes främjar dock VEGF-D bildandet av tumörlymfatiska kärl och underlättar metastatisk spridning av cancerceller. Det är dock lite känt om en roll av onormala lymfatiker och VEGF-D vid LAM- patogenes .
Diagnos
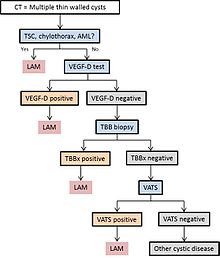
LAM kan komma till läkarvård på flera sätt, varav de flesta utlöser en CT på bröstet. Tunnväggig cystisk förändring i lungorna kan hittas för övrigt på CT-skanningar av hjärtat, bröstet eller buken (på snitt som inkluderar lungbaser) som erhållits för andra ändamål. HRCT hos TSC -patienter avslöjar att cirka 20% av kvinnorna har cystisk förändring vid 20 års ålder och cirka 80% av kvinnorna har cystiska förändringar efter 40 års ålder. LAM avslöjas ibland av bröst -CT hos patienter som uppvisar en uppenbar primär spontan pneumotorax, men mer ofta beställs inte CT -skanning (i USA) förrän upprepningar inträffar. Progressiv dyspné vid ansträngning utan de exacerbationer och remissioner som är karakteristiska för astma eller KOL leder ibland till en CT på bröstet. En granskning av CT av en expert som känner till LAM kan öka diagnostisk noggrannhet. Chylothorax kan också uppmärksamma LAM.
I vissa fall kan en LAM-diagnos göras med förtroende av kliniska skäl (utan biopsi ) hos patienter med typiska cystiska förändringar vid högupplöst CT-skanning av lungan och resultat av tuberös skleros, angiomyolipom , lymfangioleiomyom, chylothorax eller serum VEGF-D> 800 pg/ml.
Om ingen av dessa kliniska egenskaper finns, kan en biopsi vara nödvändig för att ställa diagnosen. Videoassisterad torakoskopisk lungbiopsi är den mest definitiva tekniken, men transbronkial biopsi har ett utbyte på över 50% och kan också vara effektivt. Säkerheten för det senare förfarandet hos patienter med diffus cystisk sjukdom och den mängd cystisk förändring som förutsäger en informativ biopsi är emellertid ofullständigt förstått. Cytologi av chylousvätskor, aspirerade bukenoder eller lymfmassor kan också vara diagnostiska.
Diagram 1 beskriver en föreslagen algoritm för diagnos av LAM.
Bröströntgen
Den lungröntgen kan verka relativt normal, även sent i sjukdomen, eller kan bara föreslå hyperinflation. När sjukdomen fortskrider visar bröstet röntgenbild ofta diffusa, bilaterala och symmetriska retikulonodulära opaciteter, cystor, bullae eller ett "honungskaka" (dvs pseudofibrotiskt) utseende. Pleural effusion och pneumothorax kan vara uppenbara. Bevarande av lungvolymer i närvaro av ökade interstitiella markeringar är ett radiografiskt kännetecken för LAM som hjälper till att skilja det från de flesta andra interstitiella lungsjukdomar, där alveolär septal och interstitiell expansion tenderar att öka lungans elastiska rekylegenskaper och minskade lungvolymer.
Datortomografi
Den högupplösta datortomografi (HRCT) bröstscanningen är bättre än bröstet för att upptäcka cystisk parenkymal sjukdom och är nästan alltid onormal vid diagnosen, även när bröstradiograf och lungfunktionsbedömningar är normala. Den typiska CT visar diffusa runda, bilaterala, tunnväggiga cystor i olika storlekar från 1 till 45 mm i diameter. Antalet cystor varierar i LAM från några få till nästan fullständigt byte av normal lungvävnad. Mycket av cystor tenderar att vara mildare hos patienter med TSC-LAM än S-LAM, kanske delvis förklarat eftersom TSC-LAM-patienter vanligtvis får tidigare screening. Pleural effusion ses på CT hos 12% av patienterna med S-LAM och 6% av patienterna med TSC-LAM. Andra CT -funktioner inkluderar linjära densiteter (29%), hilar eller mediastinal lymfadenopati (9%), pneumothorax, lymfangiomyom och utvidgning av thoraxkanalen. Oklarheter i slipat glas (12%) tyder på förekomst av interstitiellt ödem på grund av lymfatisk överbelastning. Hos patienter med TSC, kan nodulära densiteter på HRCT representerar multifokal micronodular pneumocyt hyperplasi (mmpH) som består av kluster av hyperplastiska typ Il-pneumocyter. MMPH kan förekomma hos män eller kvinnor med TSC i närvaro eller frånvaro av LAM, men inte hos patienter med S-LAM. MMPH är normalt inte associerat med fysiologiska eller prognostiska konsekvenser, men ett fall av andningssvikt på grund av MMPH har rapporterats.
Ventilation-perfusion skannar
I en studie var ventilationsperfusionsskanningar onormala hos 34 av 35 LAM-patienter. Den vanligaste abnormiteten var ospecifik diffus heterogenitet , vanligtvis grovt matchad. Dessa författare beskrev också ett "ovanligt" "fläckande mönster" på perfusionsbilderna hos 74% av patienterna, bestående av "små, ofta perifera samlingar av radioisotoper".
Positronemissionstomografi
LAM- och AML-lesioner uppvisar vanligtvis inte ökat upptag av 18F-fluorodeoxiglukos vid positronemissionstomografi (PET) -skanning. Andra neoplasmer (eller källor till inflammation) bör därför övervägas i kända eller misstänkta LAM-fall där FDG-PET-resultat är positiva.
Abdominal avbildning
Abnormaliteter vid bukavbildning, såsom renal AML och förstorade lymfatiska strukturer, är också vanliga vid LAM. Fett densitet inom ett njurmassa är patognomona av AML. AML är vanligare och oftare bilaterala och stora hos patienter med TSC-LAM än hos patienter med S-LAM. AML -storlek korrelerar med förekomsten av lungcystor hos patienter med TSC. En studie CT avbildade 256 patienter med S-LAM och 67 med TSC-LAM. Renal AML var närvarande hos 32% av patienterna med S-LAM och 93% av patienterna med TSC-LAM. Lever AML var närvarande hos 2% av patienterna med S-LAM och 33% av patienterna med TSC-LAM. Ascites var ovanligt, ses hos färre än 10% av patienterna med LAM. Abdominal lymfangiomatos, som ofta innehåller både cystiska och fasta komponenter, sågs hos 29% av patienterna med S-LAM och 9% av patienterna med TSC-LAM.
Bild av centrala nervsystemet
Centrala nervsystemet abnormiteter, såsom kortikala eller subependymala knölar och astrocytom , är vanliga hos patienter med TSC, inklusive de med TSC-LAM, men finns inte hos kvinnor med S-LAM. Moss och medarbetare rapporterade att kvinnor med S-LAM och TSC-LAM kan ha en ökad förekomst av meningiom , men betydelsen av detta fynd har utmanats.
Studier av lungfunktion
Lungfunktionstestning hos patienter med LAM kan vara normal eller kan avslöja obstruktiva, restriktiva eller blandade mönster. Obstruktiv fysiologi är den vanligaste abnormiteten. Kvalitetsstyrda lungfunktionsdata samlades in prospektivt av NHLBI-registret, en femårig studie av patienter med LAM i centra runt om i USA. Spirometri avslöjade obstruktiva förändringar hos cirka 57% av patienterna och normala resultat hos 34%. Begränsning, definierad som en total lungkapacitet mindre än den nedre gränsen för det normala, sågs hos 11%. Hyperinflation var närvarande hos cirka 6%. Den genomsnittliga återstående volymen var 125% av det förutspådda när det mättes med pletysmografi, men var endast 103% av det förutspådda som bestämdes med gasutspädningsmetoder, vilket tyder på betydande luftinfångning i icke -kommunicerande luftrum. Cirka 25% av patienterna med obstruktiv fysiologi kan visa bronkdilaterande lyhördhet men kan vara mindre vid svårare obstruktion. Den obstruktiva fysiologiska defekten i LAM kan främst hänföras till luftflödesobstruktion. Den tidigaste förändringen i inledande test av lungfunktion i olika fallserier var onormal gasöverföring, bedömd av den spridande kapaciteten för kolmonoxid (DLCO), som beskrivs hos 82% till 97% av patienterna. Det är inte ovanligt att DLCO reduceras i proportion till forcerad utandningsvolym på 1 sekund (FEV1). Minskning av DLCO och ökning av kvarvarande volym anses generellt vara LAM: s tidigaste fysiologiska manifestationer.
Kardiopulmonell träningstestning i en mycket större kohort av patienter med LAM avslöjade en minskad maximal syreförbrukning ( VO 2 max ) och anaerob tröskel hos 217 patienter. Träningsinducerad hypoxemi hittades även hos patienter som inte hade viloavvikelser i FEV1 och DLCO. Hos de flesta patienter ansågs träning vara begränsad ventilation, på grund av luftflödesobstruktion och ökad dödrumsventilation.
Sjukdomsutveckling åtföljs vanligtvis av en progressiv obstruktiv ventilationsdefekt. Nedgång i FEV1 är den vanligaste parametern för att övervaka sjukdomsprogression. Även om vilande pulmonell hypertoni verkar vara ovanlig vid LAM, stiger pulmonellt arteriellt tryck ofta med låga träningsnivåer, delvis relaterade till hypoxemi. En studie rapporterade en ökning av intraparenkymala shuntar hos dyspniska patienter med LAM, vilket kan bidra till vila och träning av hypoxemi.
Patologi
Grovt sett är LAM -lungor förstorade och diffust cystiska, med vidgade luftutrymmen så stora som flera centimeter i diameter. Mikroskopisk undersökning av lungan avslöjar fokus för glatt muskelliknande cellinfiltration av lungparenkym, luftvägar, lymfatik och blodkärl i samband med områden med tunnväggig cystisk förändring. LAM-lesioner innehåller ofta ett överflöd av lymfatiska kanaler och bildar ett anastomoserat nätverk av spaltliknande utrymmen kantade av endotelceller . LAM -celler expanderar i allmänhet interstitiella utrymmen utan att kränka vävnadsplan men har observerats invadera luftvägarna, lungartären, membranet, aorta och retroperitonealt fett, för att förstöra bronkialbrosk och arteriolära väggar, och att stänga lumen i lungartioler.
Det finns två stora cellmorfologier i LAM-lesionen: små spindelformade celler och kuboidala epitelioidceller. LAM cellerna färgas positivt för glatt muskulatur aktin , vimentin , desmin , och, ofta, östrogen och progesteronreceptorer. De kuboidala cellerna i LAM-lesioner reagerar också med en monoklonal antikropp som kallas HMB-45, utvecklad mot det premelanosomala proteinet gp100, ett enzym i melanogenesvägen. Denna immunhistokemiska markör är mycket användbar diagnostiskt, eftersom andra glattmuskel -dominerande skador i lungan inte reagerar med antikroppen. De spindelformade cellerna i LAM-lesionen prolifererar oftare cellkärnantigen positivt än de kuboidala cellerna, i överensstämmelse med en proliferativ fenotyp. Jämfört med cigarrformade normala glatta muskelceller innehåller spindelformade LAM-celler mindre cytoplasma och är mindre eosinofila. Östrogen- och progesteronreceptorer finns också i LAM -lesioner, men inte i angränsande normal lungvävnad. LAM-lesioner uttrycker lymfatiska markörer LYVE-1, PROX1, podoplanin och VEGFR-3. De glattmuskulära cellerna i AML är morfologiskt och immunhistokemiskt lik LAM-celler, inklusive reaktivitet med antikroppar riktade mot aktin, desmin, vimentin och HMB-45 samt östrogen- och progesteronreceptorer. Till skillnad från de vidgade luftrummen vid emfysem kan de cystiska utrymmen som finns i LAM vara delvis kantade med hyperplastiska typ II -celler.
Behandling
Ett FDA-godkänt läkemedel för behandling av LAM, mTOR- hämmaren sirolimus , är tillgänglig för stabilisering av lungfunktionsnedgång. Lungtransplantation är fortfarande den sista utvägen för patienter med avancerad sjukdom.
Pneumothorax
Pneumothoraces hos LAM -patienter tenderar att återkomma, särskilt efter konservativ behandling som observation, aspiration eller enkel tubbröstkostomi. Över 65% av LAM -patienterna utvecklar pneumothorax under sin sjukdom, i genomsnitt 3,5 pneumothoraces hos dem som har minst en pneumothorax. LAM Foundation Pleural Consensus Group förespråkade användning av en pleural symfysprocedur med den första pneumotoraxen, med tanke på mer än 70% risk för återfall. Kemisk skleros, mekanisk nötning, talkpoudrage och pleurektomi har varit effektiva hos patienter med LAM, men mekanisk nötning föredras för dem som kan behöva lungtransplantation i framtiden. Ungefär hälften av LAM -patienter som har genomgått transplantation har tidigare haft pleurodesis och mer än 75% av dem hade tidigare bilateral pleurodes . Även om pleurodesis inte är en kontraindikation för transplantation, kan det resultera i ökad perioperativ blödning.
Chylothorax
Chyle orsakar i allmänhet inte pleural inflammation eller fibros. Små stabila chylouseffusioner kräver sällan ingrepp när LAM -diagnosen är gjord. Andfåddhet kan orsaka eventuell upprepad dränering. Sirolimus är effektivt för chylousutgjutning och de flesta experter anser att det bör användas som den första behandlingslinjen. Avbildning av källan till läckan med tung T2-vägd MR eller kontrastlymfangiografi rekommenderas för eldfasta effusioner. Vissa läckor kan emboliseras genom katetrar som trätts från ljumske lymfkörtlar in i bröstkanalen . Bröstkanalligering kan övervägas, men eftersom bröstkorgsutbrott ibland härrör från ascites som sippras in i bröstet genom bröstkorgens bälgverkan, är det viktigt att utesluta en bukkälla innan du överväger detta alternativ. Pleuralsymfys kan krävas för att förhindra närings- och lymfocytbrister som kan uppstå vid upprepade kranar eller ihållande dränering. Kemisk pleurodes är i allmänhet en effektiv behandling för chylothorax, liksom mekanisk nötning och talkpoudrage.
Angiomyolipom
Njur angiomyolipom (AML) kan kräva embolisering eller kauterisation för kontroll av blödning, en komplikation som är tänkt att vara vanligare när tumördiameter överstiger 4 cm. Omfattningen av aneurysmal förändring kan avgöra blödningsrisken. Seriell bukavbildning bör utföras för att bedöma AML-storlek med 6--12 månaders intervall, åtminstone tills tillväxttrenderna är tydliga. Nephronbesparande partiella resektioner kan övervägas för mycket stora tumörer. Nefrektomi krävs ibland för tumörer med intravaskulär förlängning eller av andra skäl, men är sällan det valda tillvägagångssättet för AML som kan hanteras med mindre invasiva medel. Everolimus är godkänt av US Food and Drug Administration (FDA) för AML -behandling.
Lymfangioleiomyom
Lymphangioleiomyomatoses är vätskefyllda hypodensa strukturer som finns i de retroperitoneala områdena i buken och bäckenet hos cirka 30% av LAM-patienterna. De kräver i allmänhet inte ingripande. Biopsi eller resektion kan leda till långvarigt läckage. mTOR -hämmare är effektiva för att krympa storleken på lymfangioleiomyomatos och kan leda till total upplösning.
Management-annat
Östrogeninnehållande läkemedel kan förvärra LAM och är kontraindicerade. Medel som motverkar effekterna av östrogen har inte visat sig vara effektiva för behandling, men inga korrekta försök har gjorts. En prövning av bronkodilatatorer bör övervägas hos LAM -patienter, eftersom upp till 17% till 25% har bronkodilaterande reaktion på luftflödesobstruktion. Syre bör administreras för att bibehålla mängder oxihemoglobin över 90% med vila, träning och sömn. Bondensitometri bör övervägas hos alla patienter som är immobiliserade och/eller på antiöstrogenbehandlingar och lämplig terapi inledd för osteoporotiska patienter. Korrekt uppmärksamhet bör ägnas åt kardiovaskulär hälsa efter naturlig eller inducerad klimakteriet . Vaccinationer mot pneumokocker och influensa bör hållas uppdaterade. Lungrehabilitering verkar vara särskilt givande hos unga, motiverade patienter med obstruktiv lungsjukdom, men studier för att bedöma detta ingrepps effekt på träningstolerans, konditionering och livskvalitet har inte gjorts.
Medicin
Sirolimus är en mTOR -hämmare som stabiliserar lungfunktionen och förbättrar vissa livsmått hos LAM -patienter. Det är godkänt av FDA för användning i LAM, baserat på resultaten från Multicenter International LAM Efficacy and Safety of Sirolimus (MILES) Trial. MILES -data stöder användningen av sirolimus hos patienter som har onormal lungfunktion (dvs. FEV1 <70% förutsagt). Om fördelarna med behandlingen uppväger riskerna för asymptomatiska LAM -patienter med normal lungfunktion är inte klart, men vissa läkare överväger behandling för sjunkande patienter som närmar sig det onormala intervallet för FEV1. Sirolimus verkar också vara effektivt för behandling av chylousutgjutningar och lymfangioleiomyomatos. Fördelarna med sirolimus kvarstår bara medan behandlingen fortsätter. Säkerheten för långtidsbehandling har inte studerats.
Potentiella biverkningar från mTOR -hämmare inkluderar svullnad i anklarna, akne, munsår, dyspepsi , diarré, förhöjning av kolesterol och triglycerider , högt blodtryck och huvudvärk. Sirolimus pneumonit och latent malignitet är mer allvarliga problem, men förekommer sällan. Sirolimus hämmar sårläkning. Det är viktigt att stoppa behandlingen med läkemedlet i 1-2 veckor före och efter valbara ingrepp som kräver optimal sårläkning. Försiktighetsåtgärder måste vidtas för att undvika långvarig exponering för solen på grund av ökad risk för hudcancer .
Behandling med en annan mTOR-hämmare, everolimus , rapporterades i en liten, öppen studie som har samband med förbättring av FEV1 och sex minuters gångavstånd. Serumnivåer av VEGF-D och kollagen IV reducerades genom behandling. Biverkningar var generellt förenliga med de som är kända för att vara associerade med mTOR -hämmare, även om vissa var allvarliga och inkluderade perifert ödem , lunginflammation, hjärtsvikt och Pneumocystis jirovecii -infektion. Eskalerande doser av everolimus användes, upp till 10 mg per dag; högre än vad som vanligtvis används kliniskt för LAM.
Serum-VEGF-D-koncentration är användbar, prediktiv och prognostisk biomarkör. Högre baslinje-VEGF-D-nivåer förutsäger snabbare sjukdomsprogression och ett mer robust behandlingssvar.
Hormonella metoder för behandling har aldrig testats i riktiga försök. I avsaknad av bevisad nytta rekommenderas inte behandling med progesteron , GnRh -agonister (t.ex. leuprorelin , goserelin ) och tamoxifen rutinmässigt. Doxycyklin hade ingen effekt på graden av lungfunktionsnedgång i en dubbelblind studie.
Sirolimus är ofta effektivt som förstahandsbehandling för chylothorax. Om chylousläckage eller ackumuleringar kvarstår trots behandling, kan avbildning med tung T2 -vägd MR, MR -lymfangiografi eller bröstkanallymfangiografi övervägas. Pleural fusionsprocedurer kan övervägas i eldfasta fall.
Prognos
Överlevnadsuppskattningar varierar, beroende på presentationssätt eller konstaterande, och har i allmänhet stigit uppåt, troligen på grund av tidigare erkännande genom mer utbredd användning av CT -skanning. I en nyligen befolkningsbaserad kohortundersökning befanns medianöverlevnaden vara 29 år. Data från tidigare stora fallserier indikerade att 38% till 78% av patienterna var vid liv 8,5 år från det att sjukdomen började.
Patienter utvecklar vanligtvis progressiv luftflödesobstruktion. I en kohort av patienter i Storbritannien, tio år efter symtomdebut, var 55% av 77 patienter andfådda att gå på plan mark och 10% var hembundna. Den genomsnittliga årliga minskningen av FEV1 och DLCO hos 275 patienter som studerades i ett enda lungfunktionslaboratorium vid NHLBI var 75 ± 9 ml respektive 0,69 ± 0,07 ml/min/mm Hg. I andra serier från Europa var nedgången i FEV1 betydligt högre, uppskattad till cirka 100 till 120 ml/år. I MILES -studien förlorade patienter i placebogruppen 134 cc/år. Det fanns några bevis i dessa studier att nedgången i lungfunktionen korrelerar med initial DLCO, med klimakteriet status och hög baslinje VEGF-D.
Uppskattningar av medianöverlevnad varierar från 10 till 30 år, beroende på om sjukhusbaserade eller befolkningsbaserade kohorter studeras.
Epidemiologi
LAM är nästan helt begränsat till kvinnor. Medan lungcystor som överensstämmer med LAM rapporteras hos vissa män med tuberös skleros, utvecklar väldigt få av dessa män symptom. Förekomsten av LAM uppskattas med hjälp av data från register och patientgrupper och är mellan 3,4 och 7,8/miljoner kvinnor. Antalet nya fall varje år är mellan 0,23 och 0,31/miljoner kvinnor/år i USA, Storbritannien och Schweiz. Variationen mellan länder och mellan angränsande stater i USA tyder på att ett betydande antal kvinnor med LAM förblir antingen odiagnostiserade eller att deras symptom tillskrivs andra sjukdomar. Vuxna kvinnor med tuberös skleros är mer benägna att utveckla LAM än kvinnor utan tuberös skleros. Kohorter av patienter med tuberös skleros har screenats för LAM med hjälp av CT -skanning. I en retrospektiv studie av vuxna med tuberös skleros visade CT lungcystor hos 42% av 95 kvinnor och 13% av 91 män. I allmänhet var lungcyster större och fler hos kvinnor än hos män. I en ytterligare retrospektiv studie av kvinnor med TSC som genomgick CT -skanning för att upptäcka LAM, hade 25% av dem i 20 -årsåldern lungcyst medan 80% av kvinnorna i 40 -årsåldern påverkades, vilket tyder på att utvecklingen av LAM är åldersberoende åtminstone i tuberös sklerosrelaterad LAM. Även om förekomsten av tuberös skleros vid 1 av 6000 födelser är mycket större än för LAM, ser de flesta lungkliniker fler fall av sporadisk än tuberös skleros-LAM: troligen på grund av en kombination av låga nivåer av screening för LAM vid tuberös skleros och många, frånvaron av symptom.
Kvinnligt kön och tuberös skleros är de enda kända riskfaktorerna. Även om användning av kompletterande östrogen inte är associerat med utveckling av LAM, föreslog en studie att användning av östrogeninnehållande p-piller var associerad med tidigare debut.
Det förekommer hos mer än 30% av kvinnorna med tuberös skleroskomplex (TSC-LAM), ett ärftligt syndrom som är associerat med anfall , kognitiv försämring och godartade tumörer i flera vävnader. De flesta LAM-patienter som presenteras för medicinsk utvärdering har dock den sporadiska formen av sjukdomen (S-LAM), som dock inte är associerad med andra manifestationer av tuberös skleroskomplex.
Milda cystiska förändringar som överensstämmer med LAM har beskrivits hos 10–15% av männen med TSC, men symptomatisk LAM hos män är sällsynt. Sporadic LAM förekommer uteslutande hos kvinnor, med ett publicerat undantag hittills. Både TSC-LAM och S-LAM är associerade med mutationer i tuberösa sklerosgener.
Graviditet
Graviditet har rapporterats förvärra LAM i vissa fall. Risken har dock inte studerats noggrant. I en undersökning bland 318 patienter som angav att de hade haft minst en graviditet svarade 163 på en andra undersökning med fokus på lungkollaps. Totalt 38 patienter rapporterade en pneumotorax med graviditet, vilket överensstämde med en förekomst av pneumotorax under graviditeten på minst 10% (38 av 318). Hos en tredjedel av patienterna ledde pneumotoraxen under graviditeten till LAM -diagnosen. Pneumothoraces var nästan dubbelt så frekventa till höger som till vänster, och fyra kvinnor fick bilateral spontan pneumothorax. De flesta pneumothoraces ägde rum under andra och tredje trimestern. Denna studie och andra tyder på att graviditet är associerad med pleurakomplikationer hos LAM -patienter. Få kvinnor med en känd LAM -diagnos väljer att bli gravida och patienter där LAM diagnostiseras under graviditeten har sällan tillgängliga lungfunktionstester vid baslinjen, vilket komplicerar att denna fråga löses.
Samhälle
LAM Foundation grundades 1995 som en gräsrotsorganisation för att ge patientförespråkande och forskningsfinansiering. Idag tillhandahåller LAM Foundation stöd och utbildning för kvinnor med LAM och deras familjer, engagerar läkare och forskare att fortsätta att lära sig mer om sjukdomen och samlar in pengar för den fortsatta studien av LAM. Det söker säkra och effektiva behandlingar och i slutändan botemedel mot lymfangioleiomyomatos. Det har sitt huvudkontor i Cincinnati, Ohio.
I populärkulturen
I " Lucky Thirteen ", det femte avsnittet av den femte säsongen av House , fick Spencer (Angela Gots) diagnosen LAM, men senare visade det sig vara ett fall av Sjögrens syndrom .
Se även
Referenser
externa länkar
| Klassificering | |
|---|---|
| Externa resurser |