Brachyterapi - Brachytherapy
| Brachyterapi | |
|---|---|
 Arrow pekar på brachyterapipärlor som används för att behandla prostatacancer.
| |
| Andra namn | intern strålbehandling, sluten strålbehandling, kurietterapi, endokurterapi |
| ICD-10-PCS | D ? 1 |
| ICD-9-CM | 92,27 |
| Maska | D001918 |
Brachyterapi är en form av strålbehandling där en förseglad strålningskälla placeras inuti eller bredvid det område som kräver behandling. Brachy är grekiska för kort. Brachyterapi används vanligtvis som en effektiv behandling för livmoderhals- , prostata- , bröst- , esofageal- och hudcancer och kan också användas för att behandla tumörer på många andra kroppsställen. Behandlingsresultat har visat att cancerläkningsgraden för brachyterapi antingen är jämförbar med kirurgi och extern strålbehandling (EBRT) eller förbättras när den används i kombination med dessa tekniker. Brachyterapi kan användas ensam eller i kombination med andra terapier som kirurgi, EBRT och kemoterapi .
Brachyterapi står i kontrast till otätad strålbehandling , där en terapeutisk radionuklid (radioisotop) injiceras i kroppen för att kemiskt lokalisera till vävnaden som kräver förstörelse. Det står också i kontrast till External Beam Radiation Therapy (EBRT), där högenergiröntgenstrålar (eller ibland gammastrålar från en radioisotop som kobolt-60 ) riktas mot tumören utanför kroppen. Brachyterapi innebär istället en exakt placering av strålkällor av kort avstånd (radioisotoper, jod-125 eller cesium-131 till exempel) direkt på platsen för cancertumören. Dessa är inneslutna i en skyddande kapsel eller tråd, som gör att den joniserande strålningen kan fly för att behandla och döda omgivande vävnad men förhindrar att radioisotopens laddning rör sig eller löser sig i kroppsvätskor. Kapseln kan avlägsnas senare, eller (med vissa radioisotoper) kan den få sitta kvar.
Ett drag hos brachyterapi är att bestrålningen endast påverkar ett mycket lokaliserat område runt strålningskällorna. Exponeringen för strålning av friska vävnader längre bort från källorna reduceras därför. Dessutom, om patienten rör sig eller om det finns någon rörelse av tumören i kroppen under behandlingen, behåller strålningskällorna sin korrekta position i förhållande till tumören. Dessa egenskaper hos brachyterapi ger fördelar jämfört med EBRT - tumören kan behandlas med mycket höga doser lokaliserad strålning samtidigt som sannolikheten för onödig skada på omgivande friska vävnader minskar.
En kurs med brachyterapi kan slutföras på kortare tid än andra strålterapitekniker. Detta kan bidra till att minska chansen för överlevande cancerceller att dela sig och växa i intervallerna mellan varje strålbehandling. Patienter måste vanligtvis göra färre besök på radioterapikliniken jämfört med EBRT och kan få behandlingen som polikliniska patienter. Detta gör behandlingen tillgänglig och bekväm för många patienter. Dessa egenskaper hos brachyterapi innebär att de flesta patienter kan tolerera brachyterapiproceduren mycket bra.
Den globala marknaden för brachyterapi nådde 680 miljoner US dollar 2013, varav segmenten hög dos (HDR) och LDR stod för 70%. Mikrosfärer och elektronisk brachyterapi omfattade resterande 30%. En analys förutsäger att brachyterapimarknaden kan nå över 2,4 miljarder US-dollar 2030, växa med 8% årligen, främst driven av mikrosfärmarknaden samt elektronisk brachyterapi, som vinner stort intresse världen över som en användarvänlig teknik.
Medicinsk användning
Brachyterapi används vanligtvis för att behandla cancer i livmoderhalsen , prostata , bröst och hud .
Brachyterapi kan också användas vid behandling av tumörer i hjärnan , ögat , huvudet och nacken (läpp, munhål , tunga, nasofarynx och orofarynx ), luftvägar ( luftrör och bronkier ), matsmältningskanal ( matstrupe , gallblåsa , gallgångar , rektum , anus ), urinvägar ( urinblåsa , urinrör , penis ), kvinnliga reproduktiva kanaler ( livmoder , vagina , vulva ) och mjuka vävnader.
Eftersom strålningskällorna kan placeras exakt på tumörbehandlingsstället, möjliggör brachyterapi en hög dos strålning på ett litet område. Eftersom strålningskällorna är placerade i eller bredvid måltumören behåller källorna dessutom sin position i förhållande till tumören när patienten rör sig eller om det finns någon rörelse av tumören i kroppen. Därför förblir strålningskällorna noggrant riktade. Detta gör det möjligt för läkare att uppnå en hög doskonformitet - det vill säga att hela tumören får en optimal strålningsnivå. Det minskar också risken för skador på frisk vävnad, organ eller strukturer runt tumören, vilket ökar chansen att bota och bevara organets funktion.
Användningen av HDR -brachyterapi gör det möjligt att minska den totala behandlingstiden jämfört med EBRT. Patienter som får brachyterapi måste i allmänhet göra färre besök för strålbehandling jämfört med EBRT, och övergripande strålbehandlingsplaner kan slutföras på kortare tid. Många brachyterapiprocedurer utförs polikliniskt. Denna bekvämlighet kan vara särskilt relevant för patienter som måste arbeta, äldre patienter eller patienter som bor en bit från behandlingscentra, för att säkerställa att de har tillgång till strålterapibehandling och följer behandlingsplaner. Kortare behandlingstider och polikliniska förfaranden kan också bidra till att effektivisera strålbehandlingskliniker.
Brachyterapi kan användas för att bota cancern vid små eller lokalt avancerade tumörer, förutsatt att cancern inte har metastaserat (spridit sig till andra delar av kroppen). I lämpligt utvalda fall representerar brachyterapi för primära tumörer ofta ett jämförbart tillvägagångssätt för kirurgi, med samma sannolikhet att bota och med liknande biverkningar. Men vid lokalt avancerade tumörer kanske kirurgi inte rutinmässigt ger den bästa chansen att bota och är ofta inte tekniskt genomförbar. I dessa fall erbjuder strålbehandling, inklusive brachyterapi, den enda chansen att bota. I mer avancerade sjukdomsstadier kan brachyterapi användas som palliativ behandling för symptomlindring från smärta och blödning.
I fall där tumören inte är lättillgänglig eller är för stor för att säkerställa en optimal fördelning av bestrålning till behandlingsområdet kan brachyterapi kombineras med andra behandlingar, såsom EBRT och/eller kirurgi. Kombinationsterapi av brachyterapi uteslutande med kemoterapi är sällsynt.
Livmoderhalscancer
Brachyterapi används vanligtvis vid behandling av tidig eller lokalt begränsad livmoderhalscancer och är en standard för vård i många länder. Livmoderhalscancer kan behandlas med antingen LDR, PDR eller HDR brachyterapi. Brachyterapi används i kombination med EBRT och kan ge bättre resultat än EBRT ensam. Brachyterapins precision gör att en hög dos riktad strålning kan levereras till livmoderhalsen, samtidigt som strålningsexponering för intilliggande vävnader och organ minimeras.
Chansen att hålla sig fri från sjukdom (sjukdomsfri överlevnad) och att förbli vid liv (total överlevnad) är liknande för LDR-, PDR- och HDR-behandlingar. En viktig fördel med HDR -behandling är emellertid att varje dos kan levereras polikliniskt med en kort administreringstid vilket ger större bekvämlighet för många patienter.
Forskning visar att lokalt avancerat cancer i livmoderhalsen måste behandlas med en kombination av extern strålbehandling (EBRT) och intrakavitets brachyterapi (ICBT).
Prostatacancer
Brachyterapi för behandling av prostatacancer kan ges antingen som permanent LDR -fröimplantation eller som tillfällig HDR -brachyterapi.
Permanent fröimplantation är lämplig för patienter med lokaliserad tumör och god prognos och har visat sig vara en mycket effektiv behandling för att förhindra att cancern återkommer. Överlevnadsfrekvensen liknar den som finns vid EBRT eller kirurgi ( radikal prostatektomi ), men med färre biverkningar som impotens och inkontinens . Proceduren kan slutföras snabbt och patienter kan vanligtvis gå hem samma behandlingsdag och återgå till normala aktiviteter efter 1 till 2 dagar. Permanent fröimplantation är ofta ett mindre invasivt behandlingsalternativ jämfört med kirurgiskt avlägsnande av prostata.
Tillfällig HDR -brachyterapi är en nyare metod för behandling av prostatacancer, men är för närvarande mindre vanlig än fröimplantation. Det används huvudsakligen för att ge en extra dos utöver EBRT (känd som "boost" -terapi) eftersom det erbjuder en alternativ metod för att leverera en hög dos strålterapi som överensstämmer med tumörens form i prostatan, samtidigt som strålning sparar exponering för omgivande vävnader. HDR brachyterapi som ett lyft för prostatacancer innebär också att EBRT -kursen kan vara kortare än när EBRT används ensam.
Bröstcancer
Strålbehandling är standard för vård för kvinnor som har genomgått lumpektomi eller mastektomi , och är en integrerad del av bröstbevarande terapi. Brachyterapi kan användas efter operation, före kemoterapi eller palliativt vid avancerad sjukdom. Brachyterapi för att behandla bröstcancer utförs vanligtvis med HDR -tillfällig brachyterapi. Efter operation kan bröstbrachyterapi användas som en "boost" efter hela bröststrålning (WBI) med EBRT. Mer nyligen används brachyterapi ensam för att leverera APBI (accelererad partiell bröststrålning), vilket innebär att strålning levereras till endast den närmaste regionen som omger den ursprungliga tumören.
Den största fördelen med bröstbrachyterapi jämfört med hela bröststrålning är att en hög dos strålning kan appliceras exakt på tumören samtidigt som strålning sparar friska bröstvävnader och underliggande strukturer som revben och lungor. APBI kan vanligtvis slutföras under en vecka. Alternativet brachyterapi kan vara särskilt viktigt för att se till att arbetande kvinnor, äldre eller kvinnor utan enkel tillgång till ett behandlingscenter kan dra nytta av bröstbevarande behandling på grund av den korta behandlingskursen jämfört med WBI (som ofta kräver fler besök under 1-2 månader).
Det finns fem metoder som kan användas för att leverera bröst-brachyterapi: Interstitiell bröst-brachyterapi, Intrakavitär bröst-brachyterapi, Intraoperativ strålbehandling, Permanent bröstfröimplantation och icke-invasiv bröst-brachyterapi med hjälp av mammografi för mållokalisering och en HDR-källa.
Interstitiell bröstbrachyterapi
Interstitiell bröstbrachyterapi innebär tillfällig placering av flera flexibla plastkatetrar i bröstvävnaden. Dessa är noggrant placerade för att möjliggöra optimal riktning av strålning till behandlingsområdet samtidigt som du sparar den omgivande bröstvävnaden. Katetrarna är anslutna till en efterlastare som levererar den planerade strålningsdosen till behandlingsområdet. Interstitiell bröstbrachyterapi kan användas som "boost" efter EBRT, eller som APBI.
Intraoperativ strålbehandling
Intraoperativ strålbehandling (IORT) levererar strålning samtidigt som operationen för att ta bort tumören (lumpektomi). En applikator placeras i hålrummet kvar efter tumörborttagning och en mobil elektronisk enhet genererar strålning (antingen röntgenstrålar eller elektroner) och levererar den via applikatorn. Strålning levereras på en gång och applikatorn tas bort innan snittet stängs.
Intrakavitär bröstbrachyterapi
Intrakavitär bröstbrachyterapi (även känd som "ballongbrachyterapi") innebär placering av en enda kateter i brösthålan som lämnas efter avlägsnande av tumören (lumpektomi). Katetern kan placeras vid lumpektomi eller postoperativt. Via katetern blåses sedan en ballong upp i hålrummet. Katetern ansluts sedan till en efterlastare , som avger strålningsdosen genom katetern och in i ballongen. För närvarande används intrakavitär bröstbrachyterapi endast rutinmässigt för APBI.
Det finns också apparater som kombinerar egenskaperna hos interstitiell och intrakavitär bröstbrachyterapi (t.ex. SAVI). Dessa enheter använder flera katetrar men sätts in genom en enda ingångspunkt i bröstet. Studier tyder på att användning av flera katetrar gör det möjligt för läkare att rikta in strålningen mer exakt.
Permanent bröstfröimplantation
Permanent bröstfröimplantation (PBSI) implanterar många radioaktiva "frön" (små pellets) i bröstet i området kring tumörstället, liknande permanent fröprostata brachyterapi. Fröna implanteras i en enda 1-2 timmars procedur och levererar strålning under de följande månaderna när det radioaktiva materialet inuti dem sönderfaller. Risk för strålning från implantaten till andra (t.ex. partner/make) har studerats och befunnits vara säker.
Hjärntumörer
Kirurgiskt riktad strålningsterapi (STaRT), annars känd som GammaTile Therapy , är en ny typ av brachyterapimplantat som är särskilt utformat för användning inne i hjärnan. GammaTile är FDA-godkänt för att behandla nydiagnostiserade, opererbara maligna intrakraniella neoplasmer (dvs hjärntumörer) och opererbara återkommande intrakraniella neoplasmer, inklusive meningiom, metastaser, högklassiga gliom och glioblastom.
I en klinisk studie förbättrade GammaTile Therapy den lokala tumörkontrollen jämfört med tidigare behandlingar på samma plats utan ökad risk för biverkningar.
Cancer i matstrupen
För strålebehandling av matstrupscancer är brachyterapi ett alternativ för effektiv behandling, innebär definitiv strålbehandling (boost) eller palliativ behandling. Definitiv strålbehandling (boost) kan ge dosen exakt och palliativa behandlingar kan ges för att lindra dysfagi. Applikatorer med stor diameter eller kateter av ballongtyp används med efterladdaren för att expandera matstrupen och underlätta tillförsel av strålningsdos till tumör med skonande av närliggande normal vävnad.
Brachyterapi följt EBRT eller kirurgi har visats kan förbättra överlevnadshastigheten och lokal återkommande frekvens än EBRT eller kirurgi endast för esofagealcancerpatienter.
Hudcancer
HDR -brachyterapi för icke -melanomatös hudcancer , såsom basalcellscancer och skivepitelcancer , ger ett alternativt behandlingsalternativ till kirurgi. Detta är särskilt relevant för cancer i näsan, öronen, ögonlocken eller läpparna, där operation kan orsaka missbildning eller kräva omfattande rekonstruktion. Olika applikatorer kan användas för att säkerställa nära kontakt mellan strålningskällan (erna) och huden, som överensstämmer med hudens krökning och hjälper till att säkerställa exakt leverans av den optimala bestrålningsdosen.
En annan typ av brachyterapi som har liknande fördelar som HDR tillhandahålls är Rhenium-SCT ( Skin Cancer Therapy). Det använder sig av beta -strålningsutsläpp från Rhenium -188 för att behandla basalcell- eller skivepitelcancer . strålningskällan är innesluten i en förening som appliceras på en tunn skyddsfolie direkt över lesionen. På så sätt kan strålningskällan appliceras på komplexa platser och minimera strålning till frisk vävnad.
Brachyterapi för hudcancer ger bra kosmetiska resultat och klinisk effekt; studier med upp till 5 års uppföljning har visat att brachyterapi är mycket effektivt när det gäller lokal kontroll och är jämförbar med EBRT. Behandlingstiderna är vanligtvis korta, vilket ger patienterna bekvämlighet. Det har föreslagits att brachyterapi kan bli en standard för behandling av hudcancer inom en snar framtid.
Blodkärl
Brachyterapi kan användas vid behandling av koronar in-stent restenos , där en kateter placeras inuti blodkärlen, genom vilka källor sätts in och avlägsnas. Vid behandling av In-stent restenosis (ISR) har läkemedelseluerande stenter (DES) visat sig vara överlägsna Intrakoronär brachyterapi (ICBT). Det finns emellertid ett fortsatt intresse för vaskulär brachyterapi för ihållande restenos i misslyckade stenter och ventransplantat. Terapin har också undersökts för användning vid behandling av perifer kärlstenos och övervägts för behandling av förmaksflimmer .
Bieffekter
Sannolikheten och arten av potentiella akuta, subakuta eller långsiktiga biverkningar i samband med brachyterapi beror på placeringen av den tumör som behandlas och vilken typ av brachyterapi som används.
Akut
Akuta biverkningar associerade med brachyterapi inkluderar lokaliserade blåmärken, svullnad, blödning, urladdning eller obehag inom den implanterade regionen. Dessa löser vanligtvis inom några dagar efter avslutad behandling. Patienter kan också känna sig trötta under en kort period efter behandlingen.
Brachyterapibehandling för livmoderhals- eller prostatacancer kan orsaka akuta och övergående urinbesvär såsom urinretention, urininkontinens eller smärtsam urinering (dysuri). Övergående ökad tarmfrekvens, diarré, förstoppning eller mindre rektal blödning kan också förekomma. Akuta och subakuta biverkningar försvinner vanligtvis under några dagar eller några veckor. Vid permanent (frö) brachyterapi för prostatacancer finns det en liten chans att vissa frön kan vandra ut ur behandlingsområdet till blåsan eller urinröret och passera i urinen.
Brachyterapi för hudcancer kan leda till att de yttre hudlagren (avskamning) avlägsnas runt behandlingsområdet under veckorna efter behandlingen, vilket vanligtvis läker på 5–8 veckor. Om cancern ligger på läppen kan sår uppstå som ett resultat av brachyterapi, men försvinner vanligtvis efter 4-6 veckor.
De flesta av de akuta biverkningarna i samband med brachyterapi kan behandlas med medicinering eller genom kostförändringar och försvinner vanligtvis med tiden (vanligtvis några veckor) när behandlingen är klar. De akuta biverkningarna av HDR -brachyterapi liknar i stort sett EBRT.
Långsiktigt
Hos ett litet antal människor kan brachyterapi orsaka långsiktiga biverkningar på grund av skada eller avbrott i angränsande vävnader eller organ. Långsiktiga biverkningar är vanligtvis milda till måttliga. Till exempel kan urin- och matsmältningsproblem kvarstå som ett resultat av brachyterapi för livmoderhals- eller prostatacancer och kan kräva kontinuerlig behandling.
Brachyterapi för prostatacancer kan orsaka erektil dysfunktion hos cirka 15-30% av patienterna. Risken för erektil dysfunktion är dock relaterad till ålder (äldre män löper större risk än yngre män) och även nivån på erektil funktion innan de får brachyterapi. Hos patienter som upplever erektil dysfunktion kan de flesta fall framgångsrikt behandlas med läkemedel som Viagra . Det viktigaste är att risken för erektil dysfunktion efter brachyterapi är mindre än efter radikal prostatektomi .
Brachyterapi för bröst- eller hudcancer kan orsaka att det bildas ärrvävnad runt behandlingsområdet. Vid bröstbrachyterapi kan fettnekros uppstå som ett resultat av att fettsyror kommer in i bröstvävnaderna. Detta kan göra att bröstvävnaden blir svullen och öm. Fettnekros är ett godartat tillstånd och inträffar vanligtvis 4–12 månader efter behandlingen och drabbar cirka 2% av patienterna.
Säkerhet kring andra
Patienter frågar ofta om de behöver ha särskilda säkerhetsåtgärder kring familj och vänner efter att ha fått brachyterapi. Om tillfällig brachyterapi används finns inga radioaktiva källor kvar i kroppen efter behandlingen. Därför finns det ingen strålningsrisk för vänner eller familj från att vara i närheten av dem.
Om permanent brachyterapi används, finns låga doser av radioaktiva källor (frön) kvar i kroppen efter behandlingen - strålningsnivåerna är mycket låga och minskar med tiden. Dessutom påverkar bestrålningen bara vävnader inom några millimeter från de radioaktiva källorna (dvs. tumören som behandlas). Som en försiktighetsåtgärd kan vissa personer som får permanent brachyterapi rådas att inte hålla några små barn eller vara för nära gravida kvinnor en kort tid efter behandlingen. Strålningsonkologer eller sjuksköterskor kan ge specifika instruktioner till patienter och ge råd hur länge de behöver vara försiktiga.
Typer
Olika typer av brachyterapi kan definieras enligt (1) placeringen av strålkällorna i målbehandlingsområdet, (2) hastigheten eller 'intensiteten' för bestrålningsdosen som levereras till tumören och (3) dosens varaktighet leverans .
Källplacering
De två huvudtyperna av brachyterapibehandling när det gäller placeringen av den radioaktiva källan är interstitiell och kontakt.
Vid interstitiell brachyterapi placeras källorna direkt i målvävnaden på den drabbade platsen, till exempel prostata eller bröst.
Kontaktbrachyterapi innebär placering av strålningskällan i ett utrymme bredvid målvävnaden. Detta utrymme kan vara en kroppshålighet (intrakavitär brachyterapi) såsom livmoderhalsen , livmodern eller slidan ; en kroppslumen (intraluminal brachyterapi) såsom luftstrupen eller matstrupen ; eller externt (ytbrachyterapi) såsom huden . En strålningskälla kan också placeras i blodkärl (intravaskulär brachyterapi) för behandling av koronar in-stent restenos .
Dosfrekvens
Doshastigheten för brachyterapi avser nivån eller 'intensiteten' med vilken strålningen levereras till det omgivande mediet och uttrycks i gråtoner per timme (Gy/h).
Lågdoshastighet (LDR) brachyterapi innebär implantering av strålningskällor som avger strålning med en hastighet på upp till 2 Gy · h −1 . LDR brachyterapi används vanligtvis vid cancer i munhålan, orofarynx , sarkom och prostatacancer
Medium-dos rate (MDR) brachyterapi kännetecknas av en medelhög doshastighet, som varierar mellan 2 Gy · h −1 till 12 Gy · h −1 .
Bra-doshastighet (HDR) brachyterapi är när doseringshastigheten överstiger 12 Gy · h −1 . De vanligaste tillämpningarna av HDR -brachyterapi är i tumörer i livmoderhalsen , matstrupen , lungorna , brösten och prostata . De flesta HDR -behandlingar utförs polikliniskt, men detta beror på behandlingsplatsen.
Pulserad doshastighet (PDR) brachyterapi innebär korta strålningspulser, vanligtvis en gång i timmen, för att simulera den totala hastigheten och effektiviteten av LDR-behandling. Typiska tumörställen som behandlas med PDR -brachyterapi är gynekologisk cancer och huvud- och halscancer.
Dosleveransens varaktighet
Placering av strålningskällor i målområdet kan vara tillfällig eller permanent.
Tillfällig brachyterapi innebär att strålkällor placeras under en bestämd varaktighet (vanligtvis ett antal minuter eller timmar) innan de dras tillbaka. Den specifika behandlingstiden beror på många olika faktorer, inklusive den erforderliga doseringshastigheten och cancertyp, storlek och plats. I LDR- och PDR -brachyterapi stannar källan vanligtvis på plats upp till 24 timmar innan den tas bort, medan den i HDR -brachyterapi normalt är några minuter.
Permanent brachyterapi, även känd som fröimplantation, innebär att man placerar små LDR -radioaktiva frön eller pellets (ungefär storleken på ett riskorn) i tumören eller behandlingsstället och lämnar dem där permanent för att gradvis förfalla. Under en period av veckor eller månader kommer strålningsnivån från källorna att sjunka till nästan noll. De inaktiva fröna finns sedan kvar på behandlingsstället utan någon varaktig effekt. Permanent brachyterapi används oftast vid behandling av prostatacancer .
Procedur
Initial planering
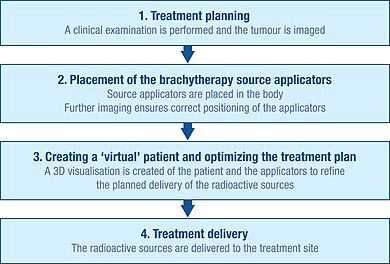
För att noggrant planera brachyterapiproceduren utförs en grundlig klinisk undersökning för att förstå tumörens egenskaper. Dessutom kan en rad olika avbildningsmetoder användas för att visualisera tumörens form och storlek och dess relation till omgivande vävnader och organ. Dessa inkluderar röntgenstrålning, ultraljud, beräknad axiell tomografi (CT eller CAT) och magnetisk resonanstomografi (MRT). Data från många av dessa källor kan användas för att skapa en 3D -visualisering av tumören och de omgivande vävnaderna.
Med hjälp av denna information kan en plan för optimal fördelning av strålningskällorna utvecklas. Detta inkluderar övervägande av hur källbärarna (applikatorerna), som används för att leverera strålningen till behandlingsstället, ska placeras och placeras. Applikatorer är icke-radioaktiva och är vanligtvis nålar eller plastkatetrar. Den specifika typ av applikator som används beror på vilken typ av cancer som behandlas och måltumörens egenskaper.
Denna första planering hjälper till att säkerställa att "kalla fläckar" (för lite bestrålning) och "hot spots" (för mycket bestrålning) undviks under behandlingen, eftersom dessa kan resultera i behandlingssvikt och biverkningar.
Införande
Innan radioaktiva källor kan levereras till tumörstället måste applikatorerna sättas in och placeras korrekt i enlighet med den ursprungliga planeringen.
Avbildningstekniker, såsom röntgen, fluoroskopi och ultraljud, används vanligtvis för att hjälpa till att placera applikatorerna till rätt position och för att ytterligare förfina behandlingsplanen. CAT -skanningar och MR kan också användas. När applikatorerna har satts in hålls de på plats mot huden med hjälp av suturer eller tejp för att förhindra att de rör sig. När applikatorerna har bekräftats vara på rätt plats kan ytterligare avbildning utföras för att vägleda detaljerad behandlingsplanering.
Skapande av en virtuell patient
Bilderna av patienten med applikatorerna in situ importeras till behandlingsplaneringsprogram och patienten förs in i ett särskilt avskärmat rum för behandling. Behandlingsplaneringsprogramvaran gör att flera 2D -bilder av behandlingsplatsen kan översättas till en 3D "virtuell patient", inom vilken applikatorernas position kan definieras. De rumsliga förhållandena mellan applikatorerna, behandlingsstället och de omgivande friska vävnaderna inom denna "virtuella patient" är en kopia av relationerna hos den faktiska patienten.
Optimera bestrålningsplanen
För att identifiera den optimala rumsliga och tidsmässiga fördelningen av strålningskällor inom applikatorerna av den implanterade vävnaden eller hålrummet, tillåter behandlingsplaneringsprogramvaran att placera virtuella strålningskällor i den virtuella patienten. Programvaran visar en grafisk framställning av strålningens fördelning. Detta fungerar som en guide för brachyterapiteamet för att förfina fördelningen av källorna och tillhandahålla en behandlingsplan som är optimalt anpassad till varje patients anatomi innan den faktiska leveransen av bestrålningen börjar. Detta tillvägagångssätt kallas ibland 'dosmålning'.
Behandling leverans
Strålningskällorna som används för brachyterapi är alltid inneslutna i en icke-radioaktiv kapsel. Källorna kan levereras manuellt, men levereras vanligare genom en teknik som kallas "efterladdning".
Manuell leverans av brachyterapi är begränsad till några få LDR -applikationer, på grund av risk för strålningsexponering för klinisk personal.
I motsats härtill innebär efterladdning exakt positionering av icke-radioaktiva applikatorer på behandlingsstället, som sedan laddas med strålningskällorna. Vid manuell efterladdning levereras källan till applikatorn av operatören.
Fjärröverbelastningssystem ger skydd mot strålningsexponering för vårdpersonal genom att säkra strålningskällan i ett skyddat värdeskåp. När applikatorerna är korrekt placerade i patienten, är de anslutna till en "efterlastare" -maskin (som innehåller de radioaktiva källorna) genom en serie anslutande styrrör. Behandlingsplanen skickas till efterlastaren, som sedan styr utmatningen av källorna längs styrrören till de fördefinierade positionerna i applikatorn. Denna process utförs först när personal avlägsnas från behandlingsrummet. Källorna förblir på plats under en förutbestämd tid, igen efter behandlingsplanen, varefter de återlämnas längs rören till efterlastaren.
Efter leverans av de radioaktiva källorna avlägsnas applikatorerna försiktigt från kroppen. Patienter återhämtar vanligtvis snabbt från brachyterapiproceduren, vilket gör att den ofta kan utföras polikliniskt.
Mellan 2003 och 2012 på amerikanska samhällssjukhus hade sjukhusvistelsen med brachyterapi (intern strålterapi) en genomsnittlig årlig minskning på 24,4 procent bland vuxna i åldern 45–64 år och en genomsnittlig årlig minskning på 27,3 procent bland vuxna i åldern 65–84 år . Brachyterapi var OR -förfarandet med den största förändringen i förekomsten bland sjukhusvistelser som betalas av Medicare och privata försäkringar.
Strålningskällor
Vanliga strålningskällor (radionuklider) för brachyterapi.
| Radionuklid | Typ | Halveringstid | Energi |
|---|---|---|---|
| Cesium-131 ( 131 Cs) | Electron Capture, ε | 9,7 dagar | 30,4 keV (medelvärde) |
| Cesium-137 ( 137 Cs) | β - - partiklar, γ -strålar | 30,17 år | 0,512, 0,662 MeV y-strålar |
| Cobalt-60 ( 60 Co) | β - - partiklar, γ -strålar | 5,26 år | 1,17, 1,33 MeV y-strålar |
| Iridium-192 ( 192 Ir) | γ-strålar | 73,8 dagar | 0,38 MeV (medelvärde) |
| Jod-125 ( 125 I) | Electron Capture, ε | 59,6 dagar | 27,4, 31,4 och 35,5 keV |
| Palladium-103 ( 103 Pd) | Electron Capture, ε | 17,0 dagar | 21 keV (medelvärde) |
| Ruthenium-106 ( 106 Ru) | β - - partiklar | 1,02 år | 3.54 MeV |
| Radium-226 ( 226 Ra) | a-partiklar | 1599 år |
Historia
Brachyterapi går tillbaka till 1901 (strax efter upptäckten av radioaktivitet av Henri Becquerel 1896) när Pierre Curie föreslog Henri-Alexandre Danlos att en radioaktiv källa skulle kunna sättas in i en tumör. Det konstaterades att strålningen fick tumören att krympa. Oberoende föreslog Alexander Graham Bell också användning av strålning på detta sätt. I början av 1900 -talet var tekniker för tillämpning av brachyterapi banbrytande på Curie -institutet i Paris av Danlos och vid St Luke's and Memorial Hospital i New York av Robert Abbe .
Arbetade med Curies i sitt radiumforskningslaboratorium vid University of Paris, förädlade den amerikanske fysikern William Duane en teknik för att utvinna radon-222 gas från radiumsulfatlösningar. Lösningar innehållande 1 gram radium "mjölkades" för att skapa radon "frön" på cirka 20 millikurer vardera. Dessa "frön" distribuerades över hela Paris för användning i en tidig form av brachyterapi som kallas endokurietterapi. Duane fulländade denna "mjölkning" -teknik under sin tid i Paris och hänvisade till enheten som en "radiumko".
Duane återvände till USA 1913 och arbetade i en gemensam roll som biträdande professor i fysik vid Harvard och forskare i fysik vid Harvard Cancer Commission. Cancerkommissionen grundades 1901 och anlitade Duane för att undersöka användningen av radiumutstrålning vid behandling av cancer. År 1915 byggde han Bostons första "radiumko" och tusentals patienter behandlades med radon-222 som genererades från den.
Interstitiell radiumterapi var vanlig på 1930 -talet. Guld frön fyllda med radon användes så tidigt som 1942 till åtminstone 1958. guldskal selekterades genom Gino Failla omkring 1920 för att avskärma betastrålar medan passerar gammastrålar . Koboltnålar användes också kort efter andra världskriget. Radon och kobolt ersattes av radioaktivt tantal och guld, innan iridium steg i framkant. Iridium användes första gången 1958 och är idag den vanligaste artificiella källan för brachyterapi.
Efter det första intresset för brachyterapi i Europa och USA minskade dess användning i mitten av 1900 -talet på grund av problemet med strålningsexponering för operatörer från den manuella tillämpningen av de radioaktiva källorna. Utvecklingen av avlägsna efterladdningssystem , som gör att strålningen kan levereras från ett skyddat kassaskåp, och användningen av nya radioaktiva källor under 1950- och 1960 -talen, minskade risken för onödig strålningsexponering för operatören och patienterna. Detta, tillsammans med nyare framsteg inom tredimensionella avbildningsmetoder, datoriserade behandlingsplaneringssystem och leveransutrustning har gjort brachyterapi till en säker och effektiv behandling för många typer av cancer idag.
Ordet "brachyterapi" kommer från det grekiska ordet βραχύς brachys , vilket betyder "kortdistans" eller "kort".
Miljöfara
På grund av den lilla storleken på brachyterapikällor och låg kontroll under de första decennierna finns det en risk att några av dessa har rymt ut i miljön för att bli föräldralösa källor . En radiumnål hittades på en lekplats i Prag 2011 och strålade 500 µSv/h från en meter bort.
Se även
- Strålbehandling med yttre strålar
- Prostata brachyterapi
- Riktad intraoperativ strålbehandling
- Obehandlad strålbehandling
- Kärnmedicin
- Intraoperativ strålbehandling
- Kontakta röntgenbrachyterapi (även kallad "elektronisk brachyterapi")
Referenser
externa länkar