Afrikansk trypanosomiasis - African trypanosomiasis
| Afrikansk trypanosomiasis | |
|---|---|
| Andra namn | Sovsjuka, afrikansk sömnsjuka |
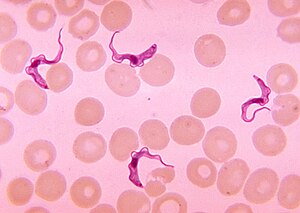 | |
| Trypanosom bildas i ett blodprov | |
| Specialitet | Smittsam sjukdom |
| Symtom |
Steg 1 : Feber, huvudvärk, klåda, ledvärk Steg 2 : Sömnproblem , förvirring , dålig koordination |
| Vanlig start | 1-3 veckor efter exponering |
| Typer | Trypanosoma brucei gambiense (TbG), Trypanosoma brucei rhodesiense (TbR) |
| Orsaker | Trypanosoma brucei sprids av tsetse flugor |
| Diagnostisk metod | Blodprov , ländryggen punktering |
| Medicin | Fexinidazol , pentamidin , suramin , eflornitin , nifurtimox |
| Prognos | Dödligt utan behandling |
| Frekvens | 977 (2018) |
| Dödsfall | 3500 (2015) |
Afrikansk trypanosomiasis , även känd som afrikansk sömnsjuka eller helt enkelt sömnsjuka , är en insektsburen parasitinfektion hos människor och andra djur. Det orsakas av arten Trypanosoma brucei . Människor är infekterade av två typer, Trypanosoma brucei gambiense (TbG) och Trypanosoma brucei rhodesiense (TbR). TbG orsakar över 98% av de rapporterade fallen. Båda överförs vanligtvis genom bettet av en infekterad tsetsefluga och är vanligast på landsbygden.
Initialt kännetecknas det första stadiet av sjukdomen av feber, huvudvärk, klåda och ledvärk, som börjar en till tre veckor efter bettet. Veckor till månader senare börjar det andra stadiet med förvirring, dålig koordination, domningar och sömnproblem. Diagnos är genom att hitta parasiten i ett blodprov eller i vätskan i en lymfkörtel. En ländryggen punktering behövs ofta för att se skillnaden mellan första och andra stadiet sjukdom.
Förebyggande av allvarliga sjukdomar innebär screening av befolkningen i riskzonen med blodprov för TbG. Behandlingen är lättare när sjukdomen upptäcks tidigt och innan neurologiska symptom uppstår. Behandlingen av det första stadiet har varit med medicinerna pentamidin eller suramin . Behandlingen av det andra steget har involverat eflornitin eller en kombination av nifurtimox och eflornitin för TbG. Fexinidazol är en nyare behandling som kan tas genom munnen för båda stadierna av TbG. Medan melarsoprol fungerar för båda typerna, används det vanligtvis bara för TbR, på grund av allvarliga biverkningar. Utan behandling leder sömnsjukdom vanligtvis till döden.
Sjukdomen förekommer regelbundet i vissa regioner i Afrika söder om Sahara och befolkningen riskerar att vara cirka 70 miljoner i 36 länder. Uppskattningsvis 11 000 personer är för närvarande smittade med 2800 nya infektioner under 2015. År 2018 fanns det 977 nya fall. År 2015 orsakade det cirka 3 500 dödsfall, en minskning från 34 000 1990. Mer än 80% av dessa fall finns i Demokratiska republiken Kongo . Tre stora utbrott har inträffat i den senaste historien: ett från 1896 till 1906 främst i Uganda och Kongo Basin och två 1920 och 1970 i flera afrikanska länder. Det klassificeras som en försummad tropisk sjukdom . Andra djur, som kor, kan bära sjukdomen och bli infekterade, i så fall kallas den Nagana eller animalisk trypanosomiasis .
tecken och symtom
Afrikanska trypanosomiasis symptom uppträder i två steg: det hemolymfatiska stadiet och det neurologiska stadiet (det senare kännetecknas av parasitisk invasion av centrala nervsystemet). Neurologiska symtom uppträder dock utöver de inledande funktionerna, och de två stadierna kan vara svåra att skilja utifrån enbart kliniska särdrag.
Sjukdomen har rapporterats uppvisa atypiska symptom hos infekterade individer som kommer från icke-endemiska områden (t.ex. resenärer). Orsakerna till detta är oklara och kan vara genetiska. Det låga antalet sådana fall kan också ha skeva fynd. Hos sådana personer sägs infektionen huvudsakligen uppstå som feber med gastrointestinala symtom (t.ex. diarré och gulsot) och lympadenopati utvecklas endast sällan.
Trypanosomal chancre
Systemisk sjukdom föregås ibland av en trypanosomal chancre som utvecklas på platsen för det infektiösa flugbettet inom 2 dagar efter infektion. Chancre observeras oftast i T. b. rhodesiense infektion, och endast sällan i T. b. gambiense (men i T. b. gambiense- infektion är chans vanligare hos personer från icke-endemiska områden).
Hemolymfatisk fas
Inkubationstiden är 1-3 veckor för T. b. rhodesiense, och längre (men mindre exakt karaktäriserad) i T. b. gambiense infektion. Det första/initiala stadiet, känt som hemolymfatisk fas, kännetecknas av ospecifika, generaliserade symtom som: feber (intermittent) , huvudvärk (svår), ledvärk , klåda , svaghet, sjukdomskänsla, trötthet, viktminskning, lymfadenopati och hepatosplenomegali.
Diagnosen kan försenas på grund av att de första symptomen är otydliga. Sjukdomen kan också misstas som malaria (som faktiskt kan uppstå som en saminfektion).
Intermittent feber
Feber är intermittent, med attacker som varar från en dag till en vecka, separerade med intervall om några dagar till en månad eller längre. Episoder av feber blir mindre frekventa under sjukdomens gång.
Lymfadenopati
Invasion av cirkulations- och lymfsystemet av parasiten är förknippad med svår svullnad av lymfkörtlar , ofta till enorma storlekar. Bakre cervikala lymfkörtlar påverkas oftast, men axillär, inguinal och epitroklear lymfkörteln kan också förekomma. Winterbottoms tecken , de berättande svullna lymfkörtlarna längs nacken, kan dyka upp. Winterbottoms tecken är vanligt i T. b. gambiense infektion.
Andra funktioner
De drabbade kan dessutom uppvisa hudutslag, hemolytisk anemi, hepatomegali och onormal leverfunktion, splenomegali, endokrina störningar, hjärtinblandning (t.ex. perikardit och hjärtsvikt) och oftalmiskt engagemang.
Många fläckar av blödning i benets hud hos en person smittad med T. b. rhodesiense
Neurologisk fas
Sjukdomens andra fas, den neurologiska fasen (även kallad meningoencefaliskt stadium ), börjar när parasiten invaderar centrala nervsystemet genom att passera genom blod -hjärnbarriären . Framsteg till den neurologiska fasen sker efter uppskattningsvis 21–60 dagar vid T. b. rhodesiens e infektion, och 300–500 dagar vid T. b. gambiense infektion.
I själva verket överlappar de två faserna och är svåra att skilja utifrån kliniska egenskaper enbart; bestämma det verkliga stadiet av sjukdomen uppnås genom att undersöka cerebrospinalvätskan för förekomsten av parasiten.
Sömnstörningar
Sömn-vakna störningar är ett ledande inslag i det neurologiska stadiet och gav sjukdomen dess vanliga namn afrikansk sömnsjukdom . Infekterade individer upplever en oorganiserad och fragmenterad sömn-väckningscykel. De drabbade upplever sömninversion vilket resulterar i sömn och sömnighet på dagtid och perioder med vakenhet och sömnlöshet. Dessutom drabbas de drabbade också av episoder av plötslig sömnighet.
Neurologiska/neurokognitiva symptom
Neurologiska symtom inkluderar: tremor , allmän muskelsvaghet, hemiparese , förlamning av en extremitet, onormal muskelton, gångstörning, ataxi, talstörningar, parestesi, hyperestesi, anestesi, synstörning, onormala reflexer, anfall och koma. Parkinsonliknande rörelser kan uppstå på grund av ospecifika rörelsestörningar och talstörningar.
Psykiatriska/beteendemässiga symptom
Individer kan uppvisa psykiatriska symptom som ibland kan dominera den kliniska diagnosen och kan inkludera aggressivitet, apati , irritabilitet, psykotiska reaktioner och hallucinationer , ångest , känslomässig labilitet , förvirring , mani , uppmärksamhetsbrist och delirium .
Avancerad/sen sjukdom och resultat
Utan behandling är sjukdomen alltid dödlig, med progressiv mental försämring som leder till koma, systemiskt organsvikt och död. En obehandlad infektion med T. b. rhodesiense kommer att orsaka död inom månader medan en obehandlad infektion med T. b. gambiense kommer att orsaka död efter flera år. Skador som orsakas i den neurologiska fasen är oåterkalleliga.
Orsak
Trypanosoma brucei gambiense står för majoriteten av afrikanska trypanosomiasisfall, med människor som den huvudsakliga reservoaren som behövs för överföringen, medan Trypanosoma brucei rhodesiense huvudsakligen är zoonotisk, med enstaka mänsklig infektion. Afrikansk trypanosomiasis är beroende av interaktionen mellan parasiten (trypanosomen) med tsetseflugorna (vektor), liksom värden (människa för Trypanosoma brucei gambiense och djur för Trypanosoma brucei rhodesiense ). Risken att drabbas av afrikansk trypanosomiasis är beroende av att komma i kontakt med en infekterad tsetsefluga.
Trypanosoma brucei
Det finns två underarter av parasiten som är ansvariga för att starta sjukdomen hos människor. Trypanosoma brucei gambiense orsakar sjukdomarna i västra och centrala Afrika , medan Trypanosoma brucei rhodesiense har ett begränsat geografiskt område och är ansvarig för att orsaka sjukdomen i östra och södra Afrika. Dessutom är en tredje underart av parasiten känd som Trypanosoma brucei brucei ansvarig för att drabba djur men inte människor.
Människor är huvudbehållaren för T. b. gambiense men denna art kan också hittas hos grisar och andra djur. Vilda viltdjur och nötkreatur är den huvudsakliga reservoaren för T. b. rhodesiense . Dessa parasiter infekterar främst individer i Afrika söder om Sahara eftersom det är där vektorn (tsetsefluga) finns. De två mänskliga formerna av sjukdomen varierar också mycket i intensitet. T. b. gambiense orsakar ett kroniskt tillstånd som kan förbli i en passiv fas i månader eller år innan symtomen dyker upp och infektionen kan pågå ungefär tre år innan döden inträffar.
T. b. rhodesiense är den akuta formen av sjukdomen, och döden kan inträffa inom månader sedan symtomen dyker upp inom några veckor och det är mer virulent och snabbare att utvecklas än T. b. gambiense . Dessutom omges trypanosomer av en skikt som består av olika ytglykoproteiner (VSG). Dessa proteiner verkar för att skydda parasiten från alla lytiska faktorer som finns i mänsklig plasma. Värdens immunsystem känner igen de glykoproteiner som finns på pälsen av parasiten vilket leder till produktion av olika antikroppar (IgM och IgG).
Dessa antikroppar kommer då att verka för att förstöra parasiterna som cirkulerar runt blodet. Från de flera parasiter som finns i plasman kommer dock ett litet antal av dem att uppleva förändringar i sina ytskikt som resulterar i bildandet av nya VSG. Således kommer antikropparna som produceras av immunsystemet inte längre att känna igen parasiten som leder till proliferation tills nya antikroppar skapas för att bekämpa de nya VSG: erna. Så småningom kommer immunsystemet inte längre att kunna bekämpa parasiten på grund av de ständiga förändringarna i VSG och infektion kommer att uppstå.
Vektor
| Typ | Trypanosom | Distribution | V ektor |
|---|---|---|---|
| Kronisk | T. brucei gambiense | Västra Afrika |
G. palpalis
G. tachinoides G. morsitans |
| Akut | T. brucei rhodesiense | Östra Afrika |
G. morsitans
G. swynnertoni G. pallidipes G. fuscipes |
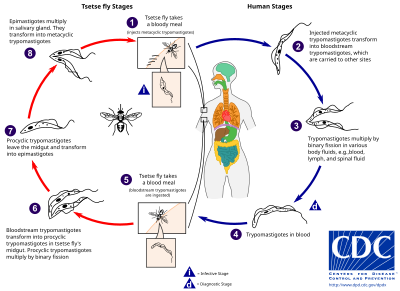
Den tsetseflugan (släktet Glossina ) är en stor, brun, bitande fluga som fungerar som både en värd och vektor för trypanosom parasiter. Medan blod tas från en däggdjursvärd injicerar en infekterad tsetsefluga metacykliska trypomastigoter i hudvävnad. Från bettet kommer parasiterna först in i lymfsystemet och passerar sedan in i blodomloppet. Inuti däggdjursvärden omvandlas de till trypomastigoter i blodomloppet och transporteras till andra platser i kroppen, når andra kroppsvätskor (t.ex. lymf, ryggmärgsvätska) och fortsätter att replikera genom binär klyvning .
Hela livscykeln för afrikanska trypanosomer representeras av extracellulära stadier. En tsetsefluga blir infekterad med trystomastigoter i blodet när man tar en blodmåltid på en infekterad däggdjursvärd. I flugans mittkärl förvandlas parasiterna till procykliska trypomastigoter, multipliceras med binär klyvning, lämnar mitten och förvandlas till epimastigoter. Epimastigoterna når flugans spottkörtlar och fortsätter att multiplicera med binär klyvning.
Hela livscykeln för flugan tar cirka tre veckor. Förutom tsetseflugans bett kan sjukdomen överföras av:
- Mor-till-barn-infektion: Trypanosomen kan ibland passera moderkakan och infektera fostret.
- Laboratorier: oavsiktliga infektioner, till exempel genom hantering av blod från en infekterad person och organtransplantation, även om detta är ovanligt.
- Blodtransfusion
- Sexuell kontakt (detta kan vara möjligt)
Hästflugor ( Tabanidae ) och stallflugor ( egentliga flugor ) möjligen spela en roll i överföringen av nagana (djuret form av sömnsjuka) och den mänskliga formen sjukdom.
Patofysiologi
Tryptophol är en kemisk förening som produceras av den trypanosomala parasiten vid sömnsjuka som framkallar sömn hos människor.
Diagnos

Guldstandarden för diagnos är identifiering av trypanosomer i ett prov genom mikroskopisk undersökning. Prover som kan användas för diagnos inkluderar chancrevätska , lymfkörtelaspirat, blod, benmärg och, under det neurologiska stadiet, cerebrospinalvätska . Detektion av trypanosomspecifika antikroppar kan användas för diagnos, men känsligheten och specificiteten hos dessa metoder är för varierande för att användas ensam för klinisk diagnos. Vidare inträffar serokonversion efter början av kliniska symptom under en T. b. rhodesiense infektion, så är av begränsad diagnostisk användning.
Trypanosomer kan detekteras från prover med hjälp av två olika preparat. Ett vått preparat kan användas för att leta efter de rörliga trypanosomerna. Alternativt kan ett fast (torkat) utstryk färgas med Giemsas eller Fields teknik och undersökas under ett mikroskop. Ofta finns parasiten relativt låg i provet, så tekniker för att koncentrera parasiterna kan användas före mikroskopisk undersökning. För blodprov inkluderar dessa centrifugering följt av undersökning av buffy coat ; mini-anjonbyte/centrifugering; och den kvantitativa buffy coat (QBC) tekniken. För andra prover, såsom spinalvätska, inkluderar koncentrationstekniker centrifugering följt av undersökning av sedimentet.
Tre serologiska tester finns också tillgängliga för detektion av parasiten: micro-CATT (kortagglutinationstest för trypanosomiasis), wb-CATT och wb-LATEX. Den första använder torkat blod, medan de andra två använder helblodsprov. En studie från 2002 visade att wb-CATT var den mest effektiva för diagnos, medan wb-LATEX är en bättre undersökning för situationer där större känslighet krävs.
Förebyggande
För närvarande finns det få medicinskt relaterade förebyggande alternativ för afrikansk trypanosomiasis (dvs inget vaccin finns för immunitet). Även om risken för infektion från en tsetse flugbett är liten (uppskattad till mindre än 0,1%), är användningen av insektsmedel, långärmade kläder, undvikande av tsetse-täta områden, implementering av bush clearance-metoder och avlivning av vilt vilt det bästa alternativ för att undvika infektion för lokalinvånare i drabbade områden.
I juli 2000 antogs en resolution om att bilda Pan African Tsetse and Trypanosomiasis Eradication Campaign (PATTEC). Kampanjen arbetar med att utrota tsetsevektorpopulationerna och därefter protozo-sjukdomen, genom användning av insekticidimpregnerade mål, flugfällor, insekticidbehandlat nötkreatur, ultralåga doser från luften/marken (SAT) av tsetse-viloplatser och det sterila insektteknik (SIT). Användningen av SIT i Zanzibar visade sig vara effektiv för att eliminera hela populationen av tsetseflugor men var dyr och är relativt opraktisk att använda i många av de endemiska länder som drabbats av afrikansk trypanosomiasis.
Ett pilotprogram i Senegal har minskat tsetseflugpopulationen med så mycket som 99% genom att införa hanflugor som har steriliserats genom exponering för gammastrålning .
Regelbunden aktiv övervakning, som involverar upptäckt och snabb behandling av nya infektioner och tsetse flugkontroll är ryggraden i strategin som används för att kontrollera sömnsjuka. Systematisk screening av riskgrupper är det bästa sättet, eftersom screening från fall till fall inte är praktisk i endemiska regioner. Systematisk screening kan vara i form av mobila kliniker eller fasta screeningcentra där team dagligen reser till områden med höga infektionshastigheter. Sådana screeningansträngningar är viktiga eftersom tidiga symtom inte är uppenbara eller tillräckligt allvarliga för att motivera personer med gambiense -sjukdom att söka läkarvård, särskilt i mycket avlägsna områden. Diagnosen av sjukdomen är också svår och vårdpersonal kan inte associera sådana allmänna symptom med trypanosomiasis. Systematisk screening gör det möjligt att upptäcka och behandla sjukdomar i ett tidigt skede innan sjukdomen fortskrider och ta bort den potentiella mänskliga reservoaren. Ett enda fall av sexuell överföring av västafrikansk sömnsjukdom har rapporterats.
Behandling
Första stadiet
Behandlingen för första stegets sjukdom är fexinidazol i munnen eller pentamidin genom injektion för T. b. gambiense . Suramin genom injektion används för T. b. rhodesiense .
Andra fasen
Fexinidazol kan användas för det andra stadiet av TbG, om sjukdomen inte är allvarlig. Annars verkar en behandling som innefattar kombinationen av nifurtimox och eflornithine , nifurtimox-eflornithine kombinationsbehandling (NECT) eller eflornithine ensam vara mer effektiv och resultera i färre biverkningar. Dessa behandlingar kan ersätta melarsoprol när det är tillgängligt. NECT har fördelen av att kräva mindre injektioner av eflornitin.
Intravenös melarsoprol var tidigare standardbehandling för sjukdom i andra stadiet (neurologisk fas) och är effektiv för båda typerna. Melarsoprol är den enda behandlingen för andra etappen T. b. rhodesiense ; det orsakar dock död hos 5% av de som tar det. Motstånd mot melarsoprol kan förekomma.
Prognos
Om den inte behandlas, T. b. gambiense resulterar nästan alltid i dödsfall, med endast några få individer som under en långsiktig 15 års uppföljning har överlevt efter att ha vägrat behandling. T. b. rhodesiense , som är en mer akut och svår form av sjukdomen, är genomgående dödlig om den inte behandlas. Sjukdomsutvecklingen varierar mycket beroende på sjukdomsform. För individer som är infekterade av T. b. gambiense , som står för 98% av alla rapporterade fall, kan en person smittas i månader eller till och med år utan tecken eller symtom fram till det avancerade sjukdomsstadiet, där det är för sent att behandlas framgångsrikt. För individer som påverkas av T. b. rhodesiense , som står för 2% av alla rapporterade fall, uppträder symtom inom veckor eller månader efter infektionen. Sjukdomsutvecklingen är snabb och invaderar centrala nervsystemet och orsakar död inom en kort tid.
Epidemiologi

År 2010 orsakade det cirka 9 000 dödsfall, en minskning från 34 000 1990. Från och med 2000 är de funktionshinderjusterade liv åren (9 till 10 år) förlorade på grund av sömnsjuka 2,0 miljoner. Från 2010–2014 fanns det uppskattningsvis 55 miljoner människor i riskzonen för gambiense afrikansk trypanosomiasis och över 6 miljoner människor i riskzonen för rhodesiense afrikansk trypanosomiasis. År 2014 rapporterade Världshälsoorganisationen 3797 fall av human afrikansk trypanosomiasis när det förutsagda antalet fall skulle vara 5000. Antalet rapporterade fall 2014 är en minskning med 86% till det totala antalet fall som rapporterades år 2000.
Sjukdomen har registrerats som förekommer i 37 länder, alla i Afrika söder om Sahara. Det förekommer regelbundet i sydöstra Uganda och västra Kenya och dödade mer än 48 000 afrikaner 2008. Demokratiska republiken Kongo är det mest drabbade landet i världen och står för 75% av Trypanosoma brucei gambiense -fall. Befolkningen i riskzonen är cirka 69 miljoner med en tredjedel av detta antal på en ”mycket hög” till ”måttlig” risk och de återstående två tredjedelarna med en ”låg” till ”mycket låg” risk. Antalet personer som drabbas av sjukdomen har minskat. I denna takt är eliminering av sömnsjukdom en möjlighet. Världshälsoorganisationen planerar att utrota sömnsjuka år 2030.
| Trypanosoma brucei gambiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Angola | 1498 | 2094 | 2406 | 1796 | 1274 | 2441 | 6726 | 8275 | 6610 | 5351 | 4546 | 4577 | 3621 | 3115 | 2280 | 1727 | 1105 | 648 | 517 | 247 | 211 | 154 | 70 | 69 | 36 | 35 | 19 | 18 | 79 | 30 |
| Benin | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Burkina Faso | 27 | 27 | 20 | 17 | 18 | 13 | 12 | 1 | 15 | 15 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Kamerun | 86 | 69 | 21 | 3 | 20 | 21 | 17 | 10 | 54 | 32 | 27 | 14 | 32 | 33 | 17 | 3 | 15 | 7 | 13 | 24 | 16 | 15 | 7 | 6 | 7 | 6 | 6 | 5 | 7 | 17 |
| Centralafrikanska republiken | 308 | 197 | 362 | 262 | 368 | 676 | 492 | 730 | 1068 | 869 | 988 | 718 | 572 | 539 | 738 | 666 | 460 | 654 | 1194 | 1054 | 395 | 132 | 381 | 59 | 194 | 147 | 124 | 76 | 57 | 86 |
| Tchad | 20 | 221 | 149 | 65 | 214 | 315 | 178 | 122 | 134 | 187 | 153 | 138 | 715 | 222 | 483 | 190 | 276 | 97 | 196 | 510 | 232 | 276 | 197 | 195 | 95 | 67 | 53 | 28 | 12 | 16 |
| Kongo | 580 | 703 | 727 | 829 | 418 | 475 | 474 | 142 | 201 | 91 | 111 | 894 | 1005 | 717 | 873 | 398 | 300 | 189 | 182 | 87 | 87 | 61 | 39 | 20 | 21 | 36 | 18 | 15 | 24 | 17 |
| Elfenbenskusten | 365 | 349 | 456 | 260 | 206 | 326 | 240 | 185 | 121 | 104 | 188 | 92 | 97 | 68 | 74 | 42 | 29 | 13 | 14 | 8 | 8 | 10 | 9 | 7 | 6 | 3 | 0 | 3 | 2 | 1 |
| Demokratiska republiken Kongo | 7515 | 5825 | 7757 | 11384 | 19021 | 18182 | 19342 | 25094 | 26318 | 18684 | 16951 | 17300 | 13816 | 11459 | 10339 | 10249 | 8013 | 8155 | 7318 | 7178 | 5624 | 5590 | 5968 | 5647 | 3205 | 2351 | 1769 | 1110 | 660 | 604 |
| Ekvatorialguinea | 63 | 36 | 45 | 30 | 85 | 37 | 46 | 67 | 62 | 28 | 16 | 17 | 32 | 23 | 22 | 17 | 13 | 15 | 11 | 7 | 8 | 1 | 2 | 3 | 0 | 0 | 3 | 4 | 4 | 3 |
| Gabon | 80 | 45 | 33 | 80 | 61 | 20 | 32 | 11 | 6 | 38 | 45 | 30 | 26 | 26 | 49 | 53 | 31 | 30 | 24 | 14 | 22 | 17 | 9 | 17 | 10 | 9 | 10 | 9 | 16 | 8 |
| Ghana | 3 | 6 | 16 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Guinea | 52 | 29 | 24 | 27 | 26 | 33 | 38 | 88 | 99 | 68 | 52 | 72 | 132 | 130 | 95 | 94 | 48 | 69 | 90 | 79 | 68 | 57 | 70 | 78 | 33 | 29 | 107 | 140 | 74 | 69 |
| Mali | 0 | 0 | 0 | 27 | 17 | 11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nigeria | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 27 | 14 | 14 | 26 | 31 | 10 | 21 | 3 | 0 | 0 | 0 | 2 | 3 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| södra Sudan | 67 | 58 | 28 | 62 | 69 | 56 | 157 | 737 | 1726 | 1312 | 1801 | 1919 | 3121 | 3061 | 1742 | 1853 | 789 | 469 | 623 | 373 | 199 | 272 | 317 | 117 | 63 | 45 | 17 | 12 | 17 | 11 |
| Togo | 2 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Uganda | 2066 | 1328 | 2042 | 1764 | 1469 | 1062 | 981 | 1123 | 971 | 1036 | 948 | 310 | 604 | 517 | 378 | 311 | 290 | 120 | 198 | 99 | 101 | 44 | 20 | 9 | 9 | 4 | 4 | 0 | 1 | 2 |
| Total | 12756 | 10987 | 14088 | 16607 | 23266 | 23671 | 28736 | 36585 | 37385 | 27862 | 25841 | 26095 | 23799 | 19941 | 17100 | 15624 | 11372 | 10466 | 10380 | 9680 | 6973 | 6632 | 7091 | 6228 | 3679 | 2733 | 2131 | 1420 | 953 | 864 |
| Trypanosoma brucei rhodesiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
| Kenya | 91 | 8 | 4 | 2 | 1 | 0 | 2 | 5 | 14 | 22 | 15 | 10 | 11 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Malawi | 228 | 195 | 143 | 53 | 31 | 15 | 8 | 7 | 10 | 11 | 35 | 38 | 43 | 70 | 48 | 41 | 58 | 50 | 49 | 39 | 29 | 23 | 18 | 35 | 32 | 30 | 37 | 7 | 15 | 91 |
| Moçambique | 3 | 7 | 24 | 10 | 16 | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | 1 | Inga data | 1 | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data |
| Uganda | 1417 | 832 | 606 | 503 | 342 | 497 | 178 | 217 | 283 | 283 | 300 | 426 | 329 | 338 | 335 | 473 | 261 | 119 | 138 | 129 | 112 | 84 | 71 | 43 | 70 | 28 | 10 | 13 | 4 | 5 |
| Förenade republiken Tanzania | 187 | 177 | 366 | 262 | 319 | 422 | 400 | 354 | 299 | 288 | 350 | 277 | 228 | 113 | 159 | 186 | 127 | 126 | 59 | 14 | 5 | 1 | 4 | 1 | 1 | 2 | 3 | 3 | 0 | 3 |
| Zambia | 7 | Inga data | 4 | 1 | 1 | 1 | 3 | Inga data | Inga data | 15 | 9 | 4 | 5 | 15 | 9 | 7 | 6 | 10 | 13 | 4 | 8 | 3 | 6 | 6 | 12 | 8 | 2 | 3 | 5 | 15 |
| Zimbabwe | Inga data | Inga data | Inga data | Inga data | 1 | Inga data | Inga data | 9 | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | Inga data | 3 | Inga data | Inga data | 0 | 3 | 2 | 4 | 9 | 1 | 3 | 3 | 1 | 1 | 0 | 2 |
| Total | 1933 | 1219 | 1147 | 831 | 710 | 935 | 591 | 583 | 606 | 619 | 709 | 755 | 617 | 536 | 552 | 707 | 453 | 305 | 259 | 187 | 154 | 111 | 101 | 85 | 115 | 68 | 52 | 27 | 24 | 116 |
Historia

Tillståndet har funnits i Afrika i tusentals år. På grund av bristande resor mellan ursprungsbefolkningen hade sömnsjuka hos människor begränsats till isolerade fickor. Detta förändrades efter att arabiska slavhandlare kommit in i centrala Afrika från öst, efter Kongofloden och förde med sig parasiter. Gambisk sömnsjukdom reste uppför Kongofloden och sedan vidare österut.
En arabisk författare från 1300-talet lämnade följande beskrivning i fallet med en sultan i Mali-kungariket: "Hans slut skulle bli omkörd av sömnsjukan ( illat an-nawm ) som är en sjukdom som ofta drabbar invånarna i dessa länder särskilt deras hövdingar. Sömnen överträffar en av dem på ett sådant sätt att det knappast är möjligt att väcka honom. "
Den brittiska sjökirurgen John Atkins beskrev sjukdomen vid sin återkomst från Västafrika 1734:
Den sömniga distemperen (vanlig bland negrarna) ger inget annat tidigare meddelande än att man vill ha aptit 2 eller 3 dagar innan; deras sömn är sund och känsla och känsla väldigt lite; för att dra, droppa eller piska kommer knappast att väcka upp Sense and Power tillräckligt för att röra sig; och det ögonblick du slutar slå de smarta är glömd, och neråt faller de igen in i ett tillstånd av okänslighet, som hela tiden driver från munnen som i djup saliv; andas långsamt, men inte ojämnt eller fnys. Unga människor är mer utsatta för det än de gamla; och domen i allmänhet uttalad är döden, Prognostiken misslyckas sällan. Om då och då en av dem återhämtar sig, förlorar han verkligen den lilla anledningen han hade och vänder Ideot ...
Den franske marinkirurgen Marie-Théophile Griffon du Bellay behandlade och beskrev fall medan han var stationerad ombord på sjukhusfartyget Caravane i Gabon i slutet av 1860-talet.
1901 utbröt en förödande epidemi i Uganda och dödade mer än 250 000 människor, inklusive cirka två tredjedelar av befolkningen i de drabbade sjöområdena. Enligt The Cambridge History of Africa , "Det har uppskattats att upp till hälften av folket dog av sömnsjuka och vattkoppor i länderna på endera stranden av nedre floden Kongo ."
Orsakssubstansen och vektorn identifierades 1903 av David Bruce , och underarterna av protozoerna differentierades 1910. Bruce hade tidigare visat att T. brucei var orsaken till en liknande sjukdom hos hästar och nötkreatur som överfördes av tsetseflugan ( Glossina morsitans ).
Den första effektiva behandlingen, liga atoxylen , en arsenik baserade läkemedel som utvecklats av Paul Ehrlich och Kiyoshi Shiga , infördes 1910, men blindhet var en allvarlig biverkning.
Suramin syntetiserades först av Oskar Dressel och Richard Kothe 1916 för Bayer . Det introducerades 1920 för att behandla det första stadiet av sjukdomen. År 1922 kombinerades Suramin i allmänhet med tryparsamid (ett annat femvärt organoarseniskt läkemedel), det första läkemedlet som kom in i nervsystemet och var användbart vid behandling av det andra steget i gambiense -formen. Tryparsamid tillkännagavs i Journal of Experimental Medicine 1919 och testades i Belgiska Kongo av Louise Pearce från Rockefeller Institute 1920. Det användes under den stora epidemin i Väst- och Centralafrika på miljontals människor och var grundpelaren i terapin fram till 1960 -talet. Amerikanska medicinska missionären Arthur Lewis Piper var aktiv med att använda tryparsamid för att behandla sömnsjuka i Belgiska Kongo 1925.
Pentamidin , ett mycket effektivt läkemedel för det första stadiet av sjukdomen, har använts sedan 1937. Under 1950 -talet användes det i stor utsträckning som ett profylaktiskt medel i västra Afrika, vilket ledde till en kraftig nedgång i infektionsgraden. Då trodde man att sjukdomen skulle utrotas.
Den organoarseniska melarsoprol (Arsobal) som utvecklades på 1940-talet är effektiv för personer med sömnsjukdom i andra steget. 3–10% av de injicerade har emellertid reaktiv encefalopati (kramper, progressiv koma eller psykotiska reaktioner) och 10–70% av sådana fall leder till döden; det kan orsaka hjärnskador hos dem som överlever encefalopati. Men på grund av dess effektivitet används melarsoprol fortfarande idag. Motståndet mot melarsoprol ökar, och kombinationsterapi med nifurtimox undersöks för närvarande.
Eflornithine (difluoromethylornithine eller DFMO), den mest moderna behandlingen, utvecklades på 1970 -talet av Albert Sjoerdsma och genomgick kliniska prövningar på 1980 -talet. Läkemedlet godkändes av United States Food and Drug Administration 1990. Aventis , företaget som ansvarar för tillverkningen, stoppade produktionen 1999. År 2001 undertecknade Aventis, i samarbete med Läkare Utan Gränser och Världshälsoorganisationen , en lång- avtal om tillverkning och donering av läkemedlet.
Förutom sömnsjuka har tidigare namn inkluderat negro -slöhet, maladie du sommeil (Fr), Schlafkrankheit (Ger), afrikansk slöhet och kongo trypanosomiasis.
- Den brittiskt ledda sovande sjukskommissionen som samlar tsetseflugor, Uganda och Nyasaland , 1908-1913
Forskning
Parasitens genom har sekvenserats och flera proteiner har identifierats som potentiella mål för läkemedelsbehandling. Analys av genomet avslöjade också anledningen till att det har varit så svårt att skapa ett vaccin mot denna sjukdom. T. brucei har över 800 gener som gör proteiner till parasiten "blandar och matchar" för att undvika upptäckt av immunsystemet.
Att använda en genetiskt modifierad form av en bakterie som förekommer naturligt i tarmarna i vektorerna studeras som en metod för att kontrollera sjukdomen.
Nya fynd tyder på att parasiten inte kan överleva i blodomloppet utan dess flagellum . Denna insikt ger forskare en ny vinkel att attackera parasiten med.
Trypanosomiasis -vacciner genomgår forskning.
Dessutom har Drugs for Neglected Disease Initiative bidragit till den afrikanska sömnsjukforskningen genom att utveckla en förening som kallas fexinidazol . Detta projekt startades ursprungligen i april 2007 och registrerade 749 personer i Demokratiska republiken Kongo och Centralafrikanska republiken . Resultaten visade effekt och säkerhet i båda stadierna av sjukdomen, både hos vuxna och barn ≥ 6 år och väger ≥ 20 kg. Den europeiska läkemedelsmyndigheten godkänt den för första och andra skede av sjukdomen utanför Europa i november 2018. Behandlingen godkändes i DRK i December 2018.
Finansiering
För aktuell finansieringsstatistik är mänsklig afrikansk trypanosomiasis grupperad med kinetoplastidinfektioner. Kinetoplastider hänvisar till en grupp flagellatprotozoer. Kinetoplastidinfektioner inkluderar afrikansk sömnsjukdom, Chagas sjukdom och Leishmaniasis. Sammantaget stod dessa tre sjukdomar för 4,4 miljoner funktionshinderjusterade levnadsår (DALY) och ytterligare 70 075 registrerade dödsfall årligen. För kinetoplastidinfektioner var den totala globala forsknings- och utvecklingsfinansieringen cirka 136,3 miljoner dollar 2012. Var och en av de tre sjukdomarna, afrikansk sömnsjukdom, Chagas sjukdom och Leishmaniasis fick var och en ungefär en tredjedel av finansieringen, vilket var cirka 36,8 miljoner dollar , 38,7 miljoner dollar respektive 31,7 miljoner dollar.
För sömnsjuka delades finansieringen in i grundforskning, upptäckt av läkemedel, vacciner och diagnostik. Det största beloppet gick till grundforskning av sjukdomen; cirka 21,6 miljoner dollar riktades till den insatsen. När det gäller terapeutisk utveckling investerades cirka 10,9 miljoner dollar.
Den främsta finansiären för forskning och utveckling av kinetoplastidinfektion är offentliga källor. Cirka 62% av finansieringen kommer från höginkomstländer medan 9% kommer från låg- och medelinkomstländer. Höginkomstländernas offentliga finansiering är den största bidragsgivaren till den försummade sjukdomsforskningen. Under de senaste åren har dock finansiering från höginkomstländer minskat stadigt; år 2007 gav höginkomstländerna 67,5% av den totala finansieringen medan höginkomstländernas offentliga medel 2012 endast gav 60% av den totala finansieringen för kinetoplastidinfektioner. Denna nedåtgående trend lämnar ett gap för andra finansiärer, till exempel filantropiska stiftelser och privata läkemedelsföretag att fylla.
Mycket av de framsteg som gjorts inom afrikansk sömnsjukdom och försummad forskning som helhet är ett resultat av de andra icke-offentliga finansiärerna. En av dessa stora finansieringskällor har kommit från stiftelser, som alltmer har blivit mer engagerade i försummade upptäckter av läkemedelssjukdomar under 2000 -talet. 2012 gav filantropiska källor 15,9% av den totala finansieringen. Bill and Melinda Gates Foundation har varit ledande när det gäller att tillhandahålla finansiering för försummad utveckling av sjukdomsmedicin. De har gett 444,1 miljoner dollar till försummade sjukdomsforskningar 2012. Hittills har de donerat över 1,02 miljarder dollar till försummade insatser för att upptäcka sjukdomar.
För kinetoplastidinfektioner specifikt har de donerat i genomsnitt 28,15 miljoner dollar årligen mellan åren 2007 till 2011. De har märkt mänsklig afrikansk trypanosomiasis som ett mål med hög möjlighet vilket innebär att det är en sjukdom som ger störst möjlighet till kontroll, eliminering och utrotning, genom utveckling av nya läkemedel, vacciner, folkhälsoprogram och diagnostik. De är den näst högsta finansieringskällan för försummade sjukdomar, direkt bakom US National Institutes of Health. I en tid där offentliga medel minskar och statsbidrag för vetenskaplig forskning är svårare att få, har den filantropiska världen gått in för att driva forskningen framåt.
En annan viktig del av ökat intresse och finansiering har kommit från industrin. Under 2012 bidrog de med 13,1% totalt till kinetoplastids forsknings- och utvecklingsarbete, och har dessutom spelat en viktig roll genom att bidra till offentlig-privata partnerskap (PPP) samt produktutvecklingspartnerskap (PDP). Ett offentlig-privat partnerskap är ett arrangemang mellan en eller flera offentliga enheter och en eller flera privata enheter som finns för att uppnå ett specifikt hälsoutfall eller för att producera en hälsoprodukt. Partnerskapet kan existera på många sätt; de kan dela och utbyta medel, egendom, utrustning, personal och immateriella rättigheter. Dessa offentlig-privata partnerskap och produktutvecklingspartnerskap har upprättats för att hantera utmaningar inom läkemedelsindustrin, särskilt relaterat till försummad sjukdomsforskning. Dessa partnerskap kan bidra till att öka omfattningen av ansträngningarna för terapeutisk utveckling genom att använda olika kunskaper, färdigheter och expertis från olika källor. Dessa typer av partnerskap har visat sig vara mer effektiva än industrin eller offentliga grupper som arbetar självständigt.
Andra djur och reservoarer
Trypanosoma av både rhodesiense och gambiense typer kan påverka andra djur som boskap och vilda djur. Afrikansk trypanosomiasis har i allmänhet ansetts vara en antroponotisk sjukdom och därför var dess kontrollprogram huvudsakligen inriktat på att stoppa överföringen genom att behandla mänskliga fall och eliminera vektorn. Djurreservoarer rapporterades emellertid möjligen spela en viktig roll för den endemiska naturen hos afrikansk trypanosomiasis och för dess återupplivning i de historiska fokuserna i Väst- och Centralafrika.
Referenser
externa länkar
| Scholia har en ämnesprofil för afrikansk trypanosomiasis . |
- "En doktors dröm" . stories.dndi.org . Hämtad 14 maj 2020 .
- "Sovsjukdom" . Läkare utan gränser . Arkiverad från originalet den 23 oktober 2013.
- Länkar till bilder på Sleeping Sickness (Hardin MD/ University of Iowa )
- Hale Carpenter G (1920). En naturforskare vid Victoriasjön, med en redogörelse för sömnsjuka och Tse-tse-flugan . Unwin. OCLC 2649363 .
| Klassificering | |
|---|---|
| Externa resurser |