Konfokal mikroskopi - Confocal microscopy
| Konfokal mikroskopi | |
|---|---|
| Maska | D018613 |
| OPS-301-kod | 3-301 |
Konfokalmikroskopi , oftast konfokal laserscanningsmikroskopi ( CLSM ) eller laser konfokal scanning microscopy ( LCSM är), en optisk bildteknik för att öka optisk upplösning och kontrast hos en mikrofoto med hjälp av användning av en spatial pinhole att blockera ut-fokus ljus i bildbildning. Att fånga flera tvådimensionella bilder på olika djup i ett prov möjliggör rekonstruktion av tredimensionella strukturer (en process som kallas optisk snittning ) inom ett objekt. Denna teknik används flitigt i de vetenskapliga och industrimiljöerna och typiska tillämpningar är inom biovetenskap , halvledarinspektion och materialvetenskap .
Ljus rör sig genom provet under ett konventionellt mikroskop så långt in i provet som det kan tränga in, medan ett konfokalt mikroskop bara fokuserar en mindre ljusstråle på en smal djupnivå åt gången. CLSM uppnår ett kontrollerat och mycket begränsat skärpedjup.
Grundläggande koncept
Principen för konfokal avbildning patenterades 1957 av Marvin Minsky och syftar till att övervinna vissa begränsningar av traditionella bredfältsfluorescensmikroskop . I ett konventionellt (dvs vidfält) fluorescensmikroskop översvämmas hela provet jämnt i ljus från en ljuskälla. Alla delar av provet kan exciteras samtidigt och den resulterande fluorescensen detekteras av mikroskopets fotodetektor eller kamera inklusive en stor ofokuserad bakgrundsdel. Däremot använder ett konfokalt mikroskop punktbelysning (se Point Spread-funktion ) och ett hål i ett optiskt konjugerat plan framför detektorn för att eliminera out-of-focus-signal-namnet "confocal" härrör från denna konfiguration. Eftersom endast ljus som alstras av fluorescens mycket nära fokalplanet kan detekteras, är bildens optiska upplösning , särskilt i provdjupets riktning, mycket bättre än vid bredfältsmikroskop. Men eftersom mycket av ljuset från provfluorescens blockeras vid hålet, är denna ökade upplösning på bekostnad av minskad signalintensitet - så lång exponering krävs ofta. För att kompensera denna minskning av signalen efter pinhålet , detekteras ljusintensiteten av en känslig detektor, vanligtvis ett fotomultiplikatorrör (PMT) eller lavinfotodiod , som omvandlar ljussignalen till en elektrisk.
Eftersom endast en punkt i provet belyses i taget kräver 2D- eller 3D -avbildning skanning över en vanlig raster (dvs ett rektangulärt mönster av parallella skanningslinjer) i provet. Strålen skannas över provet i horisontalplanet med hjälp av en eller flera ( servostyrda ) oscillerande speglar. Denna scanningsmetod har vanligtvis en låg reaktions latens och avsökningshastigheten kan varieras. Långsammare skanningar ger ett bättre signal-brusförhållande , vilket resulterar i bättre kontrast .
Den uppnåbara tjockleken hos fokalplanet definieras mestadels av våglängden hos den använda ljus dividerat med numeriska aperturen hos objektivlinsen , men också av de optiska egenskaperna hos provet. Den tunna optiska snittningen gör dessa typer av mikroskop särskilt bra vid 3D -avbildning och ytprofilering av prover.
Efterföljande skivor utgör en 'z-stack', som antingen kan bearbetas för att skapa en 3D-bild, eller den slås samman till en 2D-stack (övervägande maximalt pixelintensitet tas, andra vanliga metoder inkluderar att använda standardavvikelsen eller summera pixlar).
Konfokalmikroskopi ger kapacitet för direkt, icke-invasiv, seriell optisk snittning av intakta, tjocka, levande exemplar med ett minimum av provberedning samt en marginell förbättring av lateral upplösning jämfört med vidfältsmikroskopi. Biologiska prover behandlas ofta med fluorescerande färgämnen för att synliggöra utvalda föremål. Den faktiska färgämneskoncentrationen kan dock vara låg för att minimera störningen av biologiska system: vissa instrument kan spåra enstaka fluorescerande molekyler. Också, transgena kan tekniker skapa organismer som producerar sina egna fluorescerande chimära molekyler (såsom en fusion av GFP, grönt fluorescerande protein med proteinet av intresse). Konfokalmikroskop arbetar på principen om punktexcitation i provet (diffraktionsbegränsad fläck) och punktdetektering av den resulterande fluorescerande signalen. Ett pinhål vid detektorn ger en fysisk barriär som blockerar fluorescens som inte är i fokus. Endast in-focus, eller central plats på Airy-disken , spelas in.
Tekniker som används för horisontell skanning
Fyra typer av konfokala mikroskop är kommersiellt tillgängliga:
Konfokala laserskanningsmikroskop använder flera speglar (vanligtvis 2 eller 3 skannar linjärt längs x- och y-axlarna) för att skanna lasern över provet och "avskanna" bilden över ett fast hål och en detektor. Denna process är vanligtvis långsam och fungerar inte för levande avbildning, men kan vara användbart för att skapa högupplösta representativa bilder av fasta prover.
Spinning-disk ( Nipkow disk ) konfokalmikroskop använder en serie rörliga hål på en skiva för att skanna ljusfläckar. Eftersom en serie nålhål skannar ett område parallellt får varje hål sväva över ett specifikt område under en längre tid, vilket minskar den excitationsenergi som behövs för att belysa ett prov jämfört med laserskannande mikroskop. Minskad excitationsenergi minskar fototoxicitet och fotoblekning av ett prov, vilket ofta gör det till det föredragna systemet för avbildning av levande celler eller organismer.
Mikrolensförstärkta eller dubbla snurrskivkonfokalmikroskop fungerar enligt samma principer som snurrskivkonfokalmikroskop förutom att en andra snurrskiva som innehåller mikrolinser placeras före snurrskivan som innehåller hålen. Varje pinhål har en tillhörande mikrolins. Mikrolinserna agerar för att fånga ett brett ljusband och fokusera det i varje hål vilket avsevärt ökar mängden ljus som riktas in i varje hål och minskar mängden ljus som blockeras av snurrskivan. Microlens förstärkta konfokalmikroskop är därför betydligt känsligare än vanliga spinndisksystem. Yokogawa Electric uppfann denna teknik 1992.
Programmerbara arraymikroskop (PAM) använder en elektroniskt styrd spatial light modulator (SLM) som producerar en uppsättning rörliga hål. SLM är en enhet som innehåller en uppsättning pixlar med viss egenskap ( opacitet , reflektivitet eller optisk rotation ) för de enskilda pixlarna som kan justeras elektroniskt. SLM innehåller mikroelektromekaniska speglar eller flytande kristallkomponenter . Bilden hämtas vanligtvis av en laddningskopplad enhet (CCD) kamera.
Var och en av dessa klasser av konfokalmikroskop har särskilda fördelar och nackdelar. De flesta system är antingen optimerade för inspelningshastighet (dvs. videoinspelning) eller hög rumslig upplösning. Konfokala laserskanningsmikroskop kan ha en programmerbar provtagningstäthet och mycket höga upplösningar medan Nipkow och PAM använder en fast provtagningstäthet definierad av kamerans upplösning. Avbildningsbildhastigheter är typiskt långsammare för enstaka punktlaseravsökningssystem än spinning-disk eller PAM-system. Kommersiella konfokalmikroskop med snurrande disk uppnår bildhastigheter på över 50 per sekund-en önskvärd funktion för dynamiska observationer som levande cellavbildning.
I praktiken tillåter Nipkow och PAM att flera hål skannar samma område parallellt så länge hålen är tillräckligt långt ifrån varandra.
Banbrytande utveckling av konfokal laserscanningmikroskopi möjliggör nu bättre avbildning än standardvideorate (60 bilder per sekund) genom att använda flera mikroelektromekaniska skanningsspeglar.
Konfokal röntgenfluorescensavbildning är en nyare teknik som möjliggör kontroll över djupet, förutom horisontell och vertikal siktning, till exempel när man analyserar nedgrävda lager i en målning.
Upplösning förbättring
CLSM är en skanningsbildteknik där den uppnådda upplösningen bäst förklaras genom att jämföra den med en annan skanningsteknik som den hos skanningselektronmikroskopet (SEM). CLSM har fördelen att den inte kräver att en sond ska hänga nanometrar från ytan, till exempel i en AFM eller STM , där bilden erhålls genom att skanna med en fin spets över en yta. Avståndet från objektivlinsen till ytan (kallad arbetsavstånd ) är vanligtvis jämförbart med det för ett konventionellt optiskt mikroskop. Det varierar med systemets optiska design, men arbetsavstånd från hundratals mikrometer till flera millimeter är typiska.
I CLSM belyses ett exemplar av en punktlaserkälla, och varje volymelement är associerat med en diskret spridnings- eller fluorescensintensitet. Här bestäms storleken på skanningsvolymen av spotstorleken (nära diffraktionsgränsen ) för det optiska systemet eftersom bilden av scanningslasern inte är en oändligt liten punkt utan ett tredimensionellt diffraktionsmönster. Storleken på detta diffraktionsmönster och fokalvolymen som det definieras styrs av den numeriska bländaren för systemets objektivlins och våglängden för den använda lasern. Detta kan ses som den klassiska upplösningsgränsen för konventionella optiska mikroskop med bredfältbelysning. Men med konfokalmikroskopi är det till och med möjligt att förbättra upplösningsgränsen för bredfältsbelysningstekniker eftersom konfokalöppningen kan stängas för att eliminera högre ordningar av diffraktionsmönstret. Till exempel, om nålhålsdiametern är inställd på 1 luftig enhet, gör endast den första ordningen i diffraktionsmönstret det genom bländaren till detektorn medan de högre orderna blockeras, vilket förbättrar upplösningen på bekostnad av en liten minskning av ljusstyrkan. I fluorescensobservationer begränsas upplösningsgränsen för konfokalmikroskopi ofta av signal till brusförhållandet som orsakas av det lilla antalet fotoner som vanligtvis finns i fluorescensmikroskopi. Man kan kompensera för denna effekt genom att använda mer känsliga fotodetektorer eller genom att öka intensiteten hos den belysande laserpunktskällan. Att öka intensiteten för belysningslaser riskerar överdriven blekning eller annan skada på provet av intresse, särskilt för experiment där jämförelse av fluorescensljusstyrka krävs. Vid avbildning av vävnader som är differentiellt brytbara, såsom svampig mesofyll av växtblad eller andra vävnader som innehåller luftutrymme, uttalas ofta sfäriska aberrationer som försämrar konfokal bildkvalitet. Sådana avvikelser kan emellertid minskas avsevärt genom att montera prover i optiskt transparenta, icke-toxiska perfluorkolväten såsom perfluorodekalin , som lätt infiltrerar vävnader och har ett brytningsindex som är nästan identiskt med vatten.
Användningsområden
CLSM används flitigt i olika biologiska vetenskapsdiscipliner , från cellbiologi och genetik till mikrobiologi och utvecklingsbiologi . Det används också inom kvantoptik och nanokristallbildning och spektroskopi.
Biologi och medicin
Kliniskt används CLSM vid utvärdering av olika ögonsjukdomar och är särskilt användbart för avbildning, kvalitativ analys och kvantifiering av endotelceller i hornhinnan . Det används för att lokalisera och identifiera förekomsten av filamentära svampelement i hornhinnestromen vid keratomykos , vilket möjliggör snabb diagnos och därmed tidig institution för definitiv behandling. Forskning om CLSM -tekniker för endoskopiska ingrepp ( endomikroskopi ) visar också lovande. Inom läkemedelsindustrin rekommenderades att följa tillverkningsprocessen för farmaceutiska former av tunnfilm för att kontrollera kvaliteten och enhetligheten i läkemedelsfördelningen. Konfokal mikroskopi används också för att studera biofilmer - komplexa porösa strukturer som är den föredragna livsmiljön för mikroorganismer. Vissa av tidsfilmens och rumsliga funktionen av biofilmer kan endast förstås genom att studera deras struktur på mikro- och mesoskalor. Studien av mikroskala behövs för att upptäcka aktivitet och organisation av enskilda mikroorganismer.
Optik och kristallografi
CLSM används som datahämtningsmekanism i vissa 3D -optiska datalagringssystem och har hjälpt till att bestämma Magdalen -papyrusens ålder .
Ljudkonservering
De IRENE Systemet använder sig av konfokalmikroskopi för optisk scanning och återvinning av skadade historiska ljud.
Varianter och förbättringar
Förbättra axiell upplösning
Punktspridningsfunktionen för pinhålet är en ellipsoid, flera gånger så lång som den är bred. Detta begränsar mikroskopets axiella upplösning. En teknik för att övervinna detta är 4Pi -mikroskopi där infallande och eller utsänt ljus får störa både ovanför och under provet för att minska ellipsoidens volym. En alternativ teknik är konfokal theta -mikroskopi . I denna teknik är konen för belysande ljus och detekterat ljus i en vinkel mot varandra (bästa resultat när de är vinkelräta). Skärningspunkten mellan tvåpunktsspridningsfunktionerna ger en mycket mindre effektiv provvolym. Från detta utvecklades enkla plan belysningsmikroskop . Dessutom kan deconvolution användas med hjälp av en experimentellt härledd punktspridningsfunktion för att avlägsna ljuset från fokus, vilket förbättrar kontrasten i både axiella och laterala plan.
Super upplösning
Det finns konfokala varianter som uppnår upplösning under diffraktionsgränsen, såsom stimulerad utsläppsminskningsmikroskopi (STED). Förutom denna teknik finns en mängd andra (inte konfokalbaserade) superupplösningstekniker tillgängliga som PALM, (d) STORM, SIM, och så vidare. De har alla sina egna fördelar som användarvänlighet, upplösning och behovet av specialutrustning, buffertar eller fluoroforer.
Lågtemperaturdrift
För bildprover vid låga temperaturer har två huvudsakliga tillvägagångssätt använts, båda baserade på laserskannande konfokalmikroskopi -arkitektur . Ett tillvägagångssätt är att använda en kryostat med kontinuerligt flöde : endast provet har låg temperatur och det adresseras optiskt genom ett transparent fönster. Ett annat möjligt tillvägagångssätt är att ha en del av optiken (särskilt mikroskopobjektivet) i en kryogen lagringsdewar . Detta andra tillvägagångssätt, även om det är mer besvärligt, garanterar bättre mekanisk stabilitet och undviker förluster på grund av fönstret.
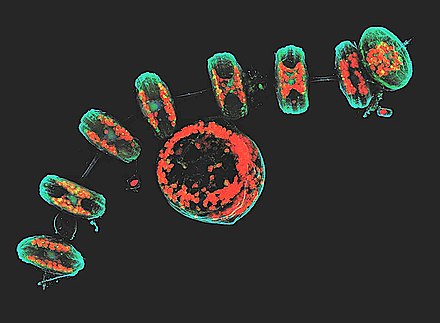
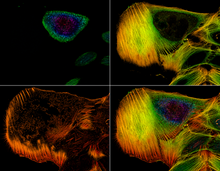
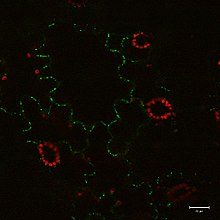
Bilder
β-tubulin i Tetrahymena (en cilierad protozo ).
Färgkodad bild av aktinfilament i en cancercell .
Grön signal från anti- tubulin -antikropp konjugerad med Alexa Fluor 488) och kärnor (blå signal från DNA färgades med DAPI) i root meristem celler fyra dagar gamla Arabidopsis thaliana (Col-0). Skalstapel: 5 um.
Historia
Början: 1940–1957
År 1940 utvecklade Hans Goldmann, ögonläkare i Bern , Schweiz, ett slitslampesystem för att dokumentera ögonundersökningar. Detta system anses av några senare författare som det första konfokala optiska systemet.
1943 publicerade Zyun Koana ett konfokalt system. En figur i denna publikation visar en konfokal överföringsstrålebana.
År 1951 beskrev Hiroto Naora, en kollega till Koana, ett konfokalt mikroskop i tidskriften Science for spectrofotometry .
Det första konfokala skanningsmikroskopet byggdes av Marvin Minsky 1955 och ett patent inlämnades 1957. Skanning av belysningspunkten i fokusplanet uppnåddes genom att flytta scenen. Ingen vetenskaplig publikation lämnades in och inga bilder gjorda med den bevarades.
Tandem-skanning-mikroskop
På 1960-talet utvecklade tjeckoslovakien Mojmír Petráň från den medicinska fakulteten vid Charles University i Plzeň Tandem-Scanning-Microscope, det första kommersialiserade konfokalmikroskopet. Den såldes av ett litet företag i Tjeckoslovakien och i USA av Tracor-Northern (senare Noran) och använde en roterande Nipkow-skiva för att generera multipla excitations- och utsläppshål.
Det tjeckoslovakiska patentet inlämnades 1966 av Petráň och Milan Hadravský, en tjeckoslovakisk arbetskamrat. En första vetenskaplig publikation med data och bilder som genererats med detta mikroskop publicerades i tidskriften Science 1967, författad av M. David Egger från Yale University och Petráň. Som en fotnot till detta dokument nämns det att Petráň designade mikroskopet och övervakade dess konstruktion och att han delvis var en "forskningsassistent" på Yale. En andra publikation från 1968 beskrev teorin och de tekniska detaljerna för instrumentet och hade Hadravský och Robert Galambos , chef för gruppen på Yale, som ytterligare författare. År 1970 beviljades det amerikanska patentet. Den lämnades in 1967.
1969: Det första konfokala laserskanningsmikroskopet
1969 och 1971, M. David Egger och Paul Davidovits från Yale University , publicerat två dokument som beskriver den första konfokala laserskanning mikroskop. Det var en punktskanner, vilket betyder att bara en belysningspunkt genererades. Den använde epi-Illumination-reflektion mikroskopi för observation av nervvävnad. En 5 mW Helium-Neon-Laser med 633 nm ljus reflekterades av en halvtransparent spegel mot målet. Målet var ett enkelt objektiv med en brännvidd på 8,5 mm. I motsats till alla tidigare och mest senare system skannades provet med rörelse av denna lins (objektiv skanning), vilket ledde till en rörelse av brännpunkten. Reflekterat ljus kom tillbaka till den halvtransparenta spegeln, den överförda delen fokuserades av en annan lins på detekteringshålet bakom vilket ett fotomultiplikatorrör placerades. Signalen visualiserades av en CRT från ett oscilloskop, katodstrålen flyttades samtidigt med målet. En speciell enhet tillät att göra Polaroid -foton , varav tre visades i publikationen 1971.
Författarna spekulerar om fluorescerande färgämnen för in vivo -undersökningar. De citerar Minskys patent, tack Steve Baer, vid den tiden doktorand vid Albert Einstein School of Medicine i New York City där han utvecklade ett konfokalt linjescanningmikroskop för att ha föreslagit att använda en laser med 'Minskys mikroskop' och tacka Galambos, Hadravsky och Petráň för diskussioner som leder till utvecklingen av deras mikroskop. Motiveringen för deras utveckling var att i Tandem-Scanning-Microscope endast en bråkdel av 10 −7 av belysningsljuset deltar i att generera bilden i ögonstycket. Således var bildkvaliteten inte tillräcklig för de flesta biologiska undersökningar.
1977–1985: Punktskannrar med lasrar och scenscanning
1977 publicerade Colin JR Sheppard och Amarjyoti Choudhury , Oxford , Storbritannien, en teoretisk analys av konfokala och laserskannande mikroskop. Det är förmodligen den första publikationen som använder termen "konfokalt mikroskop".
1978 publicerade bröderna Christoph Cremer och Thomas Cremer en design för ett konfokalt laserskannande mikroskop med fluorescerande excitation med elektronisk autofokus. De föreslog också en laserpunktsbelysning med hjälp av ett "4π-punkt- hologram ". Denna CLSM -design kombinerade laserscanningsmetoden med 3D -detektering av biologiska objekt märkta med fluorescerande markörer för första gången.
1978 och 1980 beskrev Oxford-gruppen kring Colin Sheppard och Tony Wilson ett konfokalt mikroskop med epi-laserbelysning, scenskanning och fotomultiplikatorrör som detektorer. Scenen kan röra sig längs den optiska axeln (z-axeln), vilket möjliggör optiska seriella sektioner.
År 1979 visade Fred Brakenhoff och medarbetare att de teoretiska fördelarna med optisk sektionering och upplösningsförbättring verkligen kan uppnås i praktiken. 1985 blev denna grupp den första att publicera övertygande bilder tagna i ett konfokalt mikroskop som kunde svara på biologiska frågor. Strax efter började många fler grupper använda konfokal mikroskopi för att svara på vetenskapliga frågor som fram till dess hade förblivit ett mysterium på grund av tekniska begränsningar.
År 1983 publicerade IJ Cox och C. Sheppard från Oxford det första verket där ett konfokalt mikroskop styrdes av en dator. Det första kommersiella laserskanningsmikroskopet, scenskannern SOM-25 erbjöds av Oxford Optoelectronics (efter flera övertaganden som förvärvats av BioRad) från och med 1982. Det baserades på Oxford-gruppens design.
Från och med 1985: Laserpunktskannrar med strålskanning
I mitten av 1980-talet byggde William Bradshaw Amos och John Graham White och kollegor som arbetade på Laboratory of Molecular Biology i Cambridge det första konfokala strålskanningsmikroskopet. Scenen med provet rörde sig inte, istället var belysningsplatsen, vilket möjliggjorde snabbare bildförvärv: fyra bilder per sekund med 512 rader vardera. Enormt förstorade mellanbilder, på grund av en 1-2 meter lång strålebana, tillät användning av ett konventionellt irismembran som ett 'pinhole', med diametrar ~ 1 mm. De första mikrograferna togs med långvarig exponering på film innan en digitalkamera tillsattes. En ytterligare förbättring gjorde det möjligt att zooma in i preparatet för första gången. Zeiss , Leitz och Cambridge Instruments hade inget intresse av en kommersiell produktion. Den medicinska forskningsråd (MRC) slutligen sponsrad utveckling av en prototyp. Designen förvärvades av Bio-Rad , ändrades med datorkontroll och kommersialiserades som 'MRC 500'. Efterföljaren MRC 600 var senare grunden för utvecklingen av det första tvåfotonfluorescerande mikroskopet som utvecklades 1990 vid Cornell University .
Utvecklingen vid KTH Kungliga Tekniska Högskolan i Stockholm ledde ungefär samtidigt till en kommersiell CLSM som distribuerades av det svenska företaget Sarastro. Satsningen förvärvades 1990 av Molecular Dynamics, men CLSM avbröts så småningom. I Tyskland utvecklade Heidelberg Instruments , grundat 1984, en CLSM, som ursprungligen var avsedd för industriella tillämpningar snarare än biologi. Detta instrument togs över 1990 av Leica Lasertechnik . Zeiss hade redan ett icke-konfokalt laser-scanningmikroskop för flygande fläckar på marknaden som uppgraderades till ett konfokalt. En rapport från 1990 nämnde några tillverkare av konfokaler: Sarastro, Technical Instrument, Meridian Instruments, Bio-Rad, Leica, Tracor-Northern och Zeiss.
I 1989, Fritz Karl Preikschat , med sonen Ekhard Preikschat, uppfann avsökande laserdiodmikroskop för partikelstorleksanalys. Han och Ekhard Preikschat grundade Lasentec för att kommersialisera det. År 2001 förvärvades Lasentec av Mettler Toledo . De används mest inom läkemedelsindustrin för att tillhandahålla in-situ-kontroll av kristallisationsprocessen i stora reningssystem.
Se även
- Laddningsmodulationsspektroskopi
- Dekonvolution
- Fluorescensmikroskop
- Fokuserad jonstråle
- Fokusering
- Laserskanning konfokalmikroskopi
- Levande cellavbildning
- Objektiv för mikroskop
- Mikroskopglas
- Optiskt mikroskop
- Optisk snittning
- Fotodetektor
- Punktspridningsfunktion
- Stimulerat utsläppsminskningsmikroskop
- Superupplöst mikroskopi
- Total intern reflektion fluorescensmikroskop (TIRF)
- Två-foton excitationsmikroskopi : Även om de använder en relaterad teknik (båda är laserskannande mikroskop), är multiphotonfluorescensmikroskop inte strikt konfokala mikroskop. Termen konfokal uppstår från närvaron av ett membran i det konjugerade fokalplanet (konfokalt). Detta membran saknas vanligtvis i multiphotonmikroskop.
Referenser
- Hoffman, David P .; Shtengel, Gleb; Xu, C. Shan; Campbell, Kirby R .; Freeman, Melanie; Wang, Lei; Milkie, Daniel E .; Pasolli, H. Amalia; Iyer, Nirmala; Bogovic, John A .; Stabley, Daniel R .; Shirinifard, Abbas; Pang, sång; Peale, David; Schaefer, Kathy; Pomp, Wim; Chang, Chi-Lun; Lippincott-Schwartz, Jennifer; Kirchhausen, Tom; Solecki, David J .; Betzig, Eric; Hess, Harald F. (2020). "Korrelativ tredimensionell superupplösning och block-face elektronmikroskopi av hela glasögonfrusna celler" . Vetenskap . 367 (6475): eaaz5357. doi : 10.1126/science.aaz5357 . ISSN 0036-8075 . PMC 7339343 . PMID 31949053 .
externa länkar
|
Bibliotekets resurser om konfokal mikroskopi |
- Virtuellt CLSM (Java-baserat)
- Animationer och förklaringar om olika typer av mikroskop inklusive fluorescerande och konfokala mikroskop (Université Paris Sud)