Två -foton excitationsmikroskopi - Two-photon excitation microscopy
Två-foton excitationsmikroskopi ( TPEF eller 2PEF ) är en fluorescensavbildningsteknik som tillåter avbildning av levande vävnad upp till cirka en millimeter i tjocklek. Till skillnad från traditionell fluorescensmikroskopi , där excitationsvåglängden är kortare än emissionsvåglängden, kräver två-foton-excitation samtidigt excitation av två fotoner med längre våglängd än det utsända ljuset. Två-foton excitationsmikroskopi använder vanligtvis nära-infrarött (NIR) excitationsljus som också kan excitera fluorescerande färgämnen . För varje excitation absorberas emellertid två fotoner av NIR -ljus. Användning av infrarött ljus minimerar spridning i vävnaden. På grund av multiphotonabsorptionen undertrycks bakgrundssignalen starkt. Båda effekterna leder till ett ökat penetrationsdjup för denna teknik. Tvåfoton excitation kan vara ett överlägset alternativ till konfokalmikroskopi på grund av dess djupare vävnadspenetrering, effektiva ljusdetektering och minskad fotoblekning .

Begrepp

Tvåfotonexcitering sysselsätter tvåfotonsabsorption , ett begrepp som först beskrivits av Maria Goeppert-Mayer (1906-1972) i sin doktorsavhandling i 1931, och först observerades i 1961 i en CaF 2 : Eu 2+ kristall med användning av laserexcitering av Wolfgang Kaiser . Isaac Abella visade 1962 i cesiumånga att tvåfoton excitation av enstaka atomer är möjlig.
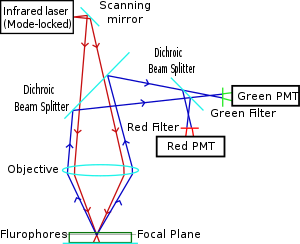
Två-foton excitationsfluorescensmikroskopi har likheter med andra konfokala lasermikroskopitekniker såsom laserskanning konfokalmikroskopi och Raman-mikroskopi . Dessa tekniker använder fokuserade laserstrålar som skannas i ett rastermönster för att generera bilder, och båda har en optisk snittningseffekt . Till skillnad från konfokalmikroskop innehåller multiphotonmikroskop inte hålöppningar som ger konfokala mikroskop deras optiska snittkvalitet. Den optiska sektione produceras av multifotonmikroskop är ett resultat av punktspridningsfunktionen hos excitationen: den multipunktspridningsfunktionen är typiskt hantelformad (längre i xy-planet), jämfört med den upprättstående rugby-boll formad punktspridningsfunktion av konfokal mikroskop. Konceptet med två-foton-excitation är baserat på tanken att två fotoner, med jämförbart lägre fotonergi än vad som behövs för en foton-excitation, också kan excitera en fluorofor i en kvanthändelse. Varje foton bär ungefär hälften av den energi som behövs för att excitera molekylen. Excitation resulterar i den efterföljande emissionen av en fluorescensfoton med samma kvantutbyte som skulle resultera från konventionell enkel-fotonabsorption. Den utsända fotonen har vanligtvis en högre energi (kortare våglängd) än någon av de två spännande fotonerna. Sannolikheten för nästan samtidig absorption av två fotoner är extremt låg. Därför krävs vanligtvis ett högt flöde av excitationsfoton, vanligtvis genererat av femtosekundpulserad laser . Syftet med att använda tvåfotoneffekten är att punktspridningsfunktionens axiella spridning är väsentligt lägre än för enkel-foton-excitation. Som ett resultat förbättras omfattningen längs z -dimensionen, vilket gör att tunna optiska sektioner kan skäras. Dessutom kan fläckens form och storlek i många intressanta fall utformas för att uppnå specifika önskade mål. De längre våglängder, lägre energi (vanligtvis infraröda) excitationslasrar i multiphotonmikroskop är väl lämpade att använda vid avbildning av levande celler eftersom de orsakar mindre skada än kortvågslasrarna som vanligtvis används för enfoton excitation, så celler kan observeras för längre perioder med färre toxiska effekter.
De vanligaste fluoroforerna har excitationsspektra i intervallet 400–500 nm, medan lasern som används för att excitera tvåfotonfluorescensen ligger i området ~ 700–1000 nm (infrarött) som produceras av ti-safirlasrar . Om fluoroforen absorberar två infraröda fotoner samtidigt kommer den att absorbera tillräckligt med energi för att lyftas till det exciterade tillståndet. Fluoroforen avger sedan en enda foton med en våglängd som beror på vilken typ av fluorofor som används (vanligtvis i det synliga spektrumet). Eftersom två fotoner absorberas under excitationen av fluoroforen, ökar sannolikheten för fluorescerande emission från fluoroforerna kvadratiskt med excitationsintensiteten. Därför genereras mycket mer tvåfotonfluorescens där laserstrålen är tätt fokuserad än där den är mer diffus. Effektivt är excitation begränsad till den lilla fokalvolymen (~ 1 femtoliter), vilket resulterar i en hög grad av avvisning av objekt som inte är i fokus. Denna lokalisering av excitation är den viktigaste fördelen jämfört med excitationsmikroskop med en-foton , som måste använda element som tapphål för att avvisa fluorescens som inte är i fokus. Fluorescensen från provet samlas sedan upp av en högkänslig detektor, såsom ett fotomultiplikatorrör . Denna observerade ljusintensitet blir en pixel i den slutliga bilden; brännpunkten skannas genom ett önskat område av provet för att bilda alla bildpunkter i bilden.
Utveckling
Tvåfotonmikroskopi var banbrytande och patenterade av Winfried Denk och James Strickler i labbet för Watt W. Webb vid Cornell University 1990. De kombinerade idén om tvåfotonabsorption med användning av en laserskanner. I två-foton excitationsmikroskopi fokuseras en infraröd laserstråle genom en objektivlins. Den Ti-safirlaser som normalt används har en pulsbredd på cirka 100 femtosekunder (fs) och en upprepningshastighet på cirka 80 MHz, vilket möjliggör den höga fotondensiteten och flödet som krävs för absorption av två fotoner och kan ställas in över ett brett spektrum av våglängder. Lägeslåsta Yb-dopade fiberlasrar med 325 fs-pulser har också använts för kollagenavbildning, vilket visar ett penetrationsdjup på över 320 μm i kollagen, vilket är betydligt överlägset djup på 250 till 300 μm som kan uppnås vid koppling till en konventionell Ti- safir excitationslaser.
Användningen av infrarött ljus för att excitera fluoroforer i ljusspridande vävnad har ytterligare fördelar. Längre våglängder sprids i mindre grad än kortare, vilket är en fördel för högupplöst bildbehandling. Dessutom är dessa fotoner med lägre energi mindre benägna att orsaka skador utanför brännvidden. Jämfört med ett konfokalt mikroskop är fotondetektering mycket effektivare eftersom även spridda fotoner bidrar till den användbara signalen. Dessa fördelar för avbildning i spridningsvävnader erkändes bara flera år efter uppfinningen av tvåfoton excitationsmikroskopi.
Det finns flera försiktighetsåtgärder för att använda tvåfotonmikroskopi: De pulserande lasrarna som behövs för tvåfoton excitation är mycket dyrare än de kontinuerliga våg (CW) lasrarna som används i konfokalmikroskopi. Två-fotonabsorptionsspektrumet för en molekyl kan skilja sig avsevärt från dess en-foton-motsvarighet. För mycket tunna föremål som isolerade celler kan enkelfoton (konfokala) mikroskop producera bilder med högre optisk upplösning på grund av deras kortare excitationsvåglängder. I spridningsvävnad å andra sidan resulterar de överlägsna optiska snittnings- och ljusdetekteringsfunktionerna i tvåfotonmikroskopet i bättre prestanda.
Ansökningar
Main
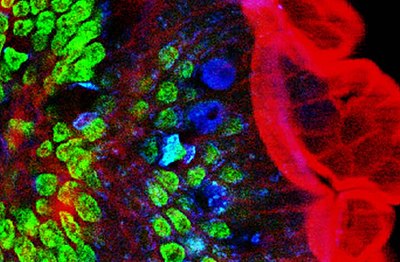
Tvåfotonmikroskopi har varit inblandat i många områden, inklusive: fysiologi, neurobiologi, embryologi och vävnadsteknik. Även tunna, nästan transparenta vävnader (som hudceller) har visualiserats med tydliga detaljer på grund av denna teknik. Tvåfotonmikroskopis höghastighetsavbildningskapacitet kan också användas vid icke-invasiv optisk biopsi. Inom cellbiologi har tvåfotonmikroskopi lämpligt använts för att producera lokaliserade kemiska reaktioner. Med hjälp av tvåfotonfluorescens och andraharmonisk generationsbaserad mikroskopi visades det att organiska porfyrintypmolekyler kan ha olika övergångsdipolmoment för tvåfotonfluorescens och andra harmonisk generation, som annars tros uppstå från samma övergångsdipol ögonblick. Icke-degenerativ tvåfoton-excitation, eller med användning av 2 fotoner med ojämna våglängder, visade sig öka fluorescensen för alla testade små molekyler och fluorescerande proteiner.
Cancerforskning
2PEF har också visat sig vara mycket värdefullt för att karakterisera hudcancer. Det hade också visat sig avslöja tumörcellsstopp, tumörcell-trombocytinteraktion, tumörcell-leukocytinteraktion och metastatiska koloniseringsprocesser.
Neurovetenskap
2PEF och 3PEF används för att karakterisera intakta neurala vävnader.
Hjärna in vivo avbildning
Multiphoton fluorescens (2PEF och 3PEF) är ett användbart medel för att avbilda hjärnan in vivo.
Genom (rakad) skalle avbildning av kapillärer och RBC publiceras på möss, vilket tyder på större djup och hög upplösning från längre bort än mikroskopi applikationer. Detta finns på tidningen, "In vivo Two-Photon Imaging avslöjar akut cerebral vaskulär spasm och mikrotrombos efter lätt traumatisk hjärnskada hos möss"
Excitation av högre ordning
Samtidig absorption av tre eller flera fotoner är också möjlig, vilket möjliggör högre multiphoton -excitationsmikroskopi. Den så kallade "tre fotoner upphetsade fluorecensmikroskopi" (3PEF) är den mest använda tekniken efter 2PEF, till vilken den kompletterar.
Färgämnen och fluorescerande proteiner för tvåfoton excitationsmikroskopi
I allmänhet kan alla vanligt använda fluorescerande proteiner (CFP, GFP, YFP, RFP) och färgämnen exciteras i tvåfoton-läge. Två-foton excitationsspektra är ofta betydligt bredare, vilket gör det svårare att excitera fluoroforer selektivt genom att byta excitationsvåglängder. Det finns flera onlinedatabaser över två-foton spektra, tillgängliga från Cornell University [1] och National Institute of Chemical Physics and Biophysics i Estland.
Flera gröna, röda och NIR-emitterande färgämnen (sonder och reaktiva etiketter) med extremt höga 2-fotonabsorptionstvärsnitt har rapporterats. På grund av donator-acceptor-donator-typ uppvisar squaraine-färgämnen som Seta-670 , Seta-700 och Seta-660 mycket höga 2-fotonabsorption (2PA) effektivitet jämfört med andra färgämnen, SeTau-647 och SeTau-665 , en ny typ av squaraine- rotaxane , uppvisar extremt höga tvärsnitt med två foton på upp till 10 000 GM i den nära IR-regionen, oöverträffad av någon annan klass av organiska färgämnen.
Se även
- 3D optisk datalagring
- Olinjär optik
- Wide-field multiphoton microscopy
- Absorption av två foton
- Tre-foton mikroskopi
- Andra-harmonisk avbildningsmikroskopi
Källor
- Schmitt, Michael; Mayerhöfer, Thomas; Popp, Jürgen; Kleppe, Ingo; Weisshart, Klaus (2013). "Light-Matter Interaction". Handbook of Biophotonics . doi : 10.1002/9783527643981.bphot003 . ISBN 9783527643981.
- König, Karsten (2018). Multiphoton Microscopy and Fluorescence Lifetime Imaging - Applications in Biology and Medicine . De Gruyter. ISBN 978-3-11-042998-5.
- Keikhosravi, Adib; Bredfeldt, Jeremy S .; Sagar, Abdul Kader; Eliceiri, Kevin W. (2014). "Andraharmoniska generationens avbildning av cancer". Kvantitativ bildbehandling i cellbiologi . Metoder i cellbiologi. 123 . s. 531–546. doi : 10.1016/B978-0-12-420138-5.00028-8 . ISBN 9780124201385. PMID 24974046 .
- Hanry Yu; Nur Aida Abdul Rahim (2020). Imaging in Cellular and Tissue Engineering, första upplagan . CRC Taylor & Francis. ISBN 9780367445867.
Referenser
externa länkar
- Två foton lämpliga färgämnen
- introduktion till multiphotonmikroskopi
- Förvärv av flera bilder i realtid för laserskanningsmikroskopi (Sanderson mikroskopi-artikel)
- Bygg ditt eget videofrekvens 2-foton mikroskop
- Två foton fluorescensljusmikroskopi, ENCYCLOPEDIA OF LIFE SCIENCES
- "Multiphoton fluorescensmikroskopi" . Mikroskopiprimer . Florida State University . Hämtad 2018-03-03 .
- Multipel-foton excitation fluorescensmikroskopi. University of Wisconsin.
- Grunder och applikationer i Multiphoton Excitation Microscopy . Nikon mikroskopiU.