Cis - transisomerism - Cis–trans isomerism
Cis - trans isomerism , även känd som geometrisk isomerism eller konfigurationsisomerism, är en term som används inom organisk kemi . Prefixen " cis " och " trans " är från latin: "denna sida av" respektive "den andra sidan av". I kemiska sammanhangindikerar cis att de funktionella grupperna (substituenterna) är på samma sida av något plan, medan trans förmedlar att de är på motsatta sidor. Cis-trans-isomerer är stereoisomerer , det vill säga par av molekyler som har samma formel men vars funktionella grupper är i olika orienteringar i tredimensionellt utrymme. Cis-trans- notation inte alltid motsvarar E - Z- isomerism , vilket är en absolut stereokemisk beskrivning. I allmänhet innehåller stereoisomerer dubbelbindningar som inte roterar, eller de kan innehålla ringstrukturer, där rotationen av bindningar är begränsad eller förhindrad. Cis- och trans -isomerer förekommer både i organiska molekyler och i oorganiska koordinationskomplex. Cis- och trans- deskriptorer används inte för fall av konformationell isomerism där de två geometriska formerna lätt kan omvandlas, till exempel de flesta enkedjade strukturer med öppen kedja; istället används termerna " syn " och " anti ".
Termen "geometrisk isomerism" anses av IUPAC vara en föråldrad synonym för " cis - trans isomerism".
Organisk kemi
När substituentgrupperna är orienterade i samma riktning kallas diastereomeren för cis , medan när substituenterna är orienterade i motsatta riktningar kallas diastereomeren som trans . Ett exempel på en liten kolväte visning cis - trans -isomeri är but-2-en .
Alicykliska föreningar kan också visa cis - trans isomerism. Som ett exempel på en geometrisk isomer på grund av en ringstruktur, överväga 1,2-diklorocyklohexan:
 
|
 
|
| trans -1,2 -diklorocyklohexan | cis -1,2 -diklorocyklohexan |
Jämförelse av fysiska egenskaper
Cis- och transisomerer har ofta olika fysikaliska egenskaper. Skillnader mellan isomerer uppstår i allmänhet från skillnaderna i molekylens form eller det totala dipolmomentet .
 |

|
| cis -2 -penten | trans -2 -penten |
 |

|
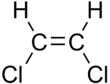
| cis -1,2 -dikloreten | trans -1,2 -dikloreten |
 |

|
|
cis -butendiosyra (maleinsyra) |
trans -butendiosyra (fumarsyra) |
 |

|
| Oljesyra | Elaidinsyra |
Dessa skillnader kan vara mycket små, som i fallet med kokpunkten för rakkedjade alkener, såsom pent-2-en , som är 37 ° C i cis- isomeren och 36 ° C i trans- isomeren. Skillnaderna mellan cis- och transisomerer kan vara större om polära bindningar är närvarande, som i 1,2-dikloretenerna . Den cis -isomeren i detta fall har en kokpunkt av 60,3 ° C, medan den trans- isomeren har en kokpunkt av 47,5 ° C. I cis- isomeren kombineras de två polära C-Cl- bindningsdipolmomenten för att ge en övergripande molekylär dipol, så att det finns intermolekylära dipol-dipolkrafter (eller Keesom-krafter), som ökar spridningskrafterna i London och höjer kokpunkten. I trans- isomeren, å andra sidan, innebär detta inte inträffa eftersom de två C-Cl obligations ögonblick avbryta och molekylen har en nettonoll dipolmoment (det har dock en icke-noll kvadrupol tillfället).
De två isomererna av butendiosyra har så stora skillnader i egenskaper och reaktivitet att de faktiskt fick helt andra namn. De cis -isomer kallas maleinsyra och trans- isomeren fumarsyra . Polaritet är nyckeln till att bestämma den relativa kokpunkten eftersom den orsakar ökade intermolekylära krafter och därigenom höjer kokpunkten. På samma sätt är symmetri avgörande för att bestämma relativ smältpunkt eftersom den möjliggör bättre packning i fast tillstånd, även om den inte förändrar molekylens polaritet. Ett exempel på detta är förhållandet mellan oljesyra och elaidinsyra ; oljesyra, cis -isomeren, har en smältpunkt på 13,4 ° C, vilket gör den till en vätska vid rumstemperatur, medan trans -isomeren, elaidinsyra, har den mycket högre smältpunkten 43 ° C, på grund av att den rakare trans -isomeren är kan packas tätare och är fast vid rumstemperatur.
Sålunda, trans alkener, som är mindre polära och mer symmetrisk, har lägre kokpunkter och högre smältpunkter, och cis alkener, som i allmänhet är mer polär och mindre symmetriska, har högre kokpunkter och lägre smältpunkter.
När det gäller geometriska isomerer som är en följd av dubbelbindningar, och i synnerhet när båda substituenterna är desamma, brukar vissa allmänna trender hålla. Dessa trender kan hänföras till det faktum att dipolerna i substituenterna i en cis -isomer kommer att summeras för att ge en total molekylär dipol. I en trans -isomer kommer dipolerna i substituenterna att avbrytas på grund av att de är på motsatta sidor av molekylen. Trans -isomerer tenderar också att ha lägre densiteter än sina cis -motsvarigheter.
Som en allmän trend, trans alkener tenderar att ha högre smältpunkter och lägre löslighet i inert lösningsmedel, såsom trans- alkener, i allmänhet är mer symmetrisk än cis alkener.
Vicinala kopplingskonstanter ( 3 J HH ), mätt genom NMR-spektroskopi , är större för trans (intervall: 12-18 Hz; typiska: 15 Hz) än för cis (intervall: 0-12 Hz; typiska: 8 Hz) isomerer.
Stabilitet
Vanligtvis för acykliska system är trans -isomerer stabilare än cis -isomerer. Detta beror vanligtvis på den ökade ogynnsamma steriska interaktionen mellan substituenterna i cis -isomeren. Därför har transisomerer en mindre exoterm förbränningsvärme , vilket indikerar högre termokemisk stabilitet. I Benson bildningsvärme grupp additivitet dataset, cis -isomerer drabbas av en 1,10 kcal / mol stabilitet påföljd. Undantag från denna regel finns, såsom 1,2-difluoretylen , 1,2-difluorodiazen (FN = NF) och flera andra halogen- och syre-substituerade etylener. I dessa fall är cis -isomeren stabilare än trans -isomeren. Detta fenomen kallas cis -effekten .
E/Z -notering

Cis-trans notation kan inte användas för alkener med mer än två olika substituenter. Istället används E/Z-notationen baserat på substituenternas prioritet som använder Cahn-Ingold-Prelog-reglerna för absolut konfiguration. LUPAC standardbeteckningar E - Z är entydiga i samtliga fall, och därför är speciellt användbara för tri- och tetrasubstituerade alkener att undvika förvirring om vilka grupper som identifieras som cis- eller trans- förhållande till varandra.
Z (från tyska zusammen ) betyder "tillsammans". E (från tyska entgegen ) betyder "motsatt" i betydelsen "motsatt". Det vill säga, Z har grupper med högre prioritet cis till varandra och E har grupper med högre prioritet trans till varandra. Huruvida en molekylär konfiguration betecknas E eller Z bestäms av Cahn-Ingold-Prelogs prioritetsregler ; högre atomnummer ges högre prioritet. För var och en av de två atomerna i dubbelbindningen är det nödvändigt att bestämma prioriteten för varje substituent. Om båda substituenterna med högre prioritet är på samma sida är arrangemanget Z ; om på motsatta sidor, är arrangemanget E .
Eftersom cis/trans- och E - Z -systemen jämför olika grupper på alken, är det inte helt sant att Z motsvarar cis och E motsvarar trans. Till exempel, trans -2-klorbut-2-en (de två metylgrupper, C1 och C4, på but-2-en ryggrad är träns till varandra) är ( Z ) -2-klorbut-2-en (den klor och C4 är tillsammans eftersom Cl och C4 är motsatta).
Oorganisk kemi
Cis - trans isomeri kan också förekomma i oorganiska föreningar, framför allt i diazenes och koordinationsföreningar .
Diazenes
Diazener (och relaterade difosfener ) kan också uppvisa cis/trans -isomerism. Precis som med organiska föreningar är cis -isomeren i allmänhet den mer reaktiva av de två, eftersom den är den enda isomeren som kan reducera alkener och alkyner till alkaner , men av en annan anledning: trans -isomeren kan inte anpassa sina väten på lämpligt sätt för att reducera alkenen, men cis -isomeren, som formas annorlunda, kan.
 
|
 
|
| trans -diazen | cis -diazen |
Samordningskomplex
I oorganiska koordinationskomplex med oktaedriska eller kvadratiska plana geometrier finns det också cis -isomerer där liknande ligander är närmare varandra och trans -isomerer där de är längre ifrån varandra.
Till exempel finns det två isomerer av kvadratiska plana Pt (NH 3 ) 2 Cl 2 , som förklarades av Alfred Werner 1893. Cis -isomeren, vars fullständiga namn är cis -diamminedichloroplatinum (II), visades 1969 av Barnett Rosenberg för har antitumöraktivitet och är nu ett kemoterapimedicin som är känt under det korta namnet cisplatin . I kontrast, den trans- isomeren ( transplatin ) har ingen användbar aktivitet mot cancer. Varje isomer kan syntetiseras med hjälp av trans -effekten för att kontrollera vilken isomer som produceras.
För oktaedriska komplex med formeln MX 4 Y 2 existerar också två isomerer. (Här är M en metallatom och X och Y är två olika typer av ligander .) I cis -isomeren ligger de två Y -liganderna intill varandra vid 90 °, vilket är sant för de två kloratomerna som visas i grönt i cis - [Co (NH 3 ) 4 Cl 2 ] + , vid vänster. I trans -isomeren som visas till höger, de två Cl-atomer är på motsatta sidor om den centrala Co-atom.
En besläktad typ av isomerism i oktaedriska MX 3 Y 3 -komplex är ansiktsmeridional (eller fac / mer ) isomerism, där olika antal ligander är cis eller trans till varandra. Metallkarbonylföreningar kan karakteriseras som " fac " eller " mer " med användning av infraröd spektroskopi .





