Strukturell isomer - Structural isomer
I kemi är en strukturell isomer (eller konstitutionell isomer i IUPAC- nomenklaturen) av en förening en annan förening vars molekyl har samma antal atomer för varje element, men med logiskt tydliga bindningar mellan dem. Termen metamer användes tidigare för samma koncept.
Till exempel butanol H
3 C - (CH
2 )
3 –OH, metylpropyleter H
3 C - (CH
2 )
2 –O– CH
3 och dietyleter ( H
3 C - CH
2 -) 2 O har samma molekylformel C
4 H
10 O men är tre distinkta strukturisomerer.
Konceptet gäller även polyatomiska joner med samma totala laddning. Ett klassiskt exempel är cyanatjonen O = C = N - och fulminatjonen C - ≡N + O - . Det utvidgas också till jonföreningar så att (till exempel) ammoniumcyanat [ NH
4 ] + [O = C = N] - och karbamid ( H
2 N -) 2 C = O betraktas som strukturella isomerer, och så är metylammoniumformiat [ H
3 C - NH
3 ] + [ HCO
2 ] - och ammoniumacetat [ NH
4 ] + [ H
3 C - CO
2 ] - .
Strukturell isomerism är den mest radikala typen av isomerism . Det motsätter sig stereoisomerism , där atomerna och bindningsschemat är desamma, men endast det relativa rumsliga arrangemanget för atomerna är annorlunda. Exempel på de senare är enantiomererna , vars molekyler är spegelbilder av varandra, och cis- och transversionerna av 2-buten .
Bland de strukturella isomererna kan man urskilja flera klasser inklusive skelettisomerer , positionsisomerer (eller regioisomerer ), funktionella isomerer , tautomerer och strukturella topoisomerer .
Skelettisomerism
En skelettisomer av en förening är en strukturell isomer som skiljer sig från den i atomerna och bindningarna som anses innefatta molekylets "skelett". För organiska föreningar , såsom alkaner , betyder det vanligtvis kolatomerna och bindningarna mellan dem.
Till exempel finns det tre skelettisomerer av pentan : n- pentan (kallas ofta helt enkelt "pentan"), isopentan (2-metylbutan) och neopentan (dimetylpropan).
|
|

|

|
| n - Pentan | Isopentan | Neopentan |
Om skelettet är acykliskt , som i exemplet ovan, kan man använda termen kedjeisomerism .
Positionsisomerism (regioisomerism)
Positionsisomerer (även positionella isomerer eller regioisomerer ) är strukturella isomerer som endast kan betraktas som olika på läget för en funktionell grupp , substituent eller någon annan egenskap i en "överordnad" struktur.
Exempelvis kan utbyte av en av de 12 väteatomerna –H med en hydroxylgrupp –OH på n- pentanföräldermolekylen ge någon av tre olika lägesisomerer:
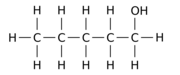
|
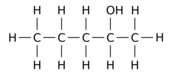
|
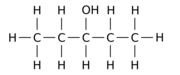
|
| Pentan-1-ol | Pentan-2-ol | Pentan-3-ol |
Funktionell isomerism
Funktionella isomerer är strukturella isomerer som har olika funktionella grupper , vilket resulterar i väsentligt olika kemiska och fysiska egenskaper.
Ett exempel är paret propanal H 3 C-CH 2 -C (= O) -H och aceton H 3 C-C (= O) -CH 3 : den första har en -C (= O) H funktionell grupp, som gör det till en aldehyd , medan den andra har en C – C (= O) –C-grupp, vilket gör den till en keton .
Ett annat exempel är det par etanol H 3 C-CH 2 -OH (en alkohol ) och dimetyleter H 3 C-O-CH 2 H (en eter ). Däremot är 1-propanol och 2-propanol strukturella isomerer, men inte funktionella isomerer, eftersom de har samma signifikanta funktionella grupp ( hydroxyl –OH) och båda är alkoholer.
Förutom den olika kemin har funktionella isomerer vanligtvis mycket olika infraröda spektra . Det infraröda spektrumet bestäms till stor del av molekylens vibrationssätt och funktionella grupper som hydroxyl och estrar har väldigt olika vibrationslägen. Således har 1-propanol och 2-propanol relativt liknande infraröda spektra på grund av hydroxylgruppen, som är ganska olika från metyletyleter.
Strukturella isotopomerer
I kemi ignorerar man vanligtvis skillnader mellan isotoper av samma element. Men i vissa situationer (till exempel i Raman , NMR eller mikrovågsspektroskopi ) kan man behandla olika isotoper av samma element som olika element. I det andra fallet sägs två molekyler med samma antal atomer för varje isotop men distinkta bindningsscheman vara strukturella isotopomerer .
Således, till exempel, skulle eten inte ha några strukturella isomerer under den första tolkningen; men att ersätta två av väteatomerna ( 1 H) med deuteriumatomer ( 2 H) kan ge någon av två strukturella isotopomerer (1,1-dideuteroeten och 1,2-dideuteroeten), om båda kolatomerna är samma isotop. Om dessutom de två kolerna är olika isotoper (säg 12 C och 13 C), skulle det finnas tre distinkta strukturella isotopomerer, eftersom 1- 13 C-1,1-dideuteroeten skulle vara annorlunda än 1- 13 C-2 , Och 2-dideuteroeten.) Och i båda fallen skulle 1,2-dideutero-strukturell isotopomer förekomma som två stereo-isotopoomerer, cis och trans .
Strukturell ekvivalens och symmetri
Strukturell likvärdighet
En säger att två molekyler (inklusive polyatomiska joner) A och B har samma struktur om varje atom av A kan paras ihop med en atom av B av samma element, på ett en-till-sätt, så att för varje bindning i A finns en bindning i B, av samma typ, mellan motsvarande atomer; och vice versa. Detta krav gäller även komplexa bindningar som involverar tre eller flera atomer, såsom avlokaliserad bindning i bensenmolekylen och andra aromatiska föreningar.
Beroende på sammanhanget kan man kräva att varje atom är ihopkopplad med en atom av samma isotop, inte bara av samma element.
Två molekyler kan då sägas vara strukturella isomerer (eller, om isotoper betyder, strukturella isotopomerer) om de har samma molekylformel men inte har samma struktur.
Strukturell symmetri och motsvarande atomer
Struktursymmetri för en molekyl kan definieras matematiskt som en permutation av atomerna som utbyter minst två atomer men inte förändrar molekylens struktur. Två atomer kan sedan sägas vara strukturellt ekvivalenta om det finns en strukturell symmetri som tar varandra till varandra.
Således är till exempel alla fyra väteatomerna av metan strukturellt ekvivalenta, eftersom varje permutation av dem kommer att bevara alla bindningar i molekylen.
På samma sätt alla sex väten av etan ( C
2 H
6 ) är strukturellt ekvivalenta med varandra, liksom de två kolerna; eftersom varje väte kan bytas mot vilket annat som helst, antingen genom en permutation som bara byter de två atomerna, eller genom en permutation som byter de två kolerna och varje väte i en metylgrupp med olika väte på den andra metylen. Endera operationen bevarar molekylens struktur. Så är också fallet för väteatomerna cyklopentan , allen , 2-butyn , hexametylentetramin , prismane , kuban , dodekaeder , etc.
Å andra sidan är inte väteatomerna i propan strukturellt ekvivalenta. De sex väten som är fästa vid det första och tredje kolet är ekvivalenta, som i etan, och de två som är fästa vid det mellersta kolet motsvarar varandra; men det finns ingen ekvivalens mellan dessa två ekvivalensklasser .
Symmetri och positionell isomerism
Strukturella ekvivalenser mellan atomer i en modermolekyl minskar antalet positionella isomerer som kan erhållas genom att ersätta dessa atomer för ett annat element eller grupp. Således kan exempelvis den strukturella ekvivalensen mellan de sex vätena av etan C
2 H
6 betyder att det bara finns en strukturell isomer av etanol CH
5 OH , inte 6. De åtta vätena av propan C
3 H
8 är uppdelade i två strukturella ekvivalensklasser (de sex på metylgrupperna och de två på det centrala kolet); därför finns det bara två lägesisomerer av propanol ( 1-propanol och 2-propanol ). På samma sätt finns det bara två lägesisomerer av butanol och tre av pentanol eller hexanol .
Symmetri bryter genom byten
När en substitution väl gjorts på en modermolekyl minskas dess strukturella symmetri vanligtvis, vilket innebär att atomer som tidigare var ekvivalenta kanske inte längre är så. Sålunda kan substitution av två eller flera ekvivalenta atomer med samma element generera mer än en lägesisomer.
Det klassiska exemplet är derivaten av bensen . Dess sex väten är alla strukturellt ekvivalenta, och det är de sex kolerna också; eftersom strukturen inte ändras om atomerna permuteras på sätt som motsvarar att vända molekylen eller rotera den med multiplar av 60 grader. Därför ger det endast en klorbensen att ersätta vätgas med klor . Men med den ersättningen är atompermutationerna som rörde vätet inte längre giltiga. Endast en permutation återstår, vilket motsvarar att vända molekylen medan klor hålls fast. De fem återstående vätena faller sedan i tre olika ekvivalensklasser: den motsatta kloren är en klass i sig (kallad paraposition ), de två som ligger närmast kloren bildar en annan klass ( orto ) och de återstående två är den tredje klass ( meta ). Sålunda en andra substitution av väte genom klor kan ge tre positionsisomerer: 1,2- eller orto - , 1,3- eller meta - , och 1,4- eller para -diklorbensen .
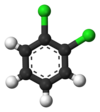
|

|
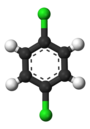
|
| orto- diklorbensen | meta- Diklorbensen | para -Diklorbensen |
| 1,2-diklorbensen | 1,3-diklorbensen | 1,4-diklorbensen |
Av samma anledning finns det bara en fenol (hydroxibensen), men tre bensendioler ; och en toluen (metylbensen), men tre toluoler och tre xylener .
Å andra sidan kan den andra ersättningen (med samma substituent) bevara eller till och med öka symmetrin för molekylen och kan således bevara eller minska antalet ekvivalensklasser för nästa ersättning. Således de fyra återstående väteatomerna i meta -diklorbensen fortfarande delas in i tre klasser, medan de av orto - indelas i två, och de av para - är alla likvärdiga igen. Fortfarande, en del av dessa 3 + 2 + 1 = 6 substitutioner hamna i utbyte ge samma struktur, så det finns endast tre strukturellt distinkta Triklorbensen : 1,2,3- , 1,2,4- , och 1,3,5- .
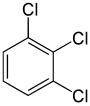
|

|

|
| 1,2,3-triklorbensen | 1,2,4-triklorbensen | 1,3,5-triklorbensen |
Om substituenterna vid varje steg är olika kommer det vanligtvis att finnas fler strukturella isomerer. Xylenol , som är bensen med en hydroxylsubstituent och två metylsubstituenter, har totalt 6 isomerer:
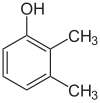
|
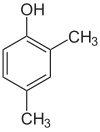
|
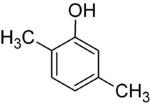
|
| 2,3-Xylenol | 2,4-Xylenol | 2,5-xylenol |

|

|

|
| 2,6-xylenol | 3,4-Xylenol | 3,5-Xylenol |
Isomerräkning och räkning
Att räkna eller räkna strukturella isomerer i allmänhet är ett svårt problem, eftersom man måste ta hänsyn till flera bindningstyper (inklusive avlokaliserade sådana), cykliska strukturer och strukturer som omöjligt kan realiseras på grund av valens eller geometriska begränsningar och oskiljbara tautomerer.
Till exempel, finns det nio strukturella isomerer med molekylformeln C 3 H 6 O med olika bindnings connectivities. Sju av dem är luftstabila vid rumstemperatur, och dessa ges i tabellen nedan.
| Kemisk förening | Molekylär struktur |
Smältande Punkt (° C) |
Kokande Punkt (° C) |
Kommentar |
|---|---|---|---|---|
| Allylalkohol |
|
–129 | 97 | |
| Cyklopropanol |
|
101–102 | ||
| Propionaldehyd |
|
–81 | 48 | Tautomer med prop-1-en-1-ol, som har både cis- och trans- stereoisomera former |
| Aceton |
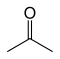
|
–94,9 | 56,53 | Tautomer med propen-2-ol |
| Oxetan |
|
–97 | 48 | |
| Propylenoxid |
|
–112 | 34 | Har två enantiomera former |
| Metylvinyleter |
|
–122 | 6 |
Två strukturella isomerer är de enol tautomerer av karbonylgrupperna isomerer (propionaldehyd och aceton), men dessa är inte stabila.
Se även
Referenser
- ^ "Konstitutionell isomerism" . IUPAC guldbok . IUPAC . Hämtad 19 juli 2018 .
- ^ Frederick A. Bettelheim, William H. Brown, Mary K. Campbell, Shawn O. Farrell (2009): Introduktion till organisk och biokemi . 752 sidor. ISBN 9780495391166
- ^ a b Peter P. Mumba (2018): Useful Principles in Chemistry for Agriculture and Nursing Students , 2nd Edition. 281 sidor. ISBN 9781618965288
- ^ a b William F. Bynum, E. Janet Browne, Roy Porter (2014): Dictionary of the History of Science . 530 sidor. ISBN 9781400853410
- ^ Jim Clark (2000). "Structural isomerism" i Chemguide , nl
- ^ Poppe, Laszlo; Nagy, Jozsef; Hornyanszky, Gabor; Boros, Zoltan; Mihaly, Nogradi (2016). Stereokemi och stereoselektiv syntes: En introduktion . Weinheim, Tyskland: Wiley-VCH. s. 26–27. ISBN 978-3-527-33901-3 .
- ^ D. Brynn Hibbert, AM James (1987): Macmillan Dictionary of Chemistry . 532 sidor. ISBN 9781349188178
- ^ Zdenek Slanina (1986): Samtida teori om kemisk isomerism . 254 sidor. ISBN 9789027717078
- ^ H. Stephen Stoker (2015): Allmän, organisk och biologisk kemi , 7: e upplagan. 1232 sidor. ISBN 9781305686182
- ^ Barry G. Hinwood (1997): En lärobok för vetenskap för hälsoyrken . 489 sidor. ISBN 9780748733774
- ^ Jean-Loup Faulon, Andreas Bender (2010): Handbook of Chemoinformatics Algorithms . 454 sidor. ISBN 9781420082999
- ^ CRC Handbook of Chemistry and Physics 65Th Ed.
