Stereoisomerism - Stereoisomerism
I stereokemin är stereoisomerism eller rumslig isomerism en form av isomerism där molekyler har samma molekylformel och sekvens av bundna atomer (konstitution), men skiljer sig åt i de tredimensionella orienteringarna av deras atomer i rymden. Detta står i kontrast med strukturella isomerer , som delar samma molekylformel, men bindningsförbindelserna eller deras ordning skiljer sig åt. Per definition representerar molekyler som är stereoisomerer av varandra samma strukturella isomer.
Enantiomerer
Enantiomerer , även kända som optiska isomerer , är två stereoisomerer som är relaterade till varandra genom en reflektion: de är spegelbilder av varandra som inte kan överlagras. Mänskliga händer är en makroskopisk analog av detta. Varje stereogen centrum i en har den motsatta konfigurationen i den andra. Två föreningar som är enantiomerer av varandra har samma fysikaliska egenskaper, förutom i vilken riktning de roterar polariserat ljus och hur de interagerar med olika optiska isomerer av andra föreningar. Som ett resultat kan olika enantiomerer av en förening ha väsentligen olika biologiska effekter. Rena enantiomerer uppvisar också fenomenet optisk aktivitet och kan endast separeras med användning av ett kiralt medel. I naturen finns bara en enantiomer av de flesta kirala biologiska föreningar, såsom aminosyror (utom glycin , vilket är achiralt). En optiskt aktiv förening visar två former: D -(+) form och L -( -) form.
Diastereomerer
Diastereomerer är stereoisomerer som inte är relaterade genom en reflektionsoperation. De är inte spegelbilder av varandra. Dessa inkluderar meso föreningar , cis - trans -isomerer , EZ-isomerer , och icke-enantiomera optiska isomerer . Diastereomerer har sällan samma fysiska egenskaper. I exemplet som visas nedan bildar mesoformen av vinsyra ett diastereomert par med både levo- och dextro vinsyra, som bildar ett enantiomeriskt par.

|

|
|
|
(naturlig) vinsyra |
D -(-)-vinsyra |
meso-vinsyra |
|
(1: 1) |
||
Den D - och L - märkning av isomererna ovan är inte den samma som d - och l - märkas med mer vanliga, förklarar varför dessa kan visas omvänd för fackmannen endast den senare namnkonventionen.
Cis -trans och EZ -isomerism
Stereoisomerism om dubbelbindningar uppstår eftersom rotationen kring dubbelbindningen är begränsad, vilket håller substituenterna fasta relativt varandra. Om de två substituenterna på åtminstone en ände av en dubbelbindning är desamma, då finns det ingen stereoisomer och dubbelbindningen inte är ett stereocentrum, t ex propen, CH 3 CH = CH 2 där de två substituenter vid den ena änden är båda H .
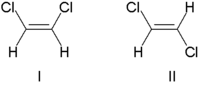
Traditionellt beskrivs dubbelbindningsstereokemi som antingen cis (latin, på denna sida) eller trans (latin, tvärs), med hänvisning till substituenternas relativa position på vardera sidan av en dubbelbindning. De enklaste exemplen på cis - trans- isomeri är de 1,2-disubstituerade etener, i likhet med dikloreten (C 2 H 2 Cl 2 ) isomerer visas nedan.
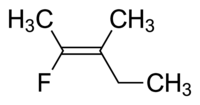
Molekyl I är cis -1,2 -dikloreten och molekyl II är trans -1,2 -dikloreten. På grund av tillfällig oklarhet antog IUPAC ett mer strikt system där substituenterna i varje ände av dubbelbindningen tilldelas prioritet baserat på deras atomnummer . Om substituenterna med hög prioritet är på samma sida av bindningen, tilldelas den Z (Ger. Zusammen , tillsammans). Om de är på motsatta sidor är det E (Ger. Entgegen , motsatt). Eftersom klor har ett större atomnummer än väte är det gruppen med högsta prioritet. Genom att använda denna notation för att namnge ovanstående bildade molekyler, är molekyl I (Z) -1,2-dikloreten och molekyl II (E) -1,2-dikloreten. Det är inte så att Z och cis eller E och trans alltid är utbytbara. Tänk på följande fluormetylpenten:
Det rätta namnet på denna molekyl är antingen trans -2-fluor-3-metylpent-2-en eftersom alkylgrupperna som bildar ryggradskedjan (dvs metyl och etyl) ligger tvärs över dubbelbindningen från varandra, eller (Z) -2-fluor-3-metylpent-2-en eftersom de högst prioriterade grupperna på varje sida av dubbelbindningen är på samma sida av dubbelbindningen. Fluoro är gruppen med högst prioritet på vänster sida av dubbelbindningen, och etyl är gruppen med högst prioritet på molekylens högra sida.
Termerna cis och trans används också för att beskriva den relativa positionen för två substituenter på en ring; cis om på samma sida, annars trans .
Konformatorer
Konformationsisomerism är en form av isomerism som beskriver fenomenet molekyler med samma strukturformel men med olika former på grund av rotationer om en eller flera bindningar. Olika konformationer kan ha olika energier, kan vanligtvis interkonvertera och är mycket sällan isolerbara. Till exempel kan cyklohexan existera i en mängd olika konformationer, inklusive en stolkonformation och en båtkonformation, men för cyklohexan i sig kan dessa aldrig separeras. Båtkonformationen representerar energimaximum på en konformationsresa mellan de två ekvivalenta stolformerna; det representerar dock inte övergångstillståndet för denna process, eftersom det finns lägre energibanor.
Det finns några molekyler som kan isoleras i flera konformationer, på grund av de stora energibarriärerna mellan olika konformationer. 2,2 ', 6,6'-tetrasubstituerade bifenyler kan passa in i den senare kategorin.
Anomerer
Anomerism är en identitet för singelbundna ringstrukturer där "cis" eller "Z" och "trans" eller "E" (geometrisk isomerism) behöver namnge substitutionerna på en kolatom som också visar identiteten för kiralitet; så anomerer har kolatomer som har geometrisk isomerism och optisk isomerism ( Enantiomerism ) på ett eller flera av kolens kol. Anomerer benämns "alfa" eller "axial" och "beta" eller "ekvatorial" vid substitution av en cyklisk ringstruktur som har enstaka bindningar mellan ringens kolatomer, till exempel en hydroxylgrupp, en metylhydroxylgrupp, en metoxigrupp eller en annan pyranos- eller furanosgrupp som är typiska enkelbindningsersättningar men inte begränsade till dessa. Axial geometrisk isomerism kommer att vara vinkelrät (90 grader) mot ett referensplan och ekvatorial kommer att vara 120 grader från den axiella bindningen eller avvika 30 grader från referensplanet.
Atropisomerer
Atropisomerer är stereoisomerer som härrör från hindrad rotation kring enkelbindningar där den steriska stambarriären för rotation är tillräckligt hög för att möjliggöra isolering av konformema.
Fler definitioner
- En konfigurationsstereoisomer är en stereoisomer av en referensmolekyl som har motsatt konfiguration vid ett stereocenter (t.ex. R- vs S- eller E- vs Z- ). Detta innebär att konfigurationsisomerer endast kan interkonverteras genom att bryta kovalenta bindningar till stereocentret, till exempel genom att invertera konfigurationerna för några eller alla stereocentrerna i en förening.
- En epimer är en diastereoisomer som har motsatt konfiguration vid endast en av stereocentrerna.
Le Bel-van't Hoff-regeln
Le Bel-van't Hoff-regeln säger att för en struktur med n asymmetriska kolatomer finns det högst 2 n olika stereoisomerer. Som ett exempel, D är -glukos en aldohexos och har formeln C 6 H 12 O 6 . Fyra av dess sex kolatomer är stereogena, vilket betyder att D -glukos är en av 2 4 = 16 möjliga stereoisomerer.