Cyklohexankonformation - Cyclohexane conformation
I organisk kemi , cyklohexan konformationer är någon av flera tredimensionella former som antagits av molekyler av cyklohexan . Eftersom många föreningar har strukturellt likadana sexledade ringar är cyklohexans struktur och dynamik viktiga prototyper för ett brett spektrum av föreningar.
De inre vinklarna i en vanlig , platt sexkant är 120 °, medan den föredragna vinkeln mellan på varandra följande bindningar i en kolkedja är cirka 109,5 °, den tetraedriska vinkeln ( bågkosinus på -1/3). Därför tenderar cyklohexanringen att anta icke-plana (snedställda) konformationer , som har alla vinklar närmare 109,5 ° och därför en lägre töjningsenergi än den platta sexkantiga formen.
Om vi håller kolatomerna 1, 2 och 3 stationära, med rätt bindningslängder och den tetraedriska vinkeln mellan de två bindningarna, och sedan fortsätta genom att tillsätta kolatomerna 4, 5 och 6 med rätt bindningslängd och den tetraedriska vinkeln, vi kan variera de tre tvåvägsvinklarna för sekvenserna (2,3,4), (3,4,5) och (4,5,6). Nästa bindning, från atom 6, ger också en dihedral vinkel, så vi har fyra frihetsgrader . Men den sista bindningen måste sluta vid positionen för atom 1, som inför tre villkor i ett tredimensionellt utrymme. Detta innebär att det finns en grad av konformationsfrihet, förutsatt att alla bindningslängderna är lika och alla vinklarna mellan bindningarna är lika. Det visar sig att det finns två uppsättningar lösningar på detta geometriska problem. En uppsättning består av de två stolkonfigurationer (en i vilken kedjan av atomer 1, 2, 3 och 4 har en positiv tvåplansvinkel, och ett i vilket den är negativ). Den andra uppsättningen är ett kontinuum, en topologisk cirkel där vinkeln stam är noll, inklusive twist båten och båten konformationer. Alla konformationer på detta kontinuum har en tvåfaldig symmetriaxel som löper genom ringen, medan stolkonformationerna inte har det (de har D 3d- symmetri, med en trefaldig axel som går genom ringen). I denna cirkel varierar energin på grund av Pitzer-belastning relaterad till de tvåvinklade vinklarna. Vridbåten har lägre energi än båten. För att gå från stolen konforma till en twist-båt konforma eller annan stol konforma har obligationsvinklar ändras, vilket leder till en hög energi halv stol konformation. Så de relativa stabiliteterna är: stol> vridbåt> båt> halvstol. Alla relativa konformationsenergier visas nedan. Vid rumstemperatur kan molekylen lätt röra sig mellan dessa konformationer, men endast stol och vridbåt kan isoleras i ren form, eftersom de andra inte är på lokala energiminima.
Båtens och vridbåtens konformationer ligger som sagt längs ett kontinuum med nollvinkelspänning. Om det finns substituenter som gör det möjligt att särskilja de olika kolatomerna, är detta kontinuitet som en cirkel med sex båtkonformationer och sex vridbåtkonformationer mellan sig, tre "högerhänta" och tre "vänsterhänta". (Vilket bör kallas högerhänt är obetydligt.) Men om kolatomerna inte kan urskiljas, som i själva cyklohexanen, tar rörelsen längs kontinuiteten molekylen från båtformen till en "högerhänt" vridbåt och sedan tillbaka till samma båtform (med en permutation av kolatomerna), sedan till en "vänsterhänt" vridbåt och sedan tillbaka till achiralbåten.
Huvudkonformer
De olika konformationerna kallas "konformatorer", en blandning av orden "konformation" och "isomer".
Stolkonformation
Stolkonformationen är den mest stabila konformationen. Vid 25 ° C antar 99,99% av alla molekyler i en cyklohexanlösning denna konformation.
Den symmetri är D 3d . Alla kolcentra är likvärdiga. Sex vätecentra är redo i axiella lägen, ungefär parallellt med C- 3 -axeln, och sex väteatomer är belägna nära ekvatorn. Dessa H-atomer kallas axiella respektive ekvatoriella.
Varje kol har ett "upp" och ett "ner" väte. CH-bindningarna i på varandra följande kolfördelningar är således förskjutna så att det blir liten torsionsspänning . Stolgeometrin bevaras ofta när väteatomerna ersätts med halogener eller andra enkla grupper .
Om vi tänker på en kolatom som en punkt med fyra halvbindningar som sticker ut mot topparna på en tetraeder , kan vi föreställa oss att de står på en yta med en halvbindning som pekar rakt uppåt. Med tanke från höger ovan verkar de andra tre gå utåt mot topparna i en liksidig triangel , så bindningarna verkar ha en vinkel på 120 ° mellan sig. Tänk nu på sex sådana atomer som står på ytan så att deras icke-vertikala halvbindningar möts upp och bildar en perfekt sexkant. Om vi sedan reflekterar tre av atomerna under ytan har vi något som liknar stolkonformationscyklohexan. I den här modellen är de sex vertikala halvbindningarna exakt vertikala och ändarna på de sex icke-vertikala halvbindningarna som sticker ut från ringen exakt på ekvatorn (det vill säga på ytan). Eftersom CH-bindningar faktiskt är längre än en halv CC-bindning kommer de "ekvatoriella" väteatomerna i stolcyklohexan faktiskt att ligga under ekvatorn när de är fästa vid ett kol som ligger ovanför ekvatorn, och vice versa. Detta gäller också andra substituenter. Den tvåkantiga vinkeln för en serie av fyra kolatomer som går runt ringen i den här modellen växlar mellan exakt + 60 ° och −60 ° (kallad gauche ).
Stolkonformationen kan inte deformeras utan att ändra vinklarna eller längden. Vi kan tänka på det som två kedjor, spegelbilder varandra, innehållande atomerna 1-2-3-4 och 1-6-5-4, med motsatta tvåvinklade vinklar. Avståndet från atom 1 till atom 4 beror på det absoluta värdet av den tvåvägsvinkeln. Om dessa två tvåvinklade vinklar ändras (fortfarande ligger mittemot varandra) är det inte möjligt att bibehålla rätt bindningsvinkel vid både kol 1 och kol 4.
Båt- och vridbåtkonformationer
Båtkonformationerna har högre energi än stolkonformationerna. Interaktionen mellan de två flaggstångsvätena genererar i synnerhet sterisk stam . Vridstam finns också mellan C2 – C3 och C5 – C6-bindningarna (kolnummer 1 är en av de två i ett spegelplan), som är förmörkade - det vill säga dessa två bindningar är parallella med varandra över ett spegelplan. På grund av denna belastning är båtkonfigurationen instabil (dvs är inte ett lokalt energiminimalt).
Den molekylära symmetrin är C 2v .
Båtkonformationerna förvrängs spontant till twist-boat-konformationer. Här symmetrin är D 2 , en rent roterande punktgrupp med tre tvåfaldiga axlarna. Denna konformation kan härledas från båtkonformationen genom att applicera en liten vridning på molekylen för att avlägsna förmörkelse av två par metylengrupper. Vridbåtens konformation är kiral och finns i högerhänta och vänsterhänta versioner.
Koncentrationen av vridbåtens konformation vid rumstemperatur är mindre än 0,1%, men vid 1073 kelvin kan den nå 30%. Snabb kylning av ett prov av cyklohexan från 1073 K till 40 K kommer att frysa i en stor koncentration av vridbåtskonformation, som sedan långsamt omvandlas till stolkonformationen vid upphettning.
Dynamik
Stol-stol
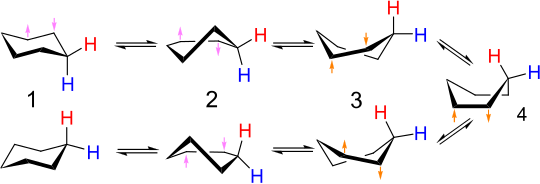
Interkonversionen av stolkonformare kallas ringvippning eller vändning av stol . Kolvätebindningar som är axiella i en konfiguration blir ekvatoriella i den andra och vice versa. Vid rumstemperatur de två stolkonformationer snabbt i jämvikt . Den proton-NMR-spektrum av cyklohexan är en singlett vid rumstemperatur.
I en stolform är den tvåkantiga vinkeln för kedjan av kolatomerna 1-2-3-4 positiv medan kedjan 1-6-5-4 är negativ, men i den andra stolformen är situationen motsatt . Så båda dessa kedjor måste genomgå en vändning av tvåvägsvinkeln. När en av dessa två fyra-atomkedjor plattas till en tvåplansvinkel av noll, har vi halv-stolkonformation, vid en energi maximum längs omvandlingsvägen. När den kedjans tvåvinklade vinkel blir lika (i tecken såväl som storlek) som den andra kedjan med fyra atomer, har molekylen nått kontinuiteten av konformationer, inklusive vridbåten och båten, där bindningsvinklarna och längder kan alla ha sina normala värden och energin är därför relativt låg. Därefter måste den andra fyrkolkedjan byta tecknet på sin tvåvägsvinkel för att uppnå målstolens form, så igen måste molekylen passera halvstolen när den kedjevinkeln för denna kedja går igenom noll. Att byta tecken på de två kedjorna sekventiellt på detta sätt minimerar det maximala energitillståndet längs vägen (vid halvstolstillståndet) - att ha tvåvinkelkedjornas tvåvägs-vinklar samtidigt skulle innebära att man går igenom en konformation av jämn högre energi på grund av vinkeltöjning vid kol 1 och 4.
Den detaljerade mekanismen för interkonvertering mellan stol och stol har varit föremål för mycket studier och debatter. Halvstolstillståndet ( D , i figuren nedan) är det centrala övergångstillståndet i omvandlingen mellan stolen och vridbåtens konformationer. Halvstolen har C 2- symmetri. Interkonversionen mellan de två stolkonformationerna involverar följande sekvens: stol → halvstol → vridbåt → halvstol '→ stol'.
Twist-boat - twist-boat
Båtkonformationen ( C , nedan) är ett övergångstillstånd som möjliggör omvandlingen mellan två olika vridbåtkonformationer. Även om båtkonformationen inte är nödvändig för interkonvertering mellan de två stolkonformationerna av cyklohexan, ingår den ofta i reaktionskoordinatdiagrammet som används för att beskriva denna omvandling eftersom dess energi är betydligt lägre än halvstolens, så varje molekyl med tillräckligt energi att gå från vridbåt till stol har också tillräckligt med energi för att gå från vridbåt till båt. Således finns det flera vägar genom vilka en molekyl cyklohexan i vridbåtens konformation kan uppnå stolkonformationen igen.
Substituerade derivat
I cyklohexan har de två stolkonformationerna samma energi. Situationen blir mer komplex med substituerade derivat. I metylcyklohexan är de två stolkonformerna inte isoenergiska. Metylgruppen föredrar ekvatorial orientering. En substituents preferens gentemot ekvatorialkonformationen mäts i termer av dess A-värde , vilket är Gibbs fria energidifferens mellan de två stolkonformationerna. Ett positivt A-värde indikerar preferens gentemot ekvatorialposition. Storleken på A-värdena sträcker sig från nästan noll för mycket små substituenter såsom deuterium , till cirka 5 kcal / mol (21 kJ / mol) för mycket skrymmande substituenter såsom tert- butylgruppen .
Disubstituerade cyklohexaner
För 1,2- och 1,4-disubstituerade cyklohexaner leder en cis- konfiguration till en axiell och en ekvatorial grupp. Sådana arter genomgår en snabb, degenererad stolsvängning. För 1,2- och 1,4-disubstituerad cyklohexan, en transkonfiguration , förhindras den diaxiella konformationen effektivt av dess höga steriska stam. För 1,3-disubstituerade cyklohexaner är cis- formen diekvatoriell och den vända konformationen lider ytterligare sterisk interaktion mellan de två axiella grupperna. trans -1,3-disubstituerade cyklohexaner är som cis -1,2- och cis -1,4- och kan vända mellan de två ekvivalenta axiella / ekvatoriella formerna.
Cis -1,4-di- tert- butylcyklohexan har en axiell tert- butylgrupp i stolkonformationen och omvandling till twist-boat-konformationen placerar båda grupperna i mer gynnsamma ekvatoriella positioner. Som ett resultat är vridbåtens konformation mer stabil med 0,47 kJ / mol (0,11 kcal / mol) vid 125 K mätt med NMR-spektroskopi .
Heterocykliska analoger
Heterocykliska analoger av cyklohexan är genomgripande i sockerarter, piperidiner, dioxaner, etc. De existerar i allmänhet de trender som ses för cyklohexan, dvs att stolkonformen är mest stabil. De axiella-ekvatoriella jämvikterna (A-värden) påverkas dock starkt av utbytet av en metylen med O eller NH. Illustrerande är glukosidernas konformationer . 1,2,4,5-Tetrathian ((SCH 2 ) 3 ) saknar ogynnsamma 1,3-diaxiella interaktioner av cyklohexan. Följaktligen är dess vridbåtkonformation befolkad; i motsvarande tetrametylstruktur, 3,3,6,6-tetrametyl-1,2,4,5-tetrathian, dominerar vridbåtens konformation.
Historisk bakgrund
År 1890 publicerade Hermann Sachse , en 28-årig assistent i Berlin, instruktioner för att vika ett papper för att representera två former av cyklohexan som han kallade symmetrisk och osymmetrisk (vad vi nu skulle kalla ordförande och båt ). Han förstod tydligt att dessa former hade två positioner för väteatomerna (återigen för att använda modern terminologi, axiell och ekvatorial ), att två stolar förmodligen skulle konvertera, och till och med hur vissa substituenter skulle gynna en av stolformerna ( Sachse-Mohr-teorin ). Eftersom han uttryckte allt detta på matematiskt språk förstod få tidens kemister hans argument. Han hade flera försök att publicera dessa idéer, men ingen lyckades fånga fantasin hos kemister. Hans död 1893 vid 31 års ålder innebar att hans idéer sjönk i dunkelhet. Det var först 1918 som Ernst Mohr , baserat på diamantens molekylstruktur som nyligen hade lösts med den då mycket nya tekniken för röntgenkristallografi, lyckades argumentera för att Sachses stol var det centrala motivet. Derek Barton och Odd Hassel delade Nobelpriset 1969 för arbete med konformationer av cyklohexan och olika andra molekyler.
Referenser
Vidare läsning
- Colin A. Russell, 1975, "The Origins of Conformational Analysis," i Van 't Hoff-Le Bel Centennial, OB Ramsay, Ed. (ACS Symposium Series 12), Washington, DC: American Chemical Society, s. 159–178.
- William Reusch, 2010, "Ringkonformationer" och "Substituerade cyklohexanföreningar", i Virtual Textbook of Organic Chemistry, East Lansing, MI, USA: Michigan State University, se [2] och [3] , öppnades 20 juni 2015.



