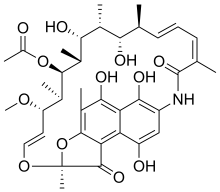
Rifamycin - Rifamycin
 | |
 | |
| Kliniska data | |
|---|---|
| Handelsnamn | Aemcolo |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a619010 |
| Licensdata | |
| Vägar administrering |
Via mun |
| ATC -kod | |
| Rättslig status | |
| Rättslig status | |
| Identifierare | |
| CAS-nummer | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| CHEMBL | |
| Kemiska och fysiska data | |
| Formel | C 37 H 47 N O 12 |
| Molmassa | 697.778 g · mol −1 |
| 3D -modell ( JSmol ) | |
| |
| |
De rifamyciner är en grupp av antibiotika som syntetiseras antingen naturligt av bakterien Amycolatopsis rifamycinica eller artificiellt. De är en underklass av den större familjen ansamyciner . Rifamyciner är särskilt effektiva mot mykobakterier och används därför för att behandla tuberkulos , spetälska och mycobacterium avium complex (MAC) infektioner.
Rifamycingruppen inkluderar de "klassiska" rifamycindrogerna såväl som rifamycinderivaten rifampicin (eller rifampin), rifabutin , rifapentine , rifalazil och rifaximin . Rifamycin, som säljs under handelsnamnet Aemcolo, är godkänt i USA för behandling av resenärers diarré under vissa omständigheter.
Bakterie
Streptomyces mediterranei isolerades första gången 1957 från ett jordprov som samlades in nära stranden vid staden Raphael i södra Frankrike. Namnet gavs ursprungligen av två mikrobiologer som arbetade med det italienska läkemedelsföretaget Group Lepetit SpA i Milano , italienaren Grazia Beretta och Pinhas Margalith i Israel.
1969 döptes bakterien till Nocardia mediterranei när en annan forskare vid namn Thiemann fann att den har en cellvägg som är typisk för Nocardia -arterna. Sedan, 1986, fick bakterien nytt namn till Amycolatopsis mediterranei , som den första arten av ett nytt släkte, eftersom en forskare vid namn Lechevalier upptäckte att cellväggen saknar mykolsyra och inte kan infekteras av Nocardia- och Rhodococcus -fagerna. Baserat på 16S ribosomala RNA -sekvenser, Bala et al. bytte namn på arten 2004 Amycolatopsis rifamycinica .
Första droger
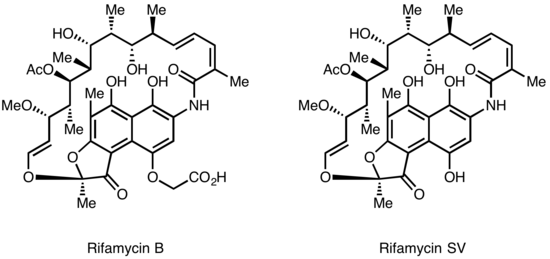
Rifamyciner isolerades först 1957 från en jäsningskultur av Streptomyces mediterranei vid laboratoriet för Gruppo Lepetit SpA i Milano av två forskare vid namn Piero Sensi och Maria Teresa Timbal, som arbetade med den israeliska forskaren Pinhas Margalith. Inledningsvis upptäcktes en familj av närbesläktade antibiotika som kallades Rifamycin A, B, C, D, E. Den enda komponenten i denna blandning som var tillräckligt stabil för att isolera i ren form var Rifamycin B, som tyvärr var dåligt aktiv. Ytterligare studier visade emellertid att medan Rifamycin B i huvudsak var inaktiv, oxiderades det och hydrolyserades spontant i vattenlösningar för att ge det mycket aktiva Rifamycin S. Enkel minskning av Rifamycin S gav hydrokinonformen Rifamycin SV, som blev den första medlemmen i denna klass att gå in i klinisk användning som ett intravenöst antibiotikum. Ytterligare kemisk modifiering av Rifamycin SV gav en förbättrad analog Rifamid, som också infördes i klinisk praxis, men var på samma sätt begränsad till intravenös användning. Efter ett omfattande modifieringsprogram producerades så småningom Rifampin, som är oralt tillgängligt och har blivit en grundpelare i tuberkulosbehandling
Lepetit ansökte om patentskydd för Rifamycin B i Storbritannien i augusti 1958 och i USA i mars 1959. Det brittiska patentet GB921045 beviljades i mars 1963 och det amerikanska patentet 3 150 046 beviljades i september 1964. Läkemedlet anses allmänt ha hjälpte till att erövra frågan om läkemedelsresistent tuberkulos på 1960-talet.
Kliniska tester
Rifamyciner har använts för behandling av många sjukdomar, den viktigaste är HIV-relaterad tuberkulos. En systematisk genomgång av kliniska prövningar av alternativa behandlingar för förebyggande av aktiv tuberkulos hos HIV-negativa personer med latent tuberkulos fann att en veckovis, direkt observerad behandling med rifapentin med isoniazid i tre månader var lika effektiv som en daglig, självadministrerad behandling av isoniazid i nio månader. Men rifapentin-isoniazid-regimen hade högre behandlingstakt och lägre hastighet av hepatotoxicitet . Emellertid var graden av behandlingsbegränsande biverkningar högre vid rifapentin-isoniazid-behandlingen.
Rifamycinerna har en unik verkningsmekanism som selektivt hämmar bakteriellt DNA-beroende RNA-polymeras och uppvisar ingen korsresistens med andra antibiotika vid klinisk användning. Men trots deras aktivitet mot bakterier som är resistenta mot andra antibiotika lider rifamycinerna själva av en ganska hög resistensfrekvens. På grund av detta används Rifampin och andra rifamyciner vanligtvis i kombination med andra antibakteriella läkemedel. Detta praktiseras rutinmässigt i TB -terapi och tjänar till att förhindra bildandet av mutanter som är resistenta mot något av läkemedlen i kombinationen. Rifampin dödar snabbt snabbdelande bacillistammar samt "persisters" -celler, som förblir biologiskt inaktiva under långa perioder som gör att de kan undvika antibiotisk aktivitet. Dessutom har rifabutin och rifapentin båda använts mot tuberkulos som förvärvats hos HIV-positiva patienter. Trots att tuberkulosbehandling fortfarande är den viktigaste användningen av Rifampin, har ett ökande problem med allvarliga multipla läkemedelsresistenta bakterieinfektioner lett till viss användning av antibiotika -kombinationer som innehåller Rifampin för att behandla dem.
Handlingsmekanism
Den antibakteriella aktiviteten hos rifamyciner är beroende av hämning av bakteriell DNA-beroende RNA-syntes. Detta beror på den höga affiniteten hos rifamyciner för det prokaryota RNA -polymeraset . Rifamycinernas selektivitet beror på att de har en mycket dålig affinitet för det analoga däggdjursenzymet. Kristallstrukturdata för antibiotikumet som är bundet till RNA-polymeras indikerar att rifamycin blockerar syntes genom att orsaka starka steriska krockar med den växande oligonukleotiden ("sterisk ocklusion" -mekanism). Om rifamycin binder polymeraset efter att kedjeförlängningsprocessen har börjat observeras ingen hämning av biosyntesen, i överensstämmelse med en sterisk ocklusionsmekanism. Enstegshög resistens mot rifamycinerna uppstår som ett resultat av en enda aminosyraförändring i det bakteriella DNA -beroende RNA -polymeraset.
Biosyntes
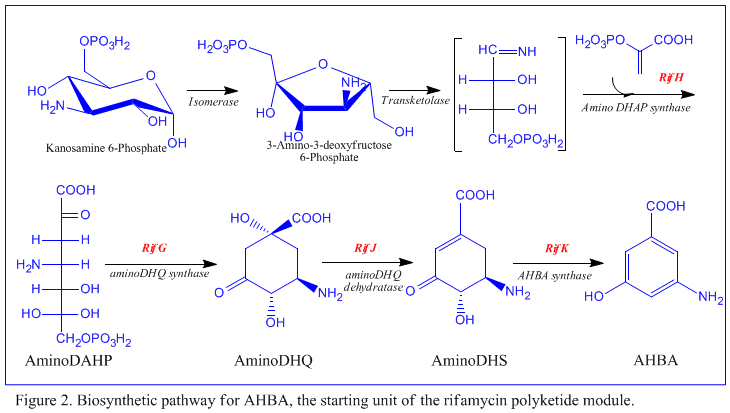
Den första informationen om biosyntesen av rifamycinerna kom från studier med den stabila isotopen Carbon-13 och NMR-spektroskopi för att fastställa ursprunget till kolskelettet. Dessa studier visade att ansakedjan härrör från acetat och propionat , i likhet med andra polyketidantibiotika . Den naftalena kromoforen visade sig härröra från en propionatenhet kopplad till en sju kolaminoenhet av okänt ursprung. Det allmänna schemat för biosyntes börjar med den ovanliga startenheten, 3-amino-5-hydroxibensoesyra ( AHBA ), via typ I polyketidväg ( PKS I ) där kedjeförlängning utförs med användning av 2 acetat och 8 propionatenheter. AHBA antas ha sitt ursprung i Shikimate -vägen , men detta införlivades inte i den biosyntetiska mekanismen. Detta beror på observationen att 3 aminosyraanaloger omvandlades till AHBA i cellfria extrakt av A. mediterranei .
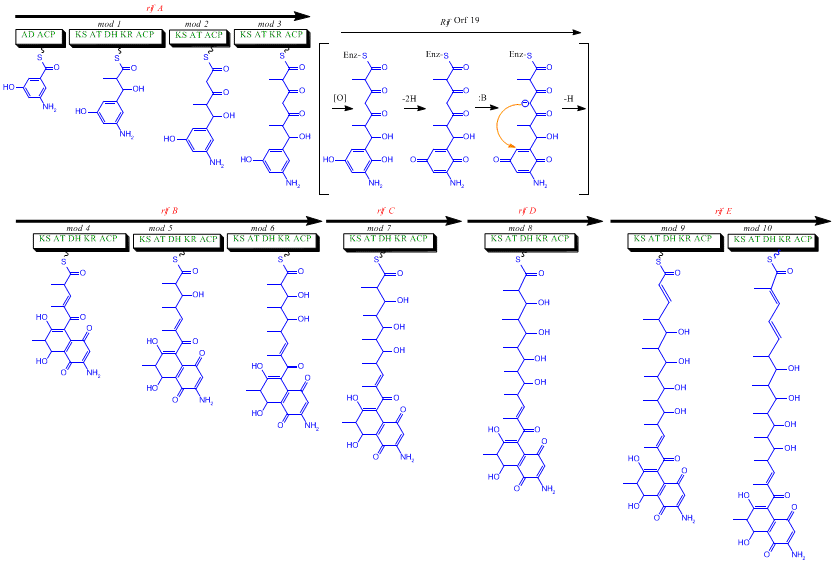
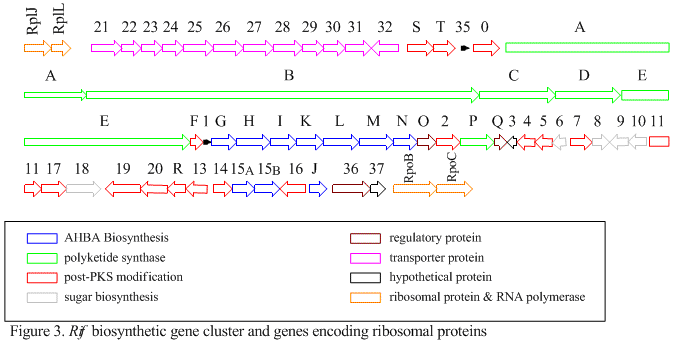
Den Rif klustret är ansvarig för biosyntesen av rifamyciner. Den innehåller gener rifG genom rifN , som visade sig biosyntetisera AHBA. [10] RifK , rifL , rifM och rifN tros fungera som transaminaser för att bilda AHBA -prekursorn kanosamin. "RifH" kodar för aminoDAHP-syntas som katalyserar kondensationen mellan 1-deoxi-1-imino-d-erytros 4-fosfat och fosfoenolpyruvat . RifA till och med rifE kodar för en polyketidsyntasmodul av typ I, varvid laddningsmodulen är ett icke-ribosomalt peptidsyntetas . Totalt, RIFA-E montera en linjär undecaketide och följs av Riff , som kodar en amid-syntas och orsakar att undecaketide att frigöra och bilda en macrolactam struktur. Dessutom innehåller rifklustret olika reglerande proteiner och glykosyleringsgener som verkar vara tysta. Andra typer av gener verkar utföra post-syntasmodifieringar av den ursprungliga polyketiden.
Derivat
Lepetit introducerade Rifampicin, ett oralt aktivt rifamycin, omkring 1966. Rifabutin, ett derivat av rifamycin S, uppfanns omkring 1975 och kom ut på den amerikanska marknaden 1993. Hoechst Marion Roussel (nu en del av Aventis ) introducerade rifapentin 1999.
Rifaximin är ett oralt rifamycin som marknadsförs i USA av Salix Pharmaceuticals som absorberas dåligt från tarmen. Det har använts för att behandla hepatisk encefalopati och resenärs diarré .
För närvarande tillgängliga rifamyciner
- Rifampicin eller Rifampin
- Rifabutin
- Rifapentine
- Rifaximin
Referenser
Bibliografi
- Sensi. et al. , Farmaco Ed. Sci. (1959) 14, 146-147 - tidningen som meddelar upptäckten av rifamycinerna.
- Thieman et al. Båge. Mikrobiol. (1969), 67 147-151 - tidningen som bytte namn på Streptomyces mediterranei till Nocardia mediterranei .
- Lechevalier et al. , Int. J. Syst. Bakteriol. (1986), 36, 29) - tidningen som bytte namn till Nocardia mediterranei som Amycolatopsis mediterranei .
- Bala S (2004). "Omklassificering av" Amycolatopsis mediterranei "DSM 46095 som" Amycolatopsis rifamycinica "sp. Nov" . International Journal of Systematic and Evolutionary Microbiology . 54 (4): 1145–1149. doi : 10.1099/ijs.0.02901-0 . PMID 15280283 . - papperet med den senaste namnändringen
externa länkar
- "Rifamycin" . Läkemedelsinformationsportal . US National Library of Medicine.