Immunhistokemi - Immunohistochemistry

Immunhistokemi ( IHC ) är den vanligaste tillämpningen av immunfärgning . Det involverar processen att selektivt identifiera antigener (proteiner) i celler i en vävnadssektion genom att utnyttja principen för antikroppar som specifikt binder till antigener i biologiska vävnader . IHC tar sitt namn från rötterna "immuno", med hänvisning till antikroppar som används i proceduren, och "histo", vilket betyder vävnad (jämför med immunocytokemi ). Albert Coons konceptualiserade och genomförde förfarandet först 1941.
Visualisering av en antikropp-antigen-interaktion kan åstadkommas på ett antal sätt, främst något av följande:
- Kromogen immunhistokemi (CIH), där en antikropp konjugeras till ett enzym, såsom peroxidas (kombinationen kallas immunoperoxidas ), som kan katalysera en färgproducerande reaktion.
- Immunfluorescens , där antikroppen är märkt till en fluorofor , såsom fluorescein eller rodamin .
Immunohistokemisk färgning är allmänt används vid diagnos av onormala celler, såsom de som finns i cancertumörer. Specifika molekylära markörer är karakteristiska för särskilda cellulära händelser såsom proliferation eller celldöd ( apoptos ). Immunhistokemi används också i stor utsträckning i grundforskning för att förstå distributionen och lokaliseringen av biomarkörer och differentiellt uttryckta proteiner i olika delar av en biologisk vävnad.
Provberedning
Förberedelse av provet är avgörande för att upprätthålla cellmorfologi, vävnadsarkitektur och antigeniciteten hos målepitoper . Detta kräver korrekt vävnadsinsamling, fixering och snittning. En lösning av formalin används ofta för att fixera vävnad, men andra metoder kan användas.
Förbereda vävnadsskivor
Vävnaden kan sedan skivas eller användas hel, beroende på syftet med experimentet eller själva vävnaden. Innan snittet kan vävnadsprovet vara inbäddat i ett medium, som paraffinvax eller kryomedia. Sektioner kan skivas på olika instrument, oftast en mikrotom , kryostat eller vibratom . Prover skivas vanligtvis i intervallet 3 µm-5 µm . Skivorna monteras sedan på objektglas, dehydratiseras med alkoholtvättar med ökande koncentrationer (t.ex. 50%, 75%, 90%, 95%, 100%) och rensas med ett tvättmedel som xylen innan de avbildas under ett mikroskop.
Beroende på metod för fixering och vävnadskonservering kan provet kräva ytterligare steg för att göra epitoperna tillgängliga för antikroppsbindning, inklusive deparaffinisering och antigenhämtning. För formalinfixerade paraffininbäddade vävnader är antigenhämtning ofta nödvändigt och innebär förbehandling av sektionerna med värme eller proteas . Dessa steg kan göra skillnaden mellan målantigenens färgning eller inte färgning.
Minska ospecifik immunfärgning
Beroende på vävnadstyp och metod för antigendetektering kan endogent biotin eller enzymer behöva blockeras respektive släckas före antikroppsfärgning. Även om antikroppar visar förmånlig aviditet för specifika epitoper kan de delvis eller svagt binda till ställen på ospecifika proteiner (även kallade reaktiva platser) som liknar de kognatiska bindningsställena på målantigenet. En stor mängd icke-specifik bindning orsakar hög bakgrundsfärgning som kommer att dölja detekteringen av målantigenet. För att minska bakgrundsfärgning i IHC, ICC och andra immunfärgningsmetoder inkuberas prover med en buffert som blockerar de reaktiva ställena till vilka de primära eller sekundära antikropparna annars kan binda. Vanliga blockerande buffertar inkluderar normalt serum, fettfri torrmjölk, BSA eller gelatin. Kommersiella blockeringsbuffertar med egenutvecklade formuleringar finns tillgängliga för ökad effektivitet. Metoder för att eliminera bakgrundsfärgning inkluderar utspädning av de primära eller sekundära antikropparna, förändring av inkubationens tid eller temperatur och användning av ett annat detektionssystem eller olika primära antikroppar. Kvalitetskontroll bör som ett minimum innefatta en vävnad som är känd för att uttrycka antigenet som en positiv kontroll och negativa kontroller av vävnad som är kända för att inte uttrycka antigenet, liksom testvävnaden som undersökts på samma sätt med utelämning av den primära antikroppen (eller bättre , absorption av den primära antikroppen).
Provmärkning
Antikroppstyper
Antikropparna som används för specifik detektion kan vara polyklonala eller monoklonala . Polyklonala antikroppar framställs genom att injicera djur med proteinet av intresse, eller ett peptidfragment och, efter att ett sekundärt immunsvar har stimulerats, isolera antikroppar från hela serum. Således är polyklonala antikroppar en heterogen blandning av antikroppar som känner igen flera epitoper . Monoklonala antikroppar framställs genom att injicera djuret och sedan ta ett specifikt prov av immunvävnad, isolera en föräldercell och använda den resulterande odödliga linjen för att skapa antikroppar. Detta gör att antikropparna visar specificitet för en enda epitop.
För immunhistokemiska detekteringsstrategier klassificeras antikroppar som primära eller sekundära reagenser. Primära antikroppar alstras mot ett antigen av intresse och är typiskt okonjugerade (omärkta), medan sekundära antikroppar alstras mot immunglobuliner hos de primära antikroppsarterna. Den sekundära antikroppen konjugeras vanligtvis till en länkmolekyl, såsom biotin , som sedan rekryterar reportermolekyler, eller så är den sekundära antikroppen själv direkt bunden till reportermolekylen.
IHC -reportrar
Reportermolekyler varierar baserat på detektionsmetodens art, den mest populära är kromogen och fluorescensdetektering medierad av ett enzym respektive en fluorofor. Med kromogena journalister reagerar en enzymmärkning med ett substrat för att ge en intensivt färgad produkt som kan analyseras med ett vanligt ljusmikroskop. Även om listan över enzymsubstrat är omfattande, är alkaliskt fosfatas (AP) och pepparrotsperoxidas (HRP) de två enzymer som används mest som etiketter för proteindetektering. En rad kromogena, fluorogena och kemiluminiscerande substrat är tillgängliga för användning med antingen enzymet, inklusive DAB eller BCIP / NBT , som producerar en brun eller lila färgning, varhelst enzymerna är bundna. Reaktionen med DAB kan förbättras med hjälp av nickel , vilket ger en djup lila/svart färgning.
Fluorescerande reportrar är små, organiska molekyler som används för IHC -detektion och inkluderar traditionellt FITC , TRITC och AMCA, medan kommersiella derivat, inklusive Alexa Fluors och Dylight Fluors, visar liknande förbättrade prestanda men varierar i pris. För kromogena och fluorescerande detektionsmetoder kan densitometrisk analys av signalen tillhandahålla halv- och fullständigt kvantitativa data för att korrelera nivån på reportersignalen till nivån av proteinuttryck eller lokalisering.

Målmetoder för detektering av antigen
Den direkta metoden är en enstegsfärgningsmetod och involverar en märkt antikropp (t.ex. FITC -konjugerat antiserum ) som reagerar direkt med antigenet i vävnadssektioner. Även om denna teknik endast använder en antikropp och därför är enkel och snabb, är känsligheten lägre på grund av liten signalförstärkning, i motsats till indirekta tillvägagångssätt. Denna strategi används dock mindre ofta än dess flerfas-motsvarighet.
Den indirekta metoden innefattar en omärkt primär antikropp (första lagret) som binder till målantigenet i vävnaden och en märkt sekundär antikropp (andra lagret) som reagerar med den primära antikroppen. Som nämnts ovan måste den sekundära antikroppen höjas mot IgG för djurarten i vilken den primära antikroppen har alstrats. Denna metod är känsligare än strategier för direkt detektering på grund av signalförstärkning på grund av bindningen av flera sekundära antikroppar till varje primär antikropp om den sekundära antikroppen konjugeras till fluorescerande eller enzymreporter .
Ytterligare amplifiering kan uppnås om den sekundära antikroppen konjugeras till flera biotinmolekyler , som kan rekrytera komplex av avidin- , streptavidin- eller NeutrAvidin -proteinbundet enzym. Skillnaden mellan dessa tre biotinbindande proteiner är deras individuella bindningsaffinitet till endogena vävnadsmål som leder till ospecifik bindning och hög bakgrund; rankningen av dessa proteiner baserat på deras ospecifika bindningsaffiniteter, från högsta till lägsta, är: 1) avidin, 2) streptavidin och 3) NeutrAvidin -protein.
Den indirekta metoden, bortsett från dess större känslighet, har också fördelen att endast ett relativt litet antal konjugerade (märkta) sekundära antikroppar behöver genereras. Till exempel är en märkt sekundär antikropp som framställs mot kanin -IgG, som kan köpas "från hyllan", användbar med vilken primär antikropp som helst som alstras i kanin. Detta är möjligt eftersom alla kanin-IgG i detta exempel skulle ha samma Fc (konstanta) region, så även med ett litet antal sekundära antikroppar mot kanin som genereras kan var och en vidhäfta till vilken primär kaninantikropp som helst. Detta är särskilt användbart när en forskare märker mer än en primär antikropp, oavsett om det beror på polyklonalt urval som producerar en rad primära antikroppar för ett singulärt antigen eller när det finns intresse för flera antigener. Med den direkta metoden skulle det vara nödvändigt att märka varje primär antikropp för varje antigen av intresse.
Motfläckar
Efter immunhistokemisk färgning av målantigenet appliceras ofta en andra fläck för att ge kontrast som hjälper den primära fläcken att sticka ut. Många av dessa fläckar visar specificitet för specifika klasser av biomolekyler, medan andra kommer att fläcka hela cellen. Både kromogena och fluorescerande färgämnen är tillgängliga för IHC för att tillhandahålla ett brett utbud av reagenser som passar varje experimentell design, och inkluderar: hematoxylin , Hoechst -fläck och DAPI används vanligen.
Felsökning
I immunhistokemiska tekniker finns det flera steg före den slutliga färgningen av vävnadsantigenet, vilket kan orsaka en mängd olika problem, inklusive stark bakgrundsfärgning, svag målantigenfärgning och autofluorescens . Endogena biotin- eller reporterenzymer eller primär/sekundär antikropps korsreaktivitet är vanliga orsaker till stark bakgrundsfärgning, medan svag färgning kan orsakas av dålig enzymaktivitet eller primär antikroppsstyrka. Vidare kan autofluorescens bero på vävnadens beskaffenhet eller fixeringsmetoden. Dessa aspekter av IHC -vävnadsförberedelse och antikroppsfärgning måste behandlas systematiskt för att identifiera och övervinna färgningsproblem.
Diagnostiska IHC -markörer
IHC är en utmärkt detekteringsteknik och har den enorma fördelen att kunna visa exakt var ett givet protein finns i den undersökta vävnaden. Det är också ett effektivt sätt att undersöka vävnaderna. Detta har gjort det till en allmänt använd teknik inom neurovetenskapen , vilket har gjort det möjligt för forskare att undersöka proteinuttryck inom specifika hjärnstrukturer. Dess stora nackdel är att, till skillnad från immunoblottingstekniker där färgning kontrolleras mot en molekylviktstege , är det omöjligt att visa i IHC att färgningen överensstämmer med proteinet av intresse. Av denna anledning måste primära antikroppar välvalideras i en Western Blot eller liknande procedur. Tekniken används ännu mer i diagnostisk kirurgisk patologi för immunofenotyperande tumörer (t.ex. immunfärgning för e-cadherin för att skilja mellan DCIS (ductal carcinoma in situ: fläckar positivt) och LCIS (lobulärt karcinom in situ: färgas inte positivt)). Mer nyligen har immunhistokemiska tekniker varit användbara vid differentialdiagnoser av flera former av spottkörtel-, huvud- och halskarcinom.
Mångfalden av IHC -markörer som används vid diagnostisk kirurgisk patologi är stor. Många kliniska laboratorier på tertiära sjukhus kommer att ha menyer med över 200 antikroppar som används som diagnostiska, prognostiska och prediktiva biomarkörer. Exempel på några vanliga markörer inkluderar:
- BrdU : används för att identifiera replikerande celler. Används för att identifiera tumörer såväl som inom neurovetenskaplig forskning.
- Cytokeratiner : används för identifiering av karcinom men kan också uttryckas i vissa sarkom.
- CD15 och CD30: används för Hodgkins sjukdom .
- Alfa -fetoprotein : för äggula -tumörer och hepatocellulärt karcinom .
- CD117 (KIT): för gastrointestinala stromaltumörer (GIST) och mastcelltumörer.
- CD10 (CALLA): för njurcellscancer och akut lymfoblastisk leukemi .
- Prostataspecifikt antigen (PSA): för prostatacancer .
- östrogener och progesteronreceptor (ER & PR) färgning används både diagnostiskt (bröst- och gyntumörer) såväl som prognostiska vid bröstcancer och förutsägande för svar på terapi (östrogenreceptor).
- Identifiering av B- celllymfom med CD20 .
- Identifiering av T- celllymfom med CD3 .
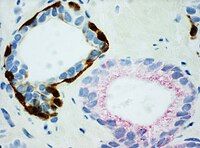
- PIN-4-cocktail, riktad mot p63 , CK-5 , CK-14 och AMACR (senare även känd som P504S), och används för att skilja prostata adenokarcinom från godartade körtlar.
Regissera terapi
En mängd olika molekylära vägar förändras vid cancer och några av förändringarna kan riktas mot cancerterapi. Immunhistokemi kan användas för att bedöma vilka tumörer som sannolikt kommer att svara på terapi, genom att detektera närvaron eller förhöjda nivåer av det molekylära målet.
Kemiska hämmare
Tumörbiologi möjliggör ett antal potentiella intracellulära mål. Många tumörer är hormonberoende. Närvaron av hormonreceptorer kan användas för att avgöra om en tumör är potentiellt mottaglig för antihormonal behandling. En av de första behandlingarna var antiöstrogen, tamoxifen , som används för att behandla bröstcancer. Sådana hormonreceptorer kan detekteras genom immunhistokemi. Imatinib , en intracellulär tyrosinkinashämmare , utvecklades för att behandla kronisk myelogen leukemi , en sjukdom som kännetecknas av bildandet av ett specifikt onormalt tyrosinkinas. Imitanib har visat sig effektivt i tumörer som uttrycker andra tyrosinkinaser, framför allt KIT. De flesta gastrointestinala stromaltumörer uttrycker KIT, som kan detekteras genom immunhistokemi.
Monoklonala antikroppar
Många proteiner som visar sig vara mycket uppreglerade i patologiska tillstånd genom immunhistokemi är potentiella mål för terapier som använder monoklonala antikroppar . Monoklonala antikroppar, på grund av deras storlek, används mot cellytemål. Bland de överuttryckta målen finns medlemmar av EGFR -familjen , transmembranproteiner med en extracellulär receptordomän som reglerar ett intracellulärt tyrosinkinas. Av dessa var HER2/neu (även känd som Erb-B2) den första som utvecklades. Molekylen uttrycks starkt i en mängd olika cancercellstyper, framför allt bröstcancer. Som sådan har antikroppar mot HER2/neu godkänts av FDA för klinisk behandling av cancer under läkemedelsnamnet Herceptin . Det finns kommersiellt tillgängliga immunhistokemiska tester, Dako HercepTest, Leica Biosystems Oracle och Ventana Pathway.
På samma sätt överuttrycks EGFR (HER-1) i en mängd olika cancerformer, inklusive huvud och hals och tjocktarm. Immunhistokemi används för att bestämma patienter som kan dra nytta av terapeutiska antikroppar som Erbitux (cetuximab). Kommersiella system för att detektera EGFR genom immunhistokemi inkluderar Dako pharmDx.
Kartläggning av proteinuttryck
Immunhistokemi kan också användas för en mer allmän proteinprofilering, förutsatt att antikroppar är validerade för immunhistokemi. Human Protein Atlas visar en karta över proteinuttryck i normala mänskliga organ och vävnader. Kombinationen av immunhistokemi och vävnadsmikroarrays ger proteinuttrycksmönster i ett stort antal olika vävnadstyper. Immunhistokemi används också för proteinprofilering i de vanligaste formerna av mänsklig cancer.
Se även
Referenser
externa länkar
- Human Protein Atlas
- Ramos-Vara JA, Miller MA (2014). "När vävnadsantigener och antikroppar går överens: återkommer de tekniska aspekterna av immunhistokemi-den röda, bruna och blå tekniken" . Veterinärpatologi . 51 (1): 42–87. doi : 10.1177/0300985813505879 . PMID 24129895 .
- Översikt över immunhistokemi-beskriver alla aspekter av IHC inklusive provförberedelse, färgning och felsökning
- Immunfluorescerande färgning av paraffininbäddad vävnad (IF-P)
- IHC Tips 1: Antigenhämtning - ska jag göra PIER eller HIER?
- Histokemiska färgningsmetoder - University of Rochester Institutionen för patologi
- Immunhistokemi färgningsprotokoll
- Burnett R, Guichard Y, Barale E (1997). "Immunhistokemi för ljusmikroskopi vid säkerhetsutvärdering av terapeutiska medel: en översikt". Toxikologi . 119 (1): 83–93. doi : 10.1016/S0300-483X (96) 03600-1 . PMID 9129199 .
- Immunhistokemi vid US National Library of Medicine Medical Subject Headings (MeSH)
- Joyner, A .; Wall, N. (2008). "Immunohistokemi för hela-mus-embryon" . Cold Spring Harbor -protokoll . 2008 (2): pdb.prot4820. doi : 10.1101/pdb.prot4820 . PMID 21356665 .

