Aktiv sida - Active site

Inom biologin är den aktiva platsen regionen för ett enzym där substratmolekyler binder och genomgår en kemisk reaktion . Det aktiva stället består av aminosyrarester som bildar tillfälliga bindningar med substratet ( bindningsstället ) och rester som katalyserar en reaktion av det substratet (katalytiskt ställe). Även om den aktiva platsen bara upptar ~ 10–20% av volymen av ett enzym, är den den viktigaste delen eftersom den direkt katalyserar den kemiska reaktionen . Det består vanligtvis av tre till fyra aminosyror, medan andra aminosyror i proteinet krävs för att upprätthålla enzymets tertiära struktur .
Varje aktiv plats utvecklas för att optimeras för att binda ett visst substrat och katalysera en särskild reaktion, vilket resulterar i hög specificitet . Denna specificitet bestäms av arrangemanget av aminosyror inom det aktiva stället och strukturen av substraten. Ibland behöver enzymer också binda med några kofaktorer för att uppfylla deras funktion. Den aktiva platsen är vanligtvis ett spår eller en ficka för enzymet som kan lokaliseras i en djup tunnel inuti enzymet, eller mellan gränssnitten för multimeriska enzymer . Ett aktivt ställe kan katalysera en reaktion upprepade gånger eftersom rester inte ändras i slutet av reaktionen (de kan förändras under reaktionen, men regenereras i slutet). Denna process uppnås genom att sänka reaktionens aktiveringsenergi , så fler substrat har tillräckligt med energi för att genomgå reaktion.
Bindningsplats
Vanligtvis har en enzymmolekyl endast två aktiva platser, och de aktiva platserna passar med en specifik typ av substrat. Ett aktivt ställe innehåller ett bindningsställe som binder substratet och orienterar det för katalys. Substratets orientering och närheten mellan det och den aktiva platsen är så viktig att enzymet i vissa fall fortfarande kan fungera korrekt även om alla andra delar muteras och förlorar funktion.
Inledningsvis är interaktionen mellan den aktiva platsen och substratet icke-kovalent och övergående. Det finns fyra viktiga typer av interaktion som håller substratet i en definierad orientering och bildar ett enzym-substratkomplex (ES-komplex): vätebindningar , van der Waals-interaktioner , hydrofoba interaktioner och elektrostatiska kraftinteraktioner. Laddningsfördelningen på substratet och den aktiva platsen måste vara komplementär, vilket innebär att alla positiva och negativa laddningar måste avbrytas. Annars kommer det att finnas en motbjudande kraft som skjuter dem isär. Det aktiva stället innehåller vanligtvis opolära aminosyror, även om ibland polära aminosyror också kan förekomma. Bindningen av substrat till bindningsstället kräver minst tre kontaktpunkter för att uppnå stereo-, regio- och enantioselektivitet. Exempelvis alkoholdehydrogenas som katalyserar överföringen av en hydrid jon från etanol till NAD + samverkar med substratet metylgrupp , hydroxylgrupp och den pro- (R) väte som kommer att abstraheras under reaktionen.
För att utöva sin funktion måste enzymer anta sin korrekta proteinvikning ( nativveck ) och tertiär struktur . För att upprätthålla denna definierade tredimensionella struktur förlitar proteiner sig på olika typer av interaktioner mellan deras aminosyrarester. Om dessa interaktioner störs, till exempel av extrema pH -värden, höga temperaturer eller höga jonkoncentrationer, kommer detta att få enzymet att denaturera och förlora sin katalytiska aktivitet.
En tätare passform mellan en aktiv plats och substratmolekylen antas öka effektiviteten av en reaktion. Om tätheten mellan det aktiva stället för DNA -polymeras och dess substrat ökar ökar trovärdigheten, vilket innebär att den korrekta DNA -replikationshastigheten också ökar. De flesta enzymer har djupt begravda aktiva platser, som kan nås av ett substrat via åtkomstkanaler.
Det finns tre föreslagna modeller för hur enzymer passar deras specifika substrat: lås- och nyckelmodellen , den inducerade passformsmodellen och konformationsurvalsmodellen. De två sistnämnda utesluter inte varandra: konformationsval kan följas av en förändring av enzymets form. Dessutom kan ett protein inte helt följa någon modell. Aminosyror vid bindningsstället för ubiquitin följer i allmänhet den inducerade passformsmodellen, medan resten av proteinet i allmänhet håller sig till konformationsval. Faktorer som temperatur påverkar sannolikt vägen som tas under bindningen, med högre temperaturer som förutses öka betydelsen av konformationsval och minska den för inducerad passform.
Lock and key hypotes
Detta koncept föreslogs av kemisten Emil Fischer från 1800-talet . Han föreslog att den aktiva platsen och substratet är två stabila strukturer som passar perfekt utan ytterligare ändringar, precis som en nyckel passar in i ett lås. Om ett substrat perfekt binder till dess aktiva plats kommer interaktionerna mellan dem att vara starkast, vilket resulterar i hög katalytisk effektivitet.
Med tiden började begränsningar för denna modell dyka upp. Till exempel kan den konkurrerande enzymhämmaren metylglukosid binda tätt till det aktiva stället för 4-alfa-glukanotransferas och passar perfekt in i det. Emellertid är 4-alfa-glukanotransferas inte aktivt på metylglukosid och ingen glykosylöverföring sker. Lock and Key -hypotesen kan inte förklara detta, eftersom det skulle förutsäga en hög effektivitet av metylglukosidglykosylöverföring på grund av dess täta bindning. Förutom konkurrerande hämning kan denna teori inte heller förklara verkningsmekanismen för icke-konkurrerande hämmare , eftersom de inte binder till det aktiva stället men ändå påverkar katalytisk aktivitet.
Inducerad passformshypotes
Daniel Koshlands teori om enzym-substratbindning är att det aktiva stället och bindningsdelen av substratet inte exakt är komplementära. Den inducerade passformsmodellen är en utveckling av lock-and-key-modellen och förutsätter att en aktiv plats är flexibel och ändrar form tills substratet är helt bundet. Denna modell liknar en person som bär handske: handsken ändrar form för att passa handen. Enzymet har initialt en konformation som lockar dess substrat. Enzymytan är flexibel och endast den korrekta katalysatorn kan framkalla interaktion som leder till katalys. Konformationsförändringar kan då inträffa när substratet är bundet. Efter reaktionen kommer produkterna att röra sig bort från enzymet och den aktiva platsen återgår till sin ursprungliga form. Denna hypotes stöds av observationen att hela proteindomänen kan röra sig flera nanometer under katalys. Denna rörelse av proteinytan kan skapa mikromiljöer som gynnar katalysen.
Konformationsurvalshypotes
Denna modell antyder att enzymer existerar i en mängd olika konformationer, varav bara några kan binda till ett substrat. När ett substrat är bundet till proteinet förskjuts jämvikten i det konformationella ensemblet mot dem som kan binda ligander (eftersom enzymer med bundna substrat avlägsnas från jämvikten mellan de fria konformationerna).
Typer av icke-kovalenta interaktioner
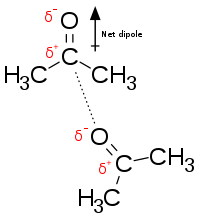
Elektrostatisk interaktion : I en vattenhaltig miljö lockar de motsatt laddade grupperna i aminosyrasidokedjor inom det aktiva stället och substrat varandra, vilket kallas elektrostatisk interaktion. Till exempel, när en karboxylsyra (R-COOH) dissocierar till RCOO - och H + joner, COO - kommer att locka positivt laddade grupper, såsom protone guanidin sidokedjan i arginin .
Vätebindning : En vätebindning är en specifik typ av dipol-dipol-interaktion mellan en delvis positiv väteatom och en partiellt negativ elektrondonator som innehåller ett par av elektroner, såsom syre , fluor och kväve . Styrkan av vätebindning beror på den kemiska naturen och det geometriska arrangemanget för varje grupp.
Van der Waalskraft : Van der Waalskraft bildas mellan motsatt laddade grupper på grund av övergående ojämn elektronfördelning i varje grupp. Om alla elektroner är koncentrerade till en pol i gruppen kommer denna ände att vara negativ, medan den andra änden kommer att vara positiv. Även om den individuella kraften är svag, eftersom det totala antalet interaktioner mellan den aktiva platsen och substratet är massivt, kommer summan av dem att vara betydande.
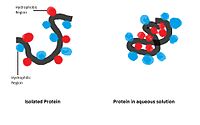
Hydrofob interaktion : Icke-polära hydrofoba grupper tenderar att aggregera tillsammans i vattenmiljön och försöka lämna från polärt lösningsmedel. Dessa hydrofoba grupper har vanligtvis en lång kolkedja och reagerar inte med vattenmolekyler. Vid upplösning i vatten kommer en proteinmolekyl att krypa ihop till en bollliknande form och lämna hydrofila grupper ute medan hydrofoba grupper är djupt begravda i mitten.
Katalytisk plats

När substratet väl har bundits och orienterats till det aktiva stället kan katalys börja. Resterna av det katalytiska stället är typiskt mycket nära bindningsstället, och vissa rester kan ha dubbla roller i både bindning och katalys.
Katalytiska rester av platsen interagerar med substratet för att sänka aktiveringsenergin för en reaktion och därigenom få den att fortgå snabbare . De gör detta genom ett antal olika mekanismer, inklusive approximation av reaktanterna, nukleofil/elektrofil katalys och syra/baskatalys. Dessa mekanismer kommer att förklaras nedan.
Mekanismer involverade i katalytisk process
Approximation av reaktanten
Under enzymkatalytisk reaktion bringas substratet och det aktiva stället samman i en nära närhet. Detta tillvägagångssätt har olika syften. För det första, när substrat binder inom det aktiva stället, ökar den effektiva koncentrationen av det avsevärt än i lösning. Detta innebär att antalet substratmolekyler som är involverade i reaktionen också ökas. Denna process minskar också den desolvationsenergi som krävs för att reaktionen ska ske. I lösning är substratmolekyler omgivna av lösningsmedelsmolekyler och energi krävs för att enzymmolekyler ska ersätta dem och komma i kontakt med substratet. Eftersom bulkmolekyler kan uteslutas från den aktiva platsen kan denna energiutmatning minimeras. Därefter är den aktiva platsen utformad för att omorientera substratet för att minska aktiveringsenergin för att reaktionen ska ske. Justeringen av substratet, efter bindning, låses i ett högenergitillstånd och kan gå vidare till nästa steg. Dessutom gynnas denna bindning av entropi eftersom energikostnaden förknippad med lösningsreaktion i stor utsträckning elimineras eftersom lösningsmedel inte kan komma in i aktiv plats. I slutändan kan det aktiva stället manipulera substratets molekylära orbital till en lämplig orientering för att minska aktiveringsenergi.
De elektrostatiska tillstånden för substrat och aktiv plats måste komplettera varandra. En polariserad negativt laddad aminosyrasidokedja kommer att avvisa oladdat substrat. Men om övergångstillståndet involverar bildandet av ett joncentrum kommer sidokedjan nu att ge en gynnsam interaktion.
Kovalent katalys
Många enzymer inklusive serinproteas , cysteinproteas , proteinkinas och fosfatas utvecklades för att bilda övergående kovalenta bindningar mellan dem och deras substrat för att sänka aktiveringsenergin och låta reaktionen ske. Denna process kan delas in i två steg: bildning och nedbrytning. Det tidigare steget är steggränssteg medan det senare steget behövs för att regenerera intakt enzym.
Nukleofil katalys : Denna process involverar donering av elektroner från enzymets nukleofil till ett substrat för att bilda en kovalent bindning mellan dem under övergångstillståndet. Styrkan i denna interaktion beror på två aspekter: förmågan hos den nukleofila gruppen att donera elektroner och elektrofilen att acceptera dem. Den förra påverkas huvudsakligen av artens grundläggande (förmåga att donera elektronpar) medan den senare är med avseende på dess p K a . Båda grupperna påverkas också av deras kemiska egenskaper som polariserbarhet , elektronegativitet och joniseringspotential . Aminosyror som kan bilda nukleofil inklusive serin , cystein , aspartat och glutamin .
Elektrofil katalys : Mekanismen bakom denna process är exakt densamma som nukleofil katalys förutom att nu fungerar aminosyror i aktiv plats som elektrofil medan substrat är nukleofiler . Denna reaktion kräver vanligtvis kofaktorer eftersom aminosyrasidokedjorna inte är tillräckligt starka för att attrahera elektroner.
Metalljoner
Metalljoner har flera roller under reaktionen. För det första kan det binda till negativt laddade substratgrupper så att de inte kommer att avvisa elektronpar från aktiva platsers nukleofila grupper. Det kan locka negativt laddade elektroner för att öka elektrofiliciteten. Det kan också överbrygga mellan aktiv plats och substrat. Äntligen kan de ändra substratets konformationsstruktur för att gynna reaktion.
Syra/baskatalys
I vissa reaktioner kan protoner och hydroxid direkt fungera som syra och bas när det gäller specifik syra och specifik baskatalys. Men oftare fungerar grupper i substrat och aktiv plats som Brønsted – Lowry syra och bas. Detta kallas allmän syra och allmän basteori. Det enklaste sättet att skilja mellan dem är att kontrollera om reaktionshastigheten bestäms av koncentrationerna av den allmänna syran och basen. Om svaret är ja är reaktionen den allmänna typen. Eftersom de flesta enzymer har ett optimalt pH-värde av 6 till 7, aminosyrorna i sidokedjan har vanligtvis en p K en av 4 ~ 10. Kandidaten inkluderar aspartat , glutamat , histidin , cystein . Dessa syror och baser kan stabilisera nukleofilen eller elektrofilen som bildas under katalysen genom att tillhandahålla positiva och negativa laddningar.
Konformationsförvrängning
Kvantitativa studier av enzymatiska reaktioner fann ofta att accelerationen av den kemiska reaktionshastigheten inte helt kan förklaras av befintliga teorier som approximation, syra/baskatalys och elektrofil/nukleofilkatalys. Och det finns en uppenbar paradox: i reversibel enzymatisk reaktion om den aktiva platsen passar perfekt till substraten kommer den bakåtreaktionen att bromsas eftersom produkter inte kan passa perfekt in i den aktiva platsen. Så konformationsförvrängning infördes och argumenterar för att både aktiv plats och substrat kan genomgå konformationsförändringar för att passa med varandra hela tiden.
Förorganiserad aktiv platskomplementaritet till övergångstillståndet
Denna teori liknar lite Lock and Key Theory, men vid denna tidpunkt är den aktiva platsen förprogrammerad för att binda perfekt till substrat i övergångstillstånd snarare än i marktillstånd. Bildandet av övergångstillstånd i lösningen kräver en stor mängd energi för att flytta lösningsmedelsmolekyler och reaktionen bromsas. Så den aktiva platsen kan ersätta lösningsmedelsmolekyler och omge substraten för att minimera den kontraproduktiva effekten som lösningen påför. Närvaron av laddade grupper med den aktiva platsen kommer att attrahera substrat och säkerställa elektrostatisk komplementaritet.
Exempel på enzymkatalysmekanismer
I verkligheten involverar de flesta enzymmekanismer en kombination av flera olika typer av katalys.
Glutation reduktas
Glutationens (GSH) roll är att ta bort ackumulerade reaktiva syrearter som kan skada celler. Under denna process, dess tiol är sidokedja oxiderat och två glutation molekyler är anslutna med en disulfidbindning för att bilda en dimer (GSSG). För att regenerera glutation måste disulfidbindningen brytas. I mänskliga celler görs detta av glutationreduktas (GR).
Glutation reduktas är en dimer som innehåller två identiska subenheter. Det kräver en NADP och en FAD som kofaktorer . Den aktiva sajten ligger i länken mellan två underenheter. NADPH är involverad i generationen av FADH-. På det aktiva stället finns två cysteinrester förutom FAD -kofaktorn och används för att bryta disulfidbindningen under den katalytiska reaktionen. NADPH är bunden av tre positivt laddade rester: Arg-218, His-219 och Arg-224.
Den katalytiska processen startar när FAD reduceras med NADPH för att acceptera en elektron och från FADH - . Den angriper då disulfidbindningen som bildas mellan 2 cysteinrester, som bildar en SH-bindning och en enda S - grupp. Detta S - grupp kommer att fungera som en nukleofil för att attackera disulfidbindningen i oxiderat glutation (GSSG), bryta den och bildar en cystein-SG-komplex. Den första SG - anjon frigörs och därefter mottager en proton från intill SH-gruppen och från den första glutation monomeren. Nästa intilliggande S - grupp attack disulfidbindning i cystein-SG komplex och frigöra den andra SG - anjon. Den tar emot en proton i lösning och bildar den andra glutationmonomeren.
Chymotrypsin
Chymotrypsin är ett serinendopeptidas som finns i bukspottskörteljuice och hjälper hydrolysen av proteiner och peptid . Det katalyserar hydrolysen av peptidbindningar i L-isomerer av tyrosin , fenylalanin och tryptofan . På det aktiva stället för detta enzym arbetar tre aminosyrarester tillsammans för att bilda en katalytisk triad som utgör det katalytiska stället. I kymotrypsin är dessa rester Ser-195, His-57 och Asp-102.
Mekanismen för kymotrypsin kan delas in i två faser. Först attackerar Ser-195 nukleofilt peptidbindningskolet i substratet för att bilda en tetraedrisk mellanprodukt. Nukleofiliciteten av Ser-195 förstärks av His-57, som abstraherar en proton från Ser-195 och är i sin tur stabiliseras av den negativt laddade karboxylat grupp (RCOO - ) i Asp-102. Vidare stabiliseras den tetraedriska oxianjon- intermediären som genereras i detta steg med vätebindningar från Ser-195 och Gly-193.
I det andra steget protoneras R'NH-gruppen av His-57 för att bilda R'NH 2 och lämnar mellanprodukten och lämnar efter sig den acylerade Ser-195. His-57 fungerar sedan som en bas igen för att abstrahera en proton från en vattenmolekyl. Den resulterande hydroxidanjonen attackerar nukleofilt acyl-enzymkomplexet för att bilda en andra tetraedral oxianjon-intermediär, som återigen stabiliseras med H-bindningar. I slutändan lämnar Ser-195 den tetraedriska mellanprodukten och bryter CO-bindningen som kopplade enzymet till peptidsubstratet. En proton överförs till Ser-195 genom His-57, så att alla tre aminosyrorna återgår till sitt ursprungliga tillstånd.
Avbindande
Substrat avbindning påverkas av olika faktorer. Större ligander stannar i allmänhet på den aktiva platsen längre, liksom de med mer roterbara bindningar (även om detta kan vara en bieffekt av storlek). När lösningsmedlet utesluts från det aktiva stället resulterar mindre flexibla proteiner i längre uppehållstider . Fler vätebindningar som skyddas från lösningsmedlet minskar också bindningen.
Kofaktorer
Enzymer kan använda kofaktorer som "hjälpmolekyler". Coenzymer hänvisas till de icke-proteinmolekyler som binder till enzymer för att hjälpa dem att fullgöra sina jobb. För det mesta är de anslutna till det aktiva stället genom icke-kovalenta bindningar såsom vätebindning eller hydrofob interaktion . Men ibland kan det också bildas ett kovalent band mellan dem. Till exempel är hemmen i cytokrom C bunden till proteinet genom tioesterbindning . I vissa fall kan koenzymer lämna enzymer efter att reaktionen är klar. Annars binder de permanent till enzymet. Coenzym är ett brett koncept som innehåller metalljoner, olika vitaminer och ATP . Om ett enzym behöver koenzym för att fungera själv kallas det för ett apoenzym. Faktum är att den inte ensam kan katalysera reaktioner ordentligt. Först när dess kofaktor kommer in och binder till den aktiva platsen för att bilda holoenzym fungerar det korrekt.
Ett exempel på koenzymet är Flavin . Den innehåller ett distinkt konjugerat isoalloxazinsystem. Flavin har flera redoxtillstånd och kan användas i processer som innebär överföring av en eller två elektroner. Det kan fungera som en elektronacceptor i reaktion, liksom oxidationen av NAD till NADH, att acceptera två elektroner och bilda 1,5-dihydroflavin. Å andra sidan kan den bilda semikinon ( fri radikal ) genom att acceptera en elektron och omvandlas sedan till helt reducerad form genom tillsats av en extra elektron. Denna egenskap gör att den kan användas i en elektronoxidationsprocess.
Hämmare
Hämmare stör interaktionen mellan enzym och substrat och saktar ner reaktionshastigheten. Det finns olika typer av hämmare, inklusive både reversibla och irreversibla former.
Konkurrenskraftiga hämmare är hämmare som endast riktar sig mot fria enzymmolekyler. De konkurrerar med substrat för fri enzymacceptor och kan övervinnas genom att öka substratkoncentrationen. De har två mekanismer. Konkurrenskraftiga hämmare har vanligtvis strukturella likheter med substraten och eller ES -komplexet. Som ett resultat kan de passa in i den aktiva platsen och utlösa gynnsamma interaktioner för att fylla i utrymmet och blockera substrat från inträde. De kan också inducera övergående konformationsförändringar i den aktiva platsen så att substrat inte kan passa perfekt med det. Efter en kort tid kommer konkurrenskraftiga hämmare att falla och lämna enzymet intakt.
Hämmare klassificeras som icke-konkurrerande hämmare när de binder både fritt enzym och ES-komplex. Eftersom de inte konkurrerar med substrat för den aktiva platsen kan de inte övervinnas genom att helt enkelt öka substratkoncentrationen. De binder vanligtvis till en annan plats på enzymet och ändrar den tredimensionella strukturen för det aktiva stället för att blockera substrat från att komma in eller lämna enzymet.
Irreversibla hämmare liknar konkurrerande hämmare eftersom de båda binder till det aktiva stället. Irreversibla hämmare bildar emellertid irreversibla kovalenta bindningar med aminosyraresterna i det aktiva stället och lämnar aldrig. Därför är den aktiva platsen upptagen och substratet kan inte komma in. Ibland kommer inhibitorn att lämna men det katalytiska stället ändras permanent i form. Dessa hämmare innehåller vanligtvis elektrofila grupper som halogensubstitut och epoxider . Med tiden binds allt fler enzymer av irreversibla hämmare och kan inte fungera längre.
| Exempel | Binder aktiv webbplats? | Minskar reaktionshastigheten? | |
|---|---|---|---|
| Konkurrerande reversibel hämmare | HIV -proteashämmare | Ja | Ja |
| Icke-konkurrenskraftig reversibel hämmare | Tungmetaller som bly och kvicksilver | Nej | Ja |
| Irreversibel hämmare | Cyanid | Ja | Ja |
Exempel på konkurrerande och irreversibla enzymhämmare
Konkurrenskraftig hämmare: HIV -proteashämmare
HIV -proteashämmare används för att behandla patienter med AIDS -virus genom att förhindra dess DNA -replikation . HIV-proteas används av viruset för att klyva Gag-Pol-polyprotein till 3 mindre proteiner som är ansvariga för virionmontering, förpackning och mognad. Detta enzym riktar sig specifikt fenylalanin - prolin klyver plats inom målproteinet. Om HIV -proteas stängs av förlorar virionpartikeln funktion och kan inte infektera patienter. Eftersom det är viktigt vid viral replikation och saknas hos friska människor, är det ett idealiskt mål för läkemedelsutveckling.
HIV -proteas tillhör aspartisk proteasfamilj och har en liknande mekanism. För det första aktiverar aspartatresten en vattenmolekyl och förvandlar den till en nukleofil . Sedan angriper den karbonylgruppen inom peptidbindningen (NH-CO) för att bilda en tetraedrisk mellanprodukt. Kväveatomen i mellanprodukten tar emot en proton, bildar en amidgrupp och efterföljande omorganisation leder till att bindningen mellan den och mellanprodukten bryts ner och bildar två produkter.
Inhibitorer innehåller vanligtvis en icke -hydrolyserbar hydroxietylen- eller hydroxietylamingrupp som efterliknar den tetraedriska mellanprodukten. Eftersom de delar en liknande struktur och elektrostatiskt arrangemang som substratets övergångstillstånd kan de fortfarande passa in i den aktiva platsen men kan inte brytas ner, så hydrolys kan inte ske.
Icke-konkurrenskraftig hämmare: Strychnine
Stryknin är ett neurotoxin som orsakar döden genom att påverka nerver som styr muskelsammandragning och orsakar andningssvårigheter. Impulsen överförs mellan synapsen genom en signalsubstans som kallas acetylkolin . Det släpps ut i synapsen mellan nervceller och binder till receptorer i den postsynaptiska cellen. Sedan genereras och överförs en åtgärdspotential genom den postsynaptiska cellen för att starta en ny cykel.
Glycin kan hämma aktiviteten hos neurotransmittorreceptorer, så en större mängd acetylkolinesteras krävs för att utlösa en åtgärdspotential. Detta säkerställer att generationen av nervimpulser kontrolleras tätt. Denna kontroll bryts emellertid ned när stryknin tillsätts. Det hämmar glycinreceptorer (en kloridkanal ) och en mycket lägre nivå av neurotransmittorkoncentration kan utlösa en åtgärdspotential. Nerver överför nu ständigt signaler och orsakar överdriven muskelsammandragning, vilket leder till kvävning och död.
Irreversibel hämmare: Diisopropylfluorfosfat
Diisopropylfluorfosfat (DIFP) är en irreversibel hämmare som blockerar verkan av serinproteas . När det binder till enzymet sker en nukleofil substitutionsreaktion som frigör en vätefluoridmolekyl . OH-gruppen i det aktiva stället fungerar som en nukleofil för att attackera de fosfor i DIFP och bildar en tetraedrisk mellanprodukt och frisätta en proton. Sedan PF bindningen är bruten, är en elektron överförs till F-atom och det lämnar den mellanliggande som F - anjon. Den kombineras med en proton i lösning för att bilda en HF -molekyl. En kovalent bindning bildas mellan den aktiva platsen och DIFP, så serinsidokedjan är inte längre tillgänglig för substratet.
Vid upptäckt av droger
Identifiering av aktiva platser är avgörande i processen för upptäckt av läkemedel . Enzymens 3D-struktur analyseras för att identifiera aktiva platsrester och utforma läkemedel som kan passa in i dem. Proteolytiska enzymer är mål för vissa läkemedel, såsom proteashämmare, som inkluderar läkemedel mot AIDS och högt blodtryck. Dessa proteashämmare binder till ett enzyms aktiva plats och blockerar interaktion med naturliga substrat. En viktig faktor för läkemedelsdesign är bindningsstyrkan mellan det aktiva stället och en enzymhämmare. Om enzymet som finns i bakterier skiljer sig väsentligt från det humana enzymet kan en hämmare utformas mot just den bakterien utan att skada det mänskliga enzymet. Om en typ av enzym endast finns i en sorts organism kan dess hämmare användas för att specifikt utplåna dem.
Aktiva platser kan kartläggas för att underlätta utformningen av nya läkemedel, såsom enzymhämmare. Detta innefattar beskrivningen av storleken på en aktiv plats och antalet och egenskaperna för delplatser, såsom detaljer om bindningsinteraktionen. Modern databasteknik som kallas CPASS (Comparison of Protein Active Site Structures) möjliggör dock jämförelse av aktiva webbplatser mer detaljerat och att hitta strukturell likhet med hjälp av programvara.
Användning av enzymhämmare
| Exempel | Handlingsmekanism | |
|---|---|---|
| Antibakteriellt medel | Penicillin | Den bakteriella cellväggen är sammansatt av peptidoglykan . Under bakterietillväxt bryts den nuvarande tvärbindningen av peptidoglykanfiber, så att ny cellväggsmonomer kan integreras i cellväggen. Penicillin verkar genom att hämma transpeptidas som är avgörande för bildandet av tvärbindningar, så cellväggen försvagas och kommer att sprängas upp på grund av turgortryck . |
| Antisvampmedel | Azole | Ergosterol är en sterol som bildar cellytans membran hos svamparna . Azol kan hämma sin biosyntes genom att hämma Lanosterol 14 alfa-demetylas , så ingen ny ergosterol produceras och skadligt 14α-lanosterol ackumuleras i cellen. Azol kan också generera reaktiva syrearter . |
| Antiviralt medel | Saquinavir | HIV-proteas behövs för att klyva Gag-Pol-polyprotein i 3 individuella proteiner så att de kan fungera korrekt och starta en viral förpackningsprocess. HIV -proteashämmare som Saquinavir hämmar det så att ingen ny mogen viral partikel kan göras. |
| Insekticider | Fysostigmin | I djuret nervsystemet , acetylkolinesteras krävs för att bryta ned signalsubstansen acetylkolin i acetat och kolin . Fysostigmin binder till dess aktiva plats och hämmar det, så impulssignal kan inte överföras genom nerver. Detta resulterar i att insekter dör eftersom de tappar kontrollen över muskel- och hjärtfunktion. |
| Herbicider | Cyklohexandion | Cyklohexandion riktar sig mot Acetyl-CoA-karboxylas som är involverat i det första steget av fettsyntes: ATP-beroende karboxylering av acetyl-CoA till malonyl-CoA . Lipider är viktiga för att bilda cellmembranet. |
Allosteriska platser
En allosterisk plats är en plats på ett enzym, som inte är relaterat till dess aktiva plats, som kan binda en effektormolekyl. Denna interaktion är en annan mekanism för enzymreglering. Allosterisk modifiering sker vanligtvis i proteiner med mer än en subenhet. Allosteriska interaktioner är ofta närvarande i metaboliska vägar och är fördelaktiga genom att de tillåter ett steg i en reaktion att reglera ett annat steg. De tillåter ett enzym att ha en rad molekylära interaktioner, andra än den mycket specifika aktiva platsen.
Se även
Referenser
Vidare läsning
- Alan Fersht, Struktur och mekanism i proteinvetenskap: En guide till enzymkatalys och proteinvikning. WH Freeman, 1998. ISBN 0-7167-3268-8
- Bugg, T. Introduktion till enzym- och koenzymkemi. (Andra upplagan), Blackwell Publishing Limited, 2004. ISBN 1-4051-1452-5 .