Proteorhodopsin - Proteorhodopsin
| Proteorhodopsin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Proteorhodopsin Cartoon Visualization av ELViture
| |||||||||
| Identifierare | |||||||||
| Symbol | Bac_rhodopsin | ||||||||
| Pfam | PF01036 | ||||||||
| InterPro | TCDB | ||||||||
| PROSIT | PDOC00291 | ||||||||
| SCOP2 | 2brd / SCOPe / SUPFAM | ||||||||
| TCDB | 3.E.1 | ||||||||
| OPM superfamilj | 6 | ||||||||
| OPM -protein | 4hyj | ||||||||
| |||||||||
Proteorhodopsin (även känt som pRhodopsin ) är en familj med över 50 fotoaktiva retinylidenproteiner , en större familj av transmembranproteiner som använder retinal som kromofor för ljusförmedlad funktionalitet, i detta fall en protonpump . Vissa homologer finns som pentamerer eller hexamerer. pRhodopsin hittas i marina plankton bakterier , arkéer och eukaryoter ( protae ), men var först upptäcktes i bakterier.
Dess namn härstammar från proteobakterier som är uppkallade efter antika grekiska Πρωτεύς ( Proteus ), en tidig havsguden nämns av Homeros som " Old Man of the Sea ", Ῥόδος (Rhodon) för " steg ", på grund av sin rosa färg och ὄψις ( opsis ) för "syn". Vissa medlemmar av familjen, Homolog rhodopsin -liknande pigment , dvs bakteriorodopsin (av vilka det finns mer än 800 typer) har sensoriska funktioner som opsins , integrerade för visuell ljusöver . Många av dessa sensoriska funktioner är okända - till exempel Neuropsins funktion i den mänskliga näthinnan. Medlemmar är kända för att ha olika absorptionsspektra inklusive grönt och blått synligt ljus .
Upptäckt
Proteorhodopsin (PR eller pRhodopsin) upptäcktes första gången år 2000 inom en bakteriell artificiell kromosom från tidigare odlade marina γ-proteobakterier , som fortfarande endast refereras till av deras ribotypmetagenomiska data , SAR86. Forskningen var ett samarbete mellan fyra parter: Oded Beja , Marcelino T. Suzuki och Edward F. DeLong vid Monterey Bay Aquarium Research Institute (Mosslanding, CA), L. Aravind och Eugene V Koonin vid National Center for Biotechnology Information ( Bethesda, MD), Andrew Hadd, Linh P. Nguyen, Stevan B. Jovanovich, Christian M. Gates och Rober A Feldman vid Molecular Dynamics (Sunnyvale, CA) och slutligen John och Elena Spudich vid institutionen för mikrobiologi och molekylär genetik vid University of Texas Health Science Center i Houston . Fler arter av y-proteobakterier, både grampositiva och negativa, visade sig uttrycka proteinet.
Distribution
Prover av proteorhodopsin som uttrycker bakterier har erhållits från östra Stilla havet , centrala norra Stilla havet och södra havet , Antarktis . Därefter har gener från proteorhodopsinvarianter identifierats i prover från Medelhavet , Röda havet , Sargassohavet och Japans hav och Nordsjön .
Proteorodopsin varianter inte sprids slumpmässigt, men dispersa längs djup gradienter baserade på maximal absorption-avstämning av den speciella holoproteinet sekvensen ; detta beror huvudsakligen på den elektromagnetiska absorption av vatten som skapar våglängds gradienter i förhållande till djup. Oxyrrhis marina är en Dinoflagellat- protist med grönabsorberande proteorhodopsin (ett resultat av L109-gruppen) som finns mestadels i grunda tidvattenbassänger och stränder, där grönt ljus fortfarande finns tillgängligt. Karlodinium micrum, ett annat dinolagelat, uttrycker ett blåstämt proteorhodopsin (E109) som kan vara relaterat till dess vertikala migreringar på djupt vatten . O.Marina ursprungligen tros vara en heterotroph dock proteorodopsinet väl kan delta i en funktionellt signifikant sätt, eftersom det var det mest rikligt uttryckta nukleär gen och vidare dispergeras ojämnt i organismen, vilket tyder på viss organell membranfunktion. Tidigare var de enda eukaryota solenergitransducerande proteinerna Fotosystem I och Fotosystem II . Det har antagits att lateral genöverföring är den metod genom vilken proteorhodopsin har tagit sig in i många fyla. Bakterier, archea och eukarya koloniserar alla den fotiska zonen där de kommer fram i ljuset; Proteorhodopsin har kunnat spridas genom denna zon, men inte till andra delar av vattenkolonnen.
Taxonomi
Proteorhodopsin tillhör en familj av liknande retinylidenproteiner, mest lik dess archeal homologes halorhodopsin och bacteriorhodopsin. Sensorisk Rhodopsin upptäcktes av Franz Christian Boll 1876. Bacteriorhodopsin upptäcktes 1971 och namngavs 1973 och är för närvarande bara känt för att existera i arkeområdet, inte bakterier. Halorhodopsin upptäcktes och namngavs först 1977. Bacteriorhodopsin och Halorhodopsin existerar båda bara inom Archea -domänen medan proteorhodopsin spänner över bakterier, arkea och eukaryoter. Proteorhodopsin delar sju transmembrana a-helixer som är retinal kovalent kopplade med en Schiff-basmekanism till en lysinrest i den sjunde helixen (helix G). Bacteriorhodopsin, liksom proteorhodopsin, är en ljusdriven protonpump. Sensory Rhodopsin är ett G-kopplat protein som är synligt.
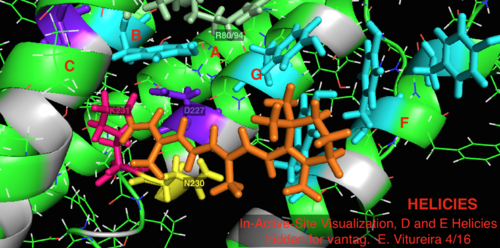
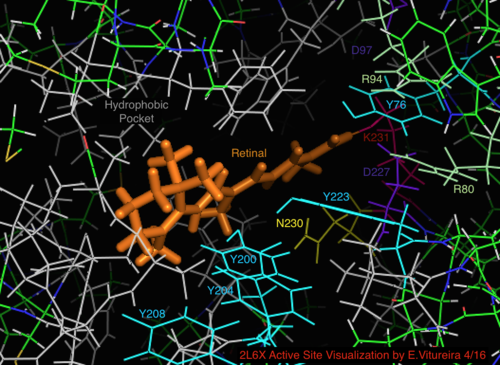
Aktiv sida
I jämförelse med dess mer välkända arkaeala homologbakteriorhodopsin bevaras de flesta av de aktiva platsresterna av känd betydelse för bakteriorhodopsin-mekanismen i proteorhodopsin. Sekvenslikhet bevaras dock inte signifikant från vare sig halo- eller bakterio-rhodopsin. Homologer av de aktiva platsresterna Arg 82, Asp 85 (den primära protonacceptorn ), Asp 212 och Lys 216 ( retinal Schiff -basbindningsstället) i bakteriorhodopsin bevaras som Arg94, Asp97, Asp227 och Lys231 i proteorhodopsin. I proteorhodopsin finns det dock inga karboxylsyrarester direkt homologa med Glu 194 eller Glu204 av bakteriorhodopsin (eller Glu 108 och 204 beroende på bacRhodopsin -varianten), som man tror är involverade i protonfrisättningsvägen vid den extracellulära ytan. Emellertid kan Asp97 och Arg94 ersätta denna funktionalitet utan den närliggande restens närhet som i bakteriorhodopsin. Institutionen för kemi vid Syracuse University visade avgörande att Asp97 inte kan vara protonfrisättningsgruppen eftersom frisättningen skedde under tvingande förhållanden under vilka asparaginsyragruppen förblev protonerad.
Ligand
De Rhodopsin haloprotein familjen delar liganden Retinal, vitamin A-aldehyd, en av de många typer av vitamin A. Retinal är en konjugerad poly- omättad kromofor ( polyen ), erhållna från köttätande diet eller genom karoten vägen ( β-karoten 15,15 '-monoxygenas ).
Fungera
Proteorhodopsin fungerar i hela jordens hav som en ljusdriven H+ -pump, med en mekanism som liknar bakteriorhodopsins. Som i bakteriorhodopsin är retinal kromofor för proteorhodopsin kovalent bunden till apoproteinet via en protonerad Schiff -bas vid Lys231. Konfigurationen av retinala kromoforen i opotolymerat proteorhodopsin är övervägande all-trans och isomeriseras till 13-cis vid belysning med ljus. Flera modeller av den fullständiga proteorhodopsin fotocykeln har föreslagits, baserade på FTIR och UV -synlig spektroskopi ; de liknar etablerade fotocykelmodeller för bacteriorhodopsin. Kompletta proteorhodopsinbaserade fotosystem har upptäckts och uttryckts i E. coli, vilket ger dem ytterligare ljusmedierad energigradientförmåga för ATP -generering utan yttre behov av näthinnan eller prekursorer; med PR kodar gen fem andra proteiner för den biosyntetiska vägen för fotopigment.
Genteknik
Om genen för proteorhodopsin sätts in i E. coli och retinal ges till dessa modifierade bakterier , kommer de att införliva pigmentet i sitt cellmembran och pumpa H+ i närvaro av ljus. En djup lila är representativ för tydligt transformerade kolonier på grund av ljusabsorption. Protongradienter kan användas för att driva andra membranproteinstrukturer eller användas för att surgöra en organell av vesikeltyp. Det demonstrerades vidare att protongradienten genererad av proteorhodopsin kunde användas för att generera ATP.