Fotoaktiverad lokaliseringsmikroskopi - Photoactivated localization microscopy
Fotoaktiverad lokaliseringsmikroskopi ( PALM eller FPALM ) och stokastisk optisk rekonstruktionsmikroskopi (STORM) är vidfält (till skillnad från punktskanningstekniker som laserskanning konfokalmikroskopi ) fluorescensmikroskopi avbildningsmetoder som gör det möjligt att få bilder med en upplösning bortom diffraktionsgränsen . Metoderna föreslogs 2006 i kölvattnet av en allmän uppkomst av optiska superupplösta mikroskopimetoder och presenterades som Årets metoder för 2008 av Nature Methods- tidskriften. Utvecklingen av PALM som en riktad biofysisk avbildningsmetod föranleddes till stor del av upptäckten av nya arter och konstruktionen av mutanter av fluorescerande proteiner som uppvisar en kontrollerbar fotokromism , såsom fotoaktiverbar GFP . Men samtidigt utvecklingen av STORM, som delar samma grundläggande princip, använde ursprungligen parade cyaninfärger . En molekyl av paret (kallad aktivator), när den exciteras nära dess absorptionsmaximum, tjänar till att återaktivera den andra molekylen (kallad reporter) till fluorescerande tillstånd.
Ett växande antal färgämnen används för PALM, STORM och relaterade tekniker, både organiska fluoroforer och fluorescerande proteiner. Vissa är kompatibla med levande cellavbildning, andra tillåter snabbare förvärv eller tätare märkning. Valet av en viss fluorofor beror slutligen på applikationen och dess underliggande fotofysiska egenskaper.
Båda teknikerna har genomgått betydande teknisk utveckling, i synnerhet möjliggör mångfärgad avbildning och förlängning till tre dimensioner, med den bästa aktuella axiella upplösningen på 10 nm i den tredje dimensionen erhållen med hjälp av en interferometrisk metod med två motsatta mål som samlar fluorescensen från provet.
Princip
Konventionell fluorescensmikroskopi utförs genom att selektivt färga provet med fluorescerande molekyler, antingen kopplade till antikroppar som i immunhistokemi eller genom att använda fluorescerande proteiner som är genetiskt fusionerade till generna av intresse. Vanligtvis, ju mer koncentrerade fluoroforerna, desto bättre är kontrasten för fluorescensbilden.
En enda fluorofor kan visualiseras under ett mikroskop (eller till och med under blotta ögat) om antalet fotoner som avges är tillräckligt högt och däremot är bakgrunden tillräckligt låg. Den tvådimensionella bilden av en punktkälla observerad under ett mikroskop är en förlängd plats, motsvarande Airy -disken (en sektion av punktspridningsfunktionen ) i bildsystemet. Möjligheten att som två enskilda enheter identifiera två fluoroforer på nära avstånd är begränsad av ljusets diffraktion . Detta kvantifieras med Abbes kriterium och anger att det minimala avståndet som gör det möjligt att lösa två punktkällor ges av
var är våglängden för fluorescerande emission och NA är mikroskopets numeriska bländare . Den teoretiska upplösningsgränsen vid den kortaste praktiska excitationsvåglängden är cirka 150 nm i sidodimensionen och närmar sig 400 nm i den axiella dimensionen (om man använder ett objektiv med en numerisk bländare på 1,40 och excitationsvåglängden är 400 nm).
Om emissionen från de två närliggande fluorescerande molekylerna görs särskiljbar, dvs fotonerna som kommer från var och en av de två kan identifieras, är det möjligt att övervinna diffraktionsgränsen. När en uppsättning fotoner från en specifik molekyl har samlats bildar den en diffraktionsbegränsad plats i mikroskopets bildplan. Mitten av denna plats kan hittas genom att montera den observerade emissionsprofilen på en känd geometrisk funktion, vanligtvis en Gauss -funktion i två dimensioner. Felet som görs vid lokalisering av mitten av en punktsändare skalas till en första approximation som den inversa kvadratroten för antalet utsända fotoner, och om tillräckligt med fotoner samlas in är det lätt att få ett lokaliseringsfel mycket mindre än den ursprungliga punkten spridningsfunktion.
De två stegen för identifiering och lokalisering av enskilda fluorescerande molekyler i en tät miljö där många är närvarande är grunden för PALM, STORM och deras utveckling.
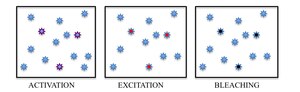
Även om det finns många metoder för molekylär identifiering, utvecklades den ljusinducerade fotokromismen hos utvalda fluoroforer som den mest lovande metoden för att skilja angränsande molekyler genom att separera deras fluorescerande emission i tid. Genom att slå på stokastiskt glesa delmängder av fluoroforer med ljus med en specifik våglängd kan enskilda molekyler sedan exciteras och avbildas enligt deras spektra. För att undvika ackumulering av aktiva fluoroforer i provet, som så småningom skulle brytas tillbaka till en diffraktionsbegränsad bild, utnyttjas det spontant förekommande fenomenet fotoblekning i PALM, medan reversibel växling mellan ett fluorescerande på-tillstånd och ett mörkt off-tillstånd av ett färgämne utnyttjas i STORM.
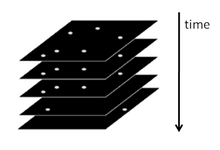
Sammanfattningsvis är PALM och STORM baserade på att samla under ett fluorescerande mikroskop ett stort antal bilder som var och en innehåller bara några få aktiva isolerade fluoroforer. Bildsekvensen möjliggör de många emissionscykler som krävs för att stokastiskt aktivera varje fluorofor från ett icke-emissivt (eller mindre emissivt) tillstånd till ett ljust tillstånd och tillbaka till ett icke-emissivt eller blekt tillstånd. Under varje cykel hålls densiteten hos aktiverade molekyler tillräckligt låg för att molekylära bilder av enskilda fluoroforer normalt inte överlappar varandra.
Lokalisering av enskilda fluoroforer
I varje bild av sekvensen beräknas positionen för en fluorofor med en precision som vanligtvis är större än diffraktionsgränsen - i det typiska intervallet från några till tiotals nm - och den resulterande informationen om positionen för centren för alla lokaliserade molekyler används för att bygga upp den superupplösta PALM- eller STORM-bilden.
Lokaliseringsprecisionen kan beräknas enligt formeln:
där N är antalet insamlade fotoner, a är bildstorlekens pixelstorlek, är den genomsnittliga bakgrundssignalen och är standardavvikelsen för punktspridningsfunktionen. Kravet på att samtidigt lokalisera flera fluoroforer samtidigt över ett utvidgat område avgör anledningen till att dessa metoder är vida fält och som en detektor använder en CCD , EMCCD eller en CMOS- kamera.
Kravet på ett förbättrat signal-brusförhållande för att maximera lokaliserings precision bestämmer den frekventa kombinationen av detta koncept med Widefield fluorescerande mikroskop medger optisk sektione, såsom total inre reflektion fluorescensmikroskop (TIRF) och lätta ark fluorescensmikroskop .
Superupplöst bild
Upplösningen av den slutliga bilden begränsas av precisionen för varje lokalisering och antalet lokaliseringar, istället för av diffraktion. Superupplösningsbilden är därför en pointillistisk representation av koordinaterna för alla de lokaliserade molekylerna. Superupplösningsbilden återges vanligen genom att representera varje molekyl i bildplanet som en tvådimensionell Gauss med amplitud proportionell mot antalet fotoner som samlas in och standardavvikelsen beroende på lokaliseringsprecisionen.
Ansökningar
Flerfärgad PALM/STORM
De säregna fotofysiska egenskaperna hos de fluoroforer som används vid PALM/STORM -superupplösning ger både begränsningar och möjligheter för mångfärgad avbildning. Tre strategier har framkommit hittills: excitation av spektralt separerade fluoroforer med hjälp av en strålningssignal för strålning, användning av flera aktivatorer/reportrar i STORM -läge och ratiometrisk avbildning av spektralt nära fluoroforer.
3D i PALM och STORM
Även om de ursprungligen utvecklades som 2D (x, y) avbildningsmetoder, har PALM och STORM snabbt utvecklats till 3D (x, y, z) kapabla tekniker. För att bestämma den axiella positionen för en enda fluorofor i provet används följande metoder för närvarande: modifiering av punktspridningsfunktionen för att införa z-beroende funktioner i 2D (x, y) -bilden (det vanligaste tillvägagångssättet är att införa astigmatism i PSF); multipeldetektering , där den axiella positionen bestäms genom att jämföra två bilder av samma PSF -defokuserade en med avseende på den andra; interferometrisk bestämning av sändarens axiella position med användning av två motsatta mål och flera detektorer; användning av tidsmässig fokusering för att begränsa excitationen/aktiveringen; användning av ljusark excitation/aktivering för att begränsa till några hundra nanometer tjockt lager godtyckligt placerat längs z-planet i provet.
Levande cellavbildning
Kravet på flera cykler av aktivering, excitation och avaktivering/blekning skulle vanligtvis innebära långa tidsperioder för att bilda en PALM/STORM-bild och därför drift på ett fast prov. Ett antal verk har publicerats redan 2007 som utförde PALM/STORM på levande celler. Möjligheten att utföra levande superupplöst avbildning med hjälp av dessa tekniker beror i slutändan på de tekniska begränsningarna för att samla in tillräckligt med fotoner från en enda sändare på mycket kort tid. Detta beror både på sondens fotofysiska begränsningar såväl som på känsligheten hos den använda detektorn. Relativt långsamma (sekunder till tiotals sekunder) processer som modifiering i organisationen av fokalvidhäftningar har undersökts med hjälp av PALM, medan STORM har möjliggjort avbildning av snabbare processer som membrandiffusion av klatrinbelagda gropar eller mitokondriella fission/fusionsprocesser. En lovande tillämpning av levande cell-PALM är användningen av fotoaktivering för att utföra högdensitetsspårning med en enda partikel (sptPALM), vilket övervinner den traditionella begränsningen av enkelpartikelspårning för att arbeta med system som visar en mycket låg koncentration av fluoroforer.
Nanofotoniska interaktioner
Medan traditionella PALM- och STORM -mätningar används för att bestämma provets fysiska struktur, med intensiteten hos fluorescerande händelser som bestämmer lokaliseringssäkerheten, kan dessa intensiteter också användas för att kartlägga fluoroforinteraktioner med nanofotoniska strukturer. Detta har utförts på både metalliska ( plasmoniska ) strukturer, såsom guld -nanoroder, samt halvledande strukturer, såsom kisel -nanotrådar. Dessa tillvägagångssätt kan antingen användas för fluoroforer som är funktionaliserade på ytan av provet av intresse (som för de plasmoniska partikelstudier som nämns här), eller slumpmässigt adsorberas på substratet som omger provet, vilket möjliggör fullständig 2D-kartläggning av fluoroforen-nanostrukturinteraktioner vid alla positioner i förhållande till strukturen.
Dessa studier har funnit att, utöver den standardiserade osäkerheten för lokalisering på grund av punktspridningsfunktionspassningen , kan självinterferens med ljus spridda av nanopartiklar leda till snedvridningar eller förskjutningar av de avbildade punktspridningsfunktionerna, vilket komplicerar analysen av sådana mätningar. Dessa kan dock vara möjliga att begränsa, till exempel genom att införliva meta -ytmaskar som styr den tillåtna vinkelfördelningen i mätsystemet.
Skillnader mellan PALM och STORM
PALM och STORM delar en gemensam grundläggande princip, och många utvecklingar har tenderat att göra de två teknikerna ännu mer sammanflätade. Ändå skiljer de sig åt i flera tekniska detaljer och en grundläggande punkt. På den tekniska sidan utförs PALM på ett biologiskt prov med fluoroforer uttryckta exogent i form av genetiska fusionskonstruktioner till ett fotoaktiverbart fluorescerande protein. STORM använder istället immunmärkning av endogena molekyler i provet med antikroppar märkta med organiska fluoroforer. I båda fallen drivs fluoroforerna mellan ett aktivt ON och ett inaktivt AV-läge av ljus. I PALM begränsar emellertid fotoaktivering och fotoblekning livslängden för fluoroforen till ett begränsat tidsintervall, och en kontinuerlig emission av fluoroforen är önskvärd däremellan utan någon fluorescensintermittens. I STORM utnyttjades stokastisk fotoblinkning av de organiska fluoroforerna (vanligtvis ljusare än fluorescerande proteiner) för att separera närliggande färgämnen. I detta avseende, ju mer robust blinkningen är, desto större är sannolikheten att skilja två angränsande fluoroforer.
I detta avseende har flera forskningsverk undersökt PALM: s potential att utföra en kvantifiering av antalet fluoroforer (och därför proteiner av intresse) som finns i ett prov genom att räkna de aktiverade fluoroforerna. Tillvägagångssättet som används för att behandla den fluorescerande dynamiken hos den fluorescerande etiketten som används i experimenten kommer att bestämma det slutliga utseendet på superupplösningsbilden och möjligheten att bestämma en entydig korrespondens mellan en lokaliseringshändelse och ett protein i provet.
Multimedia
Immobiliserade fluorescerande proteiner som fotoaktiveras, exciteras och bleks
Superupplöst dynamisk avbildning av dendritiska piggar med hjälp av ett fotokonvertibelt aktin med låg affinitet.
Undersöker aktin -dynamik i sub -ryggrad i råtthippocampala neuroner med optisk mikroskopi med superupplösning
Referenser
externa länkar
- Superupplösningsmikroskopi inom Zeiss utbildningssida i mikroskopi och digital bildbehandling
- Grundläggande begrepp i superupplösning inom Nikons utbildningsresurser för mikroskopiutbildning
- Eric Betzig och Harald Hess pratar: Utvecklar PALM -mikroskopi
- Xiaowei Zhuang-samtal: Superupplösningsmikroskopi
- Ljusmikroskopi: En pågående samtidsrevolution (introduktionsöversikt)