X -inaktivering - X-inactivation

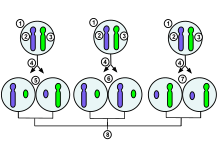
1. Embryonell cell i tidigt stadium hos en kvinnlig människa
2.
Maternal X-kromosom
3. Paternal X-kromosom 4. Mitos och slumpmässig inaktivering av X-kromosom
5. Papperskromosom inaktiveras slumpmässigt i en dottercell, maternell kromosom inaktiveras i de andra
6 .Paternell kromosom inaktiveras slumpmässigt i båda dottercellerna
7.Moderns kromosom inaktiveras slumpmässigt i båda dottercellerna
8. Tre möjliga slumpmässiga kombinationsresultat
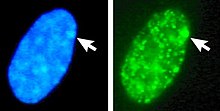
Vänster: DNA (DAPI) -färgad kärna. Pilen anger platsen för Barr -kroppen (Xi). Till höger: DNA -associerat histonprotein detekterat
X-inaktivering (även kallad lyonisering , efter den engelska genetikern Mary Lyon ) är en process genom vilken en av kopiorna av X-kromosomen inaktiveras hos theriska kvinnliga däggdjur . Den inaktiva X -kromosomen tystas genom att den förpackas i en transkriptionellt inaktiv struktur som heter heterokromatin . Som nästan alla kvinnliga däggdjur har två X-kromosomer, X-inaktive hindrar dem från att ha dubbelt så många X-kromosomen genprodukter som män , som bara besitter en enda kopia av X-kromosomen (se doserings ersättning ).
Valet av vilken X -kromosom som ska inaktiveras är slumpmässigt hos placentaldäggdjur som människor , men när en X -kromosom är inaktiverad kommer den att förbli inaktiv under hela cellens och dess ättlingar i organismen (dess cellinje). X-inaktivering som är ojämnt fördelad över cellinjer inom en organism ( skev X-inaktivering ) förekommer vanligtvis.
Till skillnad från den slumpmässiga X-inaktiveringen hos placentaldäggdjur, gäller inaktivering i pungdjur uteslutande för den paternalt härledda X-kromosomen.
Mekanism
Cykel för X-kromosomaktivering hos gnagare
Paragraferna nedan har endast att göra med gnagare och återspeglar inte XI hos majoriteten av däggdjur. X-inaktivering är en del av X-kromosomens aktiveringscykel under hela kvinnlivet. Ägget och den befruktade zygoten använder initialt maternella transkript, och hela det embryonala genomet tystas tills zygotisk genomaktivering. Därefter genomgår alla musceller en tidig, präglad inaktivering av den paternalt härledda X-kromosomen i 4-8 cellstadiumembryon . De extraembryoniska vävnaderna (som ger upphov till moderkakan och andra vävnader som stöder embryot) behåller denna tidiga inpräglade inaktivering, och därmed är endast moderns X -kromosom aktiv i dessa vävnader.
I den tidiga blastocysten reverseras denna initiala, inpräglade X-inaktivering i cellerna i den inre cellmassan (som ger upphov till embryot), och i dessa celler blir båda X-kromosomerna aktiva igen. Var och en av dessa celler inaktiverar sedan oberoende och slumpmässigt en kopia av X -kromosomen. Denna inaktiveringshändelse är irreversibel under individens livstid, med undantag för könsceller. I den kvinnliga könslinjen före meiotisk inträde reverseras X-inaktivering, så att efter meios innehåller alla haploida oocyter en enda aktiv X-kromosom.
Översikt
Den Xi markerar inaktiva, Xa den aktiva X-kromosomen. X P betecknar faderligt, och X M betecknar moderns X -kromosom. När ägget (bär X M ) befruktas av en sperma (bär ett Y eller ett X P ) bildas en diploid zygot. Från zygote, genom vuxenstadiet, till nästa generation ägg, X -kromosomen genomgår följande förändringar:
- Xi P Xi M zygote → genomgår zygotisk genomaktivering , vilket leder till:
- Xa P Xa M → genomgår påtryckt (faderlig) X-inaktivering , vilket leder till:
- Xi P Xa M → genomgår X-aktivering i det tidiga blastocyststadiet , vilket leder till:
- Xa P Xa M → genomgår slumpmässig X-inaktivering i den embryonala härkomst (inre cellmassa) i blastocyststadiet, vilket leder till:
- Xi P Xa M ELLER Xa P Xi M → genomgår X-reaktivering i urkimceller före meios , vilket leder till:
- Xa M Xa P diploida könsceller vid meiotiskt stopp. Eftersom meiosen jag bara slutför med ägglossning finns mänskliga könsceller i detta skede från de första veckorna av utvecklingen fram till puberteten. Slutförandet av meios leder till:
- Xa M OCH Xa P haploida könsceller (ägg).
X -aktiveringscykeln har studerats bäst på möss, men det finns flera studier på människor. Eftersom de flesta bevisen kommer från möss representerar ovanstående schema händelserna hos möss. Slutförandet av meiosen förenklas här för tydlighetens skull. Steg 1–4 kan studeras i in vitro -befruktade embryon och i differentierande stamceller; X-reaktivering sker i det utvecklande embryot, och efterföljande (6–7) steg inuti kvinnokroppen, därför mycket svårare att studera.
Tidpunkt
Tidpunkten för varje process beror på arten, och i många fall diskuteras den exakta tiden aktivt. [Hela delen av den mänskliga tidpunkten för X-inaktivering i den här tabellen är mycket tveksam och bör tas bort tills den är korrekt underbyggd av empiriska data]
| Bearbeta | Mus | Mänsklig | |
| 1 | Zygotisk genomaktivering | 2–4 cellstadium | 2–8 cellstadium |
| 2 | Intryckt (faderlig) X-inaktivering | 4–8 cellstadium | Oklart om det sker hos människor |
| 3 | X-aktivering | Tidigt blastocyststadium | Tidigt blastocyststadium |
| 4 | Slumpmässig X-inaktivering i den embryonala härkomst (inre cellmassa) | Sent blastocyststadium | Sent blastocyststadium, efter implantation |
| 5 | X-reaktivering i urkimceller före meios | Från före utvecklingsvecka 4 till vecka 14 |
Arv av inaktiveringsstatus mellan cellgenerationer
Efterkommande av varje cell som inaktiverade en viss X -kromosom kommer också att inaktivera samma kromosom. Detta fenomen, som kan observeras i färgen på sköldpaddskatter när honor är heterozygota för den X-kopplade genen , bör inte förväxlas med mosaicism , vilket är en term som specifikt hänvisar till skillnader i genotypen för olika cellpopulationer i samma enskild; X-inaktivering, som är en epigenetisk förändring som resulterar i en annan fenotyp, är inte en förändring på genotypisk nivå. För en enskild cell eller släktlinje är inaktiveringen därför sned eller ' icke-slumpmässig ', och detta kan ge upphov till milda symptom hos kvinnliga 'bärare' av X-länkade genetiska störningar.
Urval av en aktiv X -kromosom
Normala honor har två X -kromosomer, och i en given cell kommer en kromosom att vara aktiv (betecknad som Xa) och en kommer att vara inaktiv (Xi). Studier av individer med extra kopior av X -kromosomen visar dock att det i celler med mer än två X -kromosomer fortfarande bara finns ett Xa, och alla återstående X -kromosomer är inaktiverade. Detta indikerar att standardtillståndet för X -kromosomen hos kvinnor är inaktivering, men en X -kromosom är alltid vald för att förbli aktiv.
Det är underförstått att inaktivering av X-kromosom är en slumpmässig process som inträffar vid tidpunkten för gastrulering i epiblasten (celler som kommer att ge upphov till embryot). Moderns och faderns X -kromosomer har lika stor sannolikhet för inaktivering. Detta skulle föreslå att kvinnor förväntas drabbas av X-länkade störningar ungefär 50% så ofta som män (eftersom kvinnor har två X-kromosomer, medan män bara har en); i själva verket är förekomsten av dessa störningar hos kvinnor mycket lägre än så. En förklaring till denna skillnad är att 12–20% av generna på den inaktiverade X-kromosomen förblir uttryckta, vilket ger kvinnor ett extra skydd mot defekta gener som kodas av X-kromosomen. Vissa föreslår att denna skillnad måste vara ett bevis på preferentiell (icke-slumpmässig) inaktivering. Företrädesvis inaktivering av faderns X-kromosom sker i både pungdjur och i cellinjer som bildar membranen som omger embryot, medan hos placentaldäggdjur kan antingen maternalt eller den paternalt härledda X-kromosomen inaktiveras i olika cellinjer.
Tidsperioden för inaktivering av X-kromosom förklarar denna skillnad. Inaktivering sker i epiblasten under gastrulering, vilket ger upphov till embryot. Inaktivering sker på cellnivå, vilket resulterar i ett mosaikuttryck, där cellfläckar har en inaktiv maternell X-kromosom, medan andra fläckar har en inaktiv faderlig X-kromosom. Till exempel skulle en heterozygot kvinnlig hemofili (en X-länkad sjukdom) få ungefär hälften av hennes leverceller att fungera korrekt, vilket vanligtvis är tillräckligt för att säkerställa normal blodpropp. Chans kan resultera i betydligt fler dysfunktionella celler; sådana statistiska ytterligheter är dock osannolika. Genetiska skillnader på kromosomen kan också göra en X-kromosom mer sannolik att genomgå inaktivering. Om en X-kromosom har en mutation som hindrar dess tillväxt eller gör den icke livskraftig, kommer celler som slumpmässigt inaktiverade X ha en selektiv fördel gentemot celler som slumpmässigt inaktiverade den normala allelen. Även om inaktivering till en början är slumpmässig kommer celler som inaktiverar en normal allel (lämnar den muterade allelen aktiva) så småningom att växa igen och ersättas av funktionellt normala celler där nästan alla har samma X-kromosom aktiverad.
Det antas att det finns en autosomalt kodad "blockeringsfaktor" som binder till X-kromosomen och förhindrar att den inaktiveras. Modellen postulerar att det finns en begränsande blockeringsfaktor, så när den tillgängliga blockeringsfaktormolekylen binder till en X -kromosom skyddas inte de återstående X -kromosomerna mot inaktivering. Denna modell stöds av förekomsten av en enda Xa i celler med många X -kromosomer och av förekomsten av två aktiva X -kromosomer i cellinjer med två gånger det normala antalet autosomer.
Sekvenser vid X -inaktiveringscentret ( XIC ), som finns på X -kromosomen, styr tystningen av X -kromosomen. Den hypotetiska blockeringsfaktorn förutses binda till sekvenser inom XIC.
Uttryck av X-länkade störningar hos heterozygota honor
Effekten av heterozygositet hos kvinnor är uppenbar i vissa lokaliserade egenskaper, till exempel det unika pälsmönstret hos en kalikokatt. Det kan dock vara svårare att fullt ut förstå uttrycket av icke-lokaliserade egenskaper hos dessa kvinnor, till exempel uttryck för sjukdom.
Eftersom män bara har en kopia av X-kromosomen, finns alla uttryckta X-kromosomala gener (eller alleler , när det gäller flera variantformer för en given gen i befolkningen) på den kopian av kromosomen. Kvinnor kommer emellertid främst att uttrycka gener eller alleler som finns på den X-kromosomala kopian som förblir aktiv. Med tanke på situationen för en gen eller flera gener som orsakar individuella skillnader i en viss fenotyp (dvs orsakar variation observerad i befolkningen för den fenotypen) spelar det hos homozygota honor inte särskilt stor roll vilken kopia av kromosomen som inaktiveras, eftersom allelerna på båda kopiorna är desamma. Men hos kvinnor som är heterozygota vid kausala gener kan inaktivering av en kopia av kromosomen framför den andra ha en direkt inverkan på deras fenotypiska värde. På grund av detta fenomen finns det en observerad ökning av fenotypisk variation hos honor som är heterozygota vid den eller de involverade generna än hos honor som är homozygota vid den genen eller de generna. Det finns många olika sätt som den fenotypiska variationen kan spela ut. I många fall kan heterozygota honor vara asymptomatiska eller endast uppvisa mindre symtom på en given störning, till exempel med X-kopplad adrenoleukodystrofi.
Differentieringen av fenotyp hos heterozygota honor främjas av närvaron av X-inaktivering. Normalt tystas varje X-kromosom i hälften av cellerna, men denna process är snedställd när preferentiell inaktivering av en kromosom inträffar. Man tror att skevning sker antingen av en slump eller av en fysisk egenskap hos en kromosom som kan få den att tystas mer eller mindre ofta, till exempel en ogynnsam mutation.
I genomsnitt inaktiveras varje X-kromosom i hälften av cellerna, men 5-20% av "uppenbarligen normala" kvinnor uppvisar X-inaktivering skevhet. I fall där snedvridning förekommer kan ett brett spektrum av symptomuttryck inträffa, vilket resulterar i att uttrycket varierar från mindre till allvarligt beroende på skevhetsproportionen. Ett extremt fall av detta sågs där monozygotiska kvinnliga tvillingar hade extrem variation i uttryck för Menkes sjukdom (en X-länkad sjukdom) som resulterade i att en tvilling dödades medan den andra förblev asymptomatisk.
Man tror att X-inaktivering kan ske på grund av problem i mekanismen som orsakar inaktivering, eller av problem i själva kromosomen. Kopplingen mellan fenotyp och skevhet ifrågasätts dock fortfarande och bör undersökas från fall till fall. En studie som tittade på både symtomatiska och asymptomatiska honor som var heterozygota för Duchenne och Becker muskeldystrofier (DMD) fann ingen uppenbar koppling mellan transkriptuttryck och skev X-inaktivering. Studien tyder på att båda mekanismerna är oberoende reglerade och att det finns andra okända faktorer som spelar in.
Kromosomal komponent
X-inaktiveringscentret (eller helt enkelt XIC) på X-kromosomen är nödvändigt och tillräckligt för att orsaka X-inaktivering. Kromosomala translokationer som placerar XIC på en autosom leder till inaktivering av autosomen och X -kromosomer som saknar XIC inaktiveras inte.
XIC innehåller fyra icke- översatta RNA- gener, Xist , Tsix , Jpx och Ftx , som är inblandade i X-inaktivering. XIC innehåller också bindningsställen för både kända och okända regleringsproteiner .
Xist och Tsix RNA
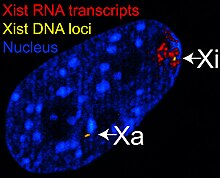
Den X-inaktiva specifika transkript ( Xist ) -genen kodar för ett stort icke-kodande RNA som är ansvarigt för att förmedla den specifika tystningen av X-kromosomen från vilken den transkriberas. Den inaktiva X -kromosomen är belagd med Xist RNA, medan Xa inte är det (se figur till höger). X -kromosomer som saknar Xist -genen kan inte inaktiveras. Att artificiellt placera och uttrycka Xist -genen på en annan kromosom leder till tystnad av den kromosomen.
Före inaktivering uttrycker båda X -kromosomerna svagt Xist RNA från Xist -genen. Under inaktiveringsprocessen upphör den framtida Xa att uttrycka Xist, medan den framtida Xi dramatiskt ökar Xist RNA -produktionen. På den framtida Xi täcker Xist RNA gradvis kromosomen och sprider sig från XIC; Xist RNA lokaliseras inte till Xa. Den tystande av gener längs Xi inträffar strax efter beläggning av Xist RNA.
Liksom Xist kodar Tsix -genen för ett stort RNA som man inte tror koder för ett protein. Tsix RNA transkriberas antisense till Xist, vilket betyder att Tsix -genen överlappar Xist -genen och transkriberas på den motsatta DNA -strängen från Xist -genen. Tsix är en negativ regulator av Xist; X -kromosomer som saknar Tsix -uttryck (och därmed har höga nivåer av Xist -transkription) inaktiveras mycket oftare än normala kromosomer.
Liksom Xist, före inaktivering, uttrycker båda X -kromosomerna svagt Tsix RNA från Tsix -genen. Vid början av X-inaktivering upphör framtiden Xi att uttrycka Tsix RNA (och ökar Xist-uttryck), medan Xa fortsätter att uttrycka Tsix i flera dagar.
Rep A är ett långt icke -kodande RNA som fungerar med ett annat långt icke -kodande RNA, Xist, för X -inaktivering. Rep A hämmar funktionen hos Tsix, antisens av Xist, i samband med att eliminerande av Xite elimineras. Det främjar metylering av Tsix -regionen genom att locka till sig PRC2 och därmed inaktivera en av X -kromosomerna.
Tystande
Den inaktiva X -kromosomen uttrycker inte majoriteten av dess gener, till skillnad från den aktiva X -kromosomen. Detta beror på tystningen av Xi med repressivt heterokromatin , som komprimerar Xi -DNA: t och förhindrar uttryck av de flesta gener.
Jämfört med Xa har Xi höga nivåer av DNA-metylering , låga nivåer av histonacetylering , låga nivåer av histon H3 lysin-4 metylering och höga nivåer av histon H3 lysin-9 metylering och H3 lysin-27 metyleringsmärke som placeras av PRC2 -komplexet rekryterat av Xist , som alla är associerade med genavstängning. PRC2 reglerar kromatinkomprimering och kromatinombyggnad i flera processer inklusive DNA -skadesvar. Dessutom finns en histonvariant som kallas macroH2A ( H2AFY ) exklusivt på nukleosomer längs Xi.
Barr kroppar
DNA förpackat i heterokromatin, såsom Xi, är mer kondenserat än DNA som är förpackat i eukromatin , såsom Xa. Det inaktiva X bildar en diskret kropp i kärnan som kallas en Barr -kropp . Barr -kroppen är i allmänhet belägen i kärnans periferi , replikerar sent i cellcykeln och innehåller, eftersom den innehåller Xi, heterokromatinmodifieringar och Xist -RNA.
Uttryckta gener på den inaktiva X -kromosomen
En bråkdel av generna längs X -kromosomen slipper inaktivering på Xi. Xist -genen uttrycks vid höga nivåer på Xi och uttrycks inte på Xa. Många andra gener slipper inaktivering; vissa uttrycks lika från Xa och Xi, och andra, medan de uttrycks från båda kromosomerna, uttrycks fortfarande övervägande från Xa. Upp till en fjärdedel av generna på den mänskliga Xi kan fly. Studier på mus tyder på att i en given celltyp undviker 3 till 15% av generna inaktivering, och att undanröjande genidentitet varierar mellan vävnader.
Många av de gener som slipper inaktivering finns närvarande längs regioner i X -kromosomen som, till skillnad från majoriteten av X -kromosomen, innehåller gener som också finns på Y -kromosomen . Dessa regioner kallas pseudoautosomala regioner, eftersom individer av båda könen kommer att få två kopior av varje gen i dessa regioner (som en autosom), till skillnad från majoriteten av gener längs könskromosomerna. Eftersom individer av båda könen kommer att få två kopior av varje gen i en pseudoautosomal region , behövs ingen doskompensation för kvinnor, så det antas att dessa DNA-områden har utvecklat mekanismer för att undkomma X-inaktivering. Generna för pseudoautosomala regioner i Xi har inte de typiska modifieringarna av Xi och har lite Xist RNA bundet.
Förekomsten av gener längs inaktiva X som inte tystas förklarar defekterna hos människor med onormalt många X -kromosomer, såsom Turners syndrom (X0) eller Klinefelters syndrom (XXY). Teoretiskt sett bör X-inaktivering eliminera skillnaderna i gendosering mellan drabbade individer och individer med ett normalt kromosomkomplement. Hos drabbade individer är X-inaktivering emellertid ofullständig och dosen av dessa icke-tysta gener kommer att skilja sig åt när de slipper X-inaktivering, liknande en autosomal aneuploidi .
De exakta mekanismerna som styr flykt från X-inaktivering är inte kända, men tysta och flyktområden har visat sig ha distinkta kromatinmärken. Det har föreslagits att flykt från X-inaktivering kan förmedlas genom uttryck av långt icke-kodande RNA (lncRNA) inom de rymande kromosomala domänerna.
Användningsområden i experimentell biologi
Stanley Michael Gartler använde X-kromosominaktivering för att demonstrera det klonala ursprunget för cancer. Undersökning av normala vävnader och tumörer från honor heterozygota för isoenzymer av den könskopplade G6PD- genen visade att tumörceller från sådana individer uttrycker endast en form av G6PD, medan normala vävnader består av en nästan lika blandning av celler som uttrycker de två olika fenotyperna. Detta mönster antyder att en enda cell, och inte en befolkning, växer till en cancer. Detta mönster har dock visat sig vara felaktigt för många cancertyper, vilket tyder på att vissa cancerformer kan ha polyklonala ursprung.
Dessutom mäts metylering (inaktivering) status för den polymorfa humana androgenreceptorn (HUMARA) som finns på X-kromosom anses vara den mest exakta metoden för att bedöma klonalitet i kvinnliga cancerbiopsier. Ett stort antal tumörer testades med denna metod, vissa, såsom njurcellscancer, hittades monoklonala medan andra (t.ex. mesoteliom) rapporterades polyklonala.
Forskare har också undersökt att använda X-kromosominaktivering för att tysta aktiviteten hos autosomala kromosomer. Till exempel Jiang et al. infogade en kopia av Xist -genen i en kopia av kromosom 21 i stamceller härrörande från en individ med trisomi 21 ( Downs syndrom ). Den infogade Xist-genen inducerar Barr-kroppsbildning, utlöser stabila heterokromatinmodifieringar och tysta de flesta generna på den extra kopian av kromosom 21. I dessa modifierade stamceller verkar den Xist-medierade genavstängningen vända några av de defekter som är förknippade med Down syndrom.
Historia
År 1959 visade Susumu Ohno att däggdjurs två X -kromosomer var olika: en verkade likna autosomerna ; den andra var kondenserad och heterokromatisk. Detta fynd föreslog, oberoende av två grupper av utredare, att en av X -kromosomerna genomgick inaktivering.
I 1961, Mary Lyon föreslog slumpmässig inaktivering av en kvinnlig X-kromosom för att förklara den fläckiga fenotypen av honmöss heterozygot för pälsfärgen gener . Lyonhypotesen redogjorde också för fynden att en kopia av X -kromosomen i kvinnliga celler var mycket kondenserad och att möss med bara en kopia av X -kromosomen utvecklades som ofruktbara honor. Detta föreslog för Ernest Beutler att studera heterozygota honor för glukos-6-fosfatdehydrogenasbrist (G6PD), att det fanns två röda cellpopulationer av erytrocyter i sådana heterozygoter: bristfälliga celler och normala celler, beroende på om den inaktiverade X-kromosomen (i kärnan i den röda cellens prekursorcell) innehåller den normala eller defekta G6PD -allelen.
Se även
- Sexbestämningssystem
- Doskompensation
- Barr kropp
- Heterokromatin
- Epigenetik
- Snedställd X-inaktivering
- Utvecklingsstörningar som antas vara relaterade till X-inaktivering:
Referenser
Vidare läsning
- Huynh KD, Lee JT (maj 2005). "X-kromosominaktivering: en hypotes som förbinder ontogeni och fylogeni". Naturrecensioner. Genetik . 6 (5): 410–8. doi : 10.1038/nrg1604 . PMID 15818384 . S2CID 19245310 .
- Goto T, Monk M (juni 1998). "Reglering av inaktivering av X-kromosom vid utveckling hos möss och människor" (översiktsartikel) . Mikrobiologi och molekylärbiologi recensioner . 62 (2): 362–78. doi : 10.1128/MMBR.62.2.362-378.1998 . PMC 98919 . PMID 9618446 .
- Lyon MF (december 2003). "Lyon och LINE -hypotesen". Seminarier i cell- och utvecklingsbiologi (granskningsartikel). 14 (6): 313–8. doi : 10.1016/j.semcdb.2003.09.015 . PMID 15015738 .
- Ng K, Pullirsch D, Leeb M, Wutz A (januari 2007). "Xist och ordningen för tystnad" (granskningsartikel) . EMBO -rapporter . 8 (1): 34–9. doi : 10.1038/sj.embor.7400871 . PMC 1796754 . PMID 17203100 .
- Cerase A, Pintacuda G, Tattermusch A, Avner P (augusti 2015). "Xist lokalisering och funktion: nya insikter från flera nivåer" . Genombiologi . 16 : 166. doi : 10.1186/s13059-015-0733-y . PMC 4539689 . PMID 26282267 .
externa länkar
-
 Media relaterade till inaktivering av X -kromosom på Wikimedia Commons
Media relaterade till inaktivering av X -kromosom på Wikimedia Commons - Kruszelnicki K (2004-02-11). "Hybrid Auto-Immune Women 3" . ABC Science .

