Spermatogenes - Spermatogenesis
| Spermatogenes | |
|---|---|
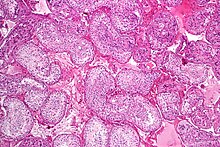
 Seminiferous tubule med mogna spermier. H & E -fläck .
| |
 En mogen människa Spermatozoon
| |
| Identifierare | |
| Maska | D013091 |
| Anatomisk terminologi | |
Spermatogenesen är den process genom vilken haploida spermatozoa utvecklas från könsceller i sädeskanalerna i testikel . Denna process börjar med den mitotiska uppdelningen av stamcellerna som ligger nära tubulernas basalmembran. Dessa celler kallas spermatogoniala stamceller . Den mitotiska uppdelningen av dessa producerar två typer av celler. Typ A -celler fyller på stamcellerna och typ B -celler differentieras till primära spermatocyter . Den primära spermatocyten delar meiotiskt ( Meios I) i två sekundära spermatocyter; varje sekundär spermatocyt delar sig i två lika haploida spermatider av Meiosis II. Spermatiderna omvandlas till spermier (spermier) genom spermiogenesprocessen . Dessa utvecklas till mogna spermier, även kända som spermier . Således ger den primära spermatocyten upphov till två celler, de sekundära spermatocyterna, och de två sekundära spermatocyterna genom deras indelning producerar fyra spermier och fyra haploida celler.
Spermatozoer är de mogna manliga könscellerna i många sexuellt reproducerande organismer. Således är spermatogenes den manliga versionen av gametogenes , av vilken den kvinnliga ekvivalenten är oogenes . Hos däggdjur förekommer det i de seminiferösa tubuli hos manliga testiklar på ett stegvis sätt. Spermatogenes är mycket beroende av optimala förhållanden för att processen ska kunna ske korrekt och är avgörande för sexuell reproduktion . DNA -metylering och histonmodifiering har varit inblandade i regleringen av denna process. Det börjar vid puberteten och fortsätter vanligtvis oavbrutet fram till döden, även om en liten minskning kan ses i mängden producerad spermier med ökad ålder (se Manlig infertilitet ).
Spermatogenes börjar i den nedre delen av seminiferous rör och gradvis går cellerna djupare in i rören och rör sig längs det tills mogna spermatozoer når lumen, där mogna spermatozoer deponeras. Delningen sker asynkront; om röret skärs i tvärgående kan man observera olika mognadstillstånd. En grupp celler med olika mognadstillstånd som genereras samtidigt kallas en spermatogen våg.
Ändamål
Spermatogenes producerar mogna manliga könsceller, vanligen kallade spermier men mer specifikt kända som spermier , som kan befrukta den motsvarande kvinnliga könscellen, äggcellen , under befruktningen för att producera en encellad individ som kallas en zygot . Detta är hörnstenen i sexuell reproduktion och involverar att de två könscellerna båda bidrar till hälften av den normala uppsättningen kromosomer ( haploid ) för att resultera i en kromosomalt normal ( diploid ) zygot.
För att bevara antalet kromosomer i avkomman - som skiljer sig åt mellan arter - måste en av varje könscykel ha hälften av det vanliga antalet kromosomer som finns i andra kroppsceller. Annars kommer avkomman att ha två gånger det normala antalet kromosomer, och allvarliga avvikelser kan uppstå. Hos människor resulterar kromosomavvikelser som orsakas av felaktig spermatogenes i medfödda defekter och onormala fosterskador ( Downs syndrom , Klinefelters syndrom ) och i de flesta fall spontan abort av det utvecklande fostret.
Plats hos människor
Spermatogenes sker inom flera strukturer i det manliga reproduktiva systemet . De inledande stadierna inträffar inom testiklarna och går vidare till epididymis där de utvecklande könscellerna mognar och lagras fram till utlösning . De sädeskanalerna av testiklarna är utgångspunkten för den process, där spermatogoniala stamceller angränsande till den inre tubuli väggen klyftan i en centripetal riktning-början vid väggarna och fortsätter in i den innersta delen, eller lumen -att producera omogna spermier. Mognad sker i epididymis. Platsen [Testes/Scrotum] är särskilt viktig eftersom processen med spermatogenes kräver en lägre temperatur för att producera livskraftig sperma, specifikt 1 ° -8 ° C lägre än normal kroppstemperatur på 37 ° C (98,6 ° F). Kliniskt orsakar små fluktuationer i temperatur, till exempel från ett atletiskt stödband, ingen försämring av spermiens livskraft eller antal.
Varaktighet
För människor uppskattas hela processen med spermatogenes på olika sätt ta 74 dagar (enligt tritiummärkta biopsier) och cirka 120 dagar (enligt DNA-klockmätningar). Inklusive transport på kanalsystem tar det 3 månader. Testes producerar 200 till 300 miljoner spermier dagligen. Men bara ungefär hälften eller 100 miljoner av dessa blir livskraftiga spermier.
Etapper
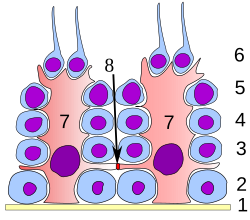
Hela processen med spermatogenes kan delas upp i flera olika stadier, var och en motsvarar en viss celltyp hos människor. I följande tabell gäller ploidi, kopiantal och kromosom/kromatidräkning för en cell, i allmänhet före DNA -syntes och delning (i G1 om tillämpligt). Den primära spermatocyten stoppas efter DNA -syntes och före delning.
| Celltyp | ploidi /kromosomer hos människor | DNA -kopieringsnummer/ kromatider hos människa | Processen angiven av cell |
| spermatogonium (typerna Ad, Ap och B) | diploid (2N) / 46 | 2C / 46 | spermatocytogenes ( mitos ) |
| primär spermatocyt | diploid (2N) / 46 | 4C / 2x46 | spermatidogenes (meios I) |
| två sekundära spermatocyter | haploid (N) / 23 | 2C / 2x23 | spermatidogenes (meios II) |
| fyra spermatider | haploid (N) / 23 | C / 23 | spermiogenes |
| fyra funktionella spermatozoider | haploid (N) / 23 | C / 23 | spermiering |
Spermatocytogenes
Spermatocytogenes är den manliga formen av gametocytogenes och resulterar i bildandet av spermatocyter som har hälften av det normala komplementet av genetiskt material. Vid spermatocytogenes delar en diploid spermatogonium , som ligger i basfacket i de seminiferösa tubulerna, mitotiskt och producerar två diploida mellanliggande celler som kallas primära spermatocyter . Varje primär spermatocyt rör sig sedan in i adluminalfacket i seminiferous tubuli och duplicerar dess DNA och genomgår därefter meios I för att producera två haploida sekundära spermatocyter , som senare kommer att dela sig upp igen i haploida spermatider . Denna uppdelning implicerar källor till genetisk variation, såsom slumpmässig inkludering av antingen föräldrakromosomer och kromosomal crossover som ökar gametens genetiska variabilitet. Den DNA-skada svaret (DDR) maskiner spelar en viktig roll i spermatogenes. Proteinet FMRP binder till meiotiska kromosomer och reglerar dynamiken i DDR -maskineriet under spermatogenes. FMRP verkar vara nödvändigt för reparation av DNA -skador .
Varje celldelning från ett spermatogonium till en spermatid är ofullständig; cellerna förblir sammankopplade med varandra genom broar av cytoplasma för att möjliggöra synkron utveckling. Inte alla spermatogonier delar sig för att producera spermatocyter; annars skulle tillgången på spermatogoni ta slut. Istället delar spermatogoniala stamceller mitotiskt för att producera kopior av sig själva, vilket säkerställer en konstant tillförsel av spermatogoni till bränsle spermatogenes.
Spermatidogenes
Spermatidogenes är skapandet av spermatider från sekundära spermatocyter. Sekundära spermatocyter som producerats tidigare går snabbt in i meios II och delar sig för att producera haploida spermatider. Kortfattningen av detta stadium innebär att sekundära spermatocyter sällan ses i histologiska studier.
Spermiogenes
Under spermiogenes börjar spermatiderna bilda en svans genom att odla mikrotubuli på en av centriolerna, som förvandlas till baskropp. Dessa mikrotubuli bildar ett axonem . Senare ändras centriolen i processen med centrosomreduktion . Den främre delen av svansen (kallad mittstycke) tjocknar eftersom mitokondrier är anordnade runt axonemet för att säkerställa energiförsörjning. Spermatid DNA genomgår också förpackningar, blir mycket kondenseras. DNA: t förpackas först med specifika nukleära basproteiner, som därefter ersätts med protaminer under spermatidförlängning. Det resulterande tätt packade kromatinet är transkriptionellt inaktivt. Den Golgiapparaten omger nu kondenserad kärna, bli den akrosomen .
Mognad sker sedan under påverkan av testosteron, vilket tar bort den återstående onödiga cytoplasman och organellerna . Överskottet av cytoplasma, känt som restkroppar , fagocyteras av omgivande Sertoli -celler i testiklarna . De resulterande spermierna är nu mogna men saknar rörlighet. De mogna spermierna släpps ut från de skyddande Sertoli -cellerna i lumen i den seminiferösa tubuli i en process som kallas spermiering .
De icke-rörliga spermierna transporteras till epididymis i testikelvätska som utsöndras av Sertoli-cellerna med hjälp av peristaltisk kontraktion . Medan i epididymis får spermierna rörlighet och blir befruktbara. Transport av de mogna spermierna genom resten av det manliga reproduktiva systemet uppnås dock genom muskelsammandragning snarare än spermierna nyligen förvärvade rörlighet.
Sertoli -cellers roll
Vid alla differentieringsstadier är spermatogena celler i nära kontakt med Sertoli -celler som anses ge strukturellt och metaboliskt stöd till de spermier som utvecklas. En enda Sertoli -cell sträcker sig från basalmembranet till lumen i tuben, även om de cytoplasmatiska processerna är svåra att skilja på den ljusmikroskopiska nivån.
Sertoli -celler tjänar ett antal funktioner under spermatogenes, de stöder utvecklande könsceller på följande sätt:
- Behåll miljön som är nödvändig för utveckling och mognad, via blod-testikelbarriären
- Sekreta ämnen som initierar meios
- Sekret stödjande testikelvätska
- Sekret androgenbindande protein (ABP), som koncentrerar testosteron i närheten av de utvecklande könscellerna
- Testosteron behövs i mycket stora mängder för underhåll av reproduktionsvägarna, och ABP tillåter en mycket högre fertilitet
- Sekreta hormoner som påverkar hypofysens kontroll av spermatogenes, särskilt polypeptidhormonet, inhibin
- Fagocytos kvarvarande cytoplasma kvar från spermiogenes
- Utsöndring av anti-Müllerian hormon orsakar försämring av Müllerian kanalen
- Skydda spermatider från hanens immunsystem, via blod-testikelbarriären
- Bidra till spermatogoniala stamceller nisch
De intercellulära vidhäftningsmolekylerna ICAM-1 och lösliga ICAM-1 har antagonistiska effekter på de snäva korsningarna som bildar blod-testisbarriären. ICAM-2- molekyler reglerar spermatidhäftning på den apikala sidan av barriären (mot lumen ).
Påverkande faktorer
Spermatogenesprocessen är mycket känslig för fluktuationer i omgivningen, särskilt hormoner och temperatur. Testosteron krävs i stora lokala koncentrationer för att upprätthålla processen, som uppnås via bindning av testosteron av androgenbindande protein som finns i seminiferous tubuli. Testosteron produceras av interstitiella celler, även kända som Leydig -celler , som ligger intill seminiferous tubuli.
Seminiferous epitel är känsligt för förhöjd temperatur hos människor och vissa andra arter, och kommer att påverkas negativt av temperaturer så höga som normal kroppstemperatur. Följaktligen är testiklarna placerade utanför kroppen i en hudpåse som kallas pungen . Den optimala temperaturen hålls vid 2 ° C ( man ) (8 ° C mus ) under kroppstemperaturen. Detta uppnås genom reglering av blodflödet och positionering mot och bort från kroppens värme av kremastermuskeln och dartos glatta muskler i pungen.
En viktig mekanism är ett termiskt utbyte mellan testikelartär- och venösa blodströmmar. Specialiserade anatomiska arrangemang består av två zoner av spiral längs den inre spermatiska artären. Detta anatomiska arrangemang förlänger kontakttiden och det termiska utbytet mellan testikelartär- och venösa blodströmmar och kan delvis förklara temperaturgradienten mellan aorta- och testikelartärblod rapporterat hos hundar och baggar. Dessutom, minskning av pulstrycket, som inträffar i den proximala en tredjedel av den lindade längden av den inre spermatiska artären. Dessutom minskar aktiviteten hos spermatogent rekombinas, och detta är tänkt att vara en viktig faktor för degenerering av testiklar.
Kostbrister (som vitamin B, E och A), anabola steroider , metaller (kadmium och bly), röntgenexponering, dioxin , alkohol och infektionssjukdomar kommer också att påverka hastigheten på spermatogenes negativt. Dessutom är den manliga könslinjen mottaglig för DNA -skada orsakad av oxidativ stress, och denna skada har sannolikt en betydande inverkan på befruktning och graviditet. Exponering för bekämpningsmedel påverkar också spermatogenes.
Hormonell kontroll
Hormonell kontroll av spermatogenes varierar mellan arter. Hos människor är mekanismen inte helt förstådd; emellertid är det känt att initiering av spermatogenes sker vid puberteten på grund av samspelet mellan hypothalamus , hypofysen och Leydig -celler . Om hypofysen tas bort kan spermatogenes fortfarande initieras av follikelstimulerande hormon (FSH) och testosteron . I motsats till FSH verkar luteiniserande hormon (LH) ha liten roll i spermatogenes utanför att inducera gonadal testosteronproduktion.
FSH stimulerar både produktionen av androgenbindande protein (ABP) av Sertoli-celler och bildandet av blod-testisbarriären . ABP är viktigt för att koncentrera testosteron i tillräckligt höga nivåer för att initiera och upprätthålla spermatogenes. Intratestikulära testosteronnivåer är 20–100 eller 50–200 gånger högre än koncentrationen som finns i blod, även om det finns variation över ett 5- till 10-faldigt intervall bland friska män. FSH kan initiera sekvestrering av testosteron i testiklarna, men en gång utvecklat krävs endast testosteron för att upprätthålla spermatogenes. Att öka nivåerna av FSH kommer dock att öka produktionen av spermier genom att förhindra apoptos av typ A spermatogoni . Hormonet inhibin verkar för att minska nivåerna av FSH. Studier från gnagarmodeller tyder på att gonadotropiner (både LH och FSH) stödjer processen med spermatogenes genom att undertrycka de proapoptotiska signalerna och därför främja spermatogen cellöverlevnad.
Sertoli -cellerna själva förmedlar delar av spermatogenes genom hormonproduktion. De kan producera hormonerna estradiol och inhibin. Leydig -cellerna kan också producera östradiol utöver deras huvudprodukt testosteron. Östrogen har visat sig vara avgörande för spermatogenes hos djur. En man med östrogenokänslighetssyndrom (ett defekt ERα ) hittades dock producera spermier med normalt antal spermier , om än onormalt låg spermier . om han var steril eller inte är oklart. Nivåer av östrogen som är för höga kan vara skadliga för spermatogenes på grund av undertryckande av gonadotropinsekretion och i förlängningen intratestikulär testosteronproduktion. Prolaktin verkar också vara viktigt för spermatogenes.
Se även
Referenser
Vidare läsning
- Okano, Tsukasa; Ishiniwa, Hiroko; Onuma, Manabu; Shindo, Junji; Yokohata, Yasushi; Tamaoki, Masanori (23 mars 2016). "Effekter av miljöstrålning på testiklar och spermatogenes hos vilda stora japanska fältmöss (Apodemus speciosus) från Fukushima" . Vetenskapliga rapporter . 6 (1): 23601. Bibcode : 2016NatSR ... 623601O . doi : 10.1038/srep23601 . PMC 4804236 . PMID 27005329 .
- Johnson, L .; Blanchard, TL; Varner, DD; Scrutchfield, WL (november 1997). "Faktorer som påverkar spermatogenes i hingsten". Teriogenologi . 48 (7): 1199–1216. doi : 10.1016/s0093-691x (97) 00353-1 . PMID 16728209 .
- Bardin, CW (1991). "Hypofys-testikelaxel". I Yen, SSC; Jaffee, RB (red.). Reproduktiv endokrinologi (3: e upplagan). Philadelphia: WB Saunders. ISBN 0721632068.
- Chambers, Christopher V .; Shafer, Mary-Ann; Adger, Hoover; Ohm-Smith, Marilyn; Millstein, Susan G .; Irwin, Charles E .; Schachter, Julius; Sweet, Richard (februari 1987). "Mikroflora av urinröret hos ungdomar: Förhållanden till sexuell aktivitet och nongonokock uretrit". Journal of Pediatrics . 110 (2): 314–321. doi : 10.1016/s0022-3476 (87) 80180-4 . PMID 3100755 .
- Czyba, JC; Girod, C. (1980). "Utveckling av normala testiklar". I Hafez, ESE (red.). Nedstigande och Cryptorchid Testis . Haag: Martinus Nijhoff. ISBN 9024723337.
- Whitmore, Willet F .; Karsh, Lawrence; Gittes, Ruben F. (oktober 1985). "Germinalepitelets roll och spermatogenes i den privilegierade överlevnaden av intratestikulära transplantat". Journal of Urology . 134 (4): 782–786. doi : 10.1016/s0022-5347 (17) 47438-6 . PMID 2863395 .