Presenilin - Presenilin
| Presenilin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
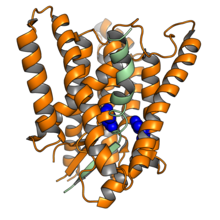
Kryo-elektronmikroskopistruktur av humant presenilin-1 (orange) i komplex med ett fragment av ett av dess proteinsubstrat, Notch (grönt). De två katalytiska platserna visas i blått. Renderad från PDB : 6IDF .
| |||||||||
| Identifierare | |||||||||
| Symbol | Presenilin | ||||||||
| Pfam | PF01080 | ||||||||
| Pfam -klan | CL0130 | ||||||||
| InterPro | IPR001108 | ||||||||
| MEROPS | A22 | ||||||||
| TCDB | 1.A.54 | ||||||||
| OPM superfamilj | 244 | ||||||||
| OPM -protein | 4hyg | ||||||||
| |||||||||
| presenilin 1 (Alzheimers sjukdom 3) | |||||||
|---|---|---|---|---|---|---|---|
| Identifierare | |||||||
| Symbol | PSEN1 | ||||||
| Alt. symboler | AD3 | ||||||
| NCBI -gen | 5663 | ||||||
| HGNC | 9508 | ||||||
| OMIM | 104311 | ||||||
| RefSeq | NM_000021 | ||||||
| UniProt | P49768 | ||||||
| Övrig data | |||||||
| EG -nummer | 3.4.23.- | ||||||
| Ställe | Chr. 14 q24.3 | ||||||
| |||||||
| presenilin 2 (Alzheimers sjukdom 4) | |||||||
|---|---|---|---|---|---|---|---|
| Identifierare | |||||||
| Symbol | PSEN2 | ||||||
| Alt. symboler | AD4 | ||||||
| NCBI -gen | 5664 | ||||||
| HGNC | 9509 | ||||||
| OMIM | 600759 | ||||||
| RefSeq | NM_000447 | ||||||
| UniProt | P49810 | ||||||
| Övrig data | |||||||
| EG -nummer | 3.4.23.- | ||||||
| Ställe | Chr. 1 q31-q42 | ||||||
| |||||||
Preseniliner är en familj av besläktade multipasstransmembranproteiner som utgör de katalytiska underenheter av gamma-sekretas intramembrane proteas proteinkomplex . De identifierades först på skärmar för mutationer som orsakade tidiga former av familjär Alzheimers sjukdom av Peter St George-Hyslop vid Center for Research in Neurodegenerative Diseases vid University of Toronto , och nu också vid University of Cambridge . Ryggradsdjur har två presenilin gener , som kallas PSEN1 (belägen på kromosom 14 hos människa) som kodar för presenilin 1 (PS-1) och Psen2 (på kromosom 1 hos människa) som kodar för presenilin 2 (PS-2). Båda generna visar bevarande mellan arter, med liten skillnad mellan råtta och humana preseniliner. Nematodmasken C. elegans har två gener som liknar presenilinerna och verkar fungera lika, sel-12 och hop-1 .
Preseniliner genomgår klyvning i en alfa-spiralformad region i en av de cytoplasmatiska öglorna för att producera en stor N-terminal och ett mindre C-terminal fragment som tillsammans utgör en del av det funktionella proteinet. Klyvning av presenilin 1 kan förhindras genom en mutation som orsakar förlust av exon 9 och resulterar i förlust av funktion. Preseniliner spelar en nyckelroll i moduleringen av intracellulärt Ca 2+ involverat i presynaptisk neurotransmittorfrisättning och långsiktig potentieringsinduktion .
Strukturera
Preseniliner är transmembranproteiner med nio alfa -spiraler . Strukturer har lösts av det sammansatta gammasekretaskomplexet genom kryo-elektronmikroskopi , vilket visar signifikant konformationsflexibilitet i strukturen av presenilin-subenheten i komplexet som svar på ligand eller inhibitorbindning. Preseniliner genomgår autokatalytisk proteolytisk bearbetning efter uttryck, klyvning av en cytoplasmatisk slingregion mellan den sjätte och sjunde spiralen för att producera en stor N-terminal och ett mindre C-terminal fragment. De två fragmenten förblir i kontakt med varandra i det mogna proteinet. De två katalytiska aspartat -aktiva rester som krävs för aspartylproteasaktivitet är belägna i den sjätte och sjunde helixen.
Strukturen och membrantopologin för preseniliner var ursprungligen kontroversiell när de först upptäcktes. Den PSEN1 genen förutsades innehålla tio transmembrandomäner; modeller enades om den förväntade topologin för det N-terminala fragmentet, men strukturen för det C-terminala fragmentet bestreds. En studie 2006 föreslog en nio-pass transmembrantopologi med klyvning och montering in i gamma-sekretas -komplexet före insättning i plasmamembranet . Lösnings-NMR- studier av det C-terminala fragmentet visade tre spiraler som sannolikt kommer att passera membranet, medan röntgenkristallografistudier av en archaeal homolog, samt kryo-elektronmikroskopi av det humana gamma-sekretaskomplexet, indikerar nio transmembranhelixer.
Fungera
Katalytisk
Preseniliner är den katalytiska komponenten i gamma-sekretas- intramembranproteaset , ett proteinkomplex med fyra medlemmar bestående av presenilin, nikastrin , APH-1 och PEN-2 . Den har ett mycket brett spektrum av substrat för sin proteolytiska aktivitet . Dess substrat är hydrofoba enkelpassade transmembranspiraler med relativt små extracellulära regioner. Dessa substrat uppstår efter ectodomain shedding . Väl över 100 olika integrerade membranproteiner bearbetas av gammasekretas. De bäst karaktäriserade gamma-sekretas-substraten är Notch-receptorn och amyloidprekursorproteinet (APP). Presenilins roll i Notch -signalvägen är viktig i utvecklingen; möss som har PS1 -genen utslagna dör tidigt i utvecklingen av utvecklingsavvikelser som liknar dem som upptäcks när hacket störs. Hos villkorade knockout-möss där presenilin först inaktiveras efter tidig utveckling, finns det bevis på att preseniliner i deras roll som gammasekretaskomponenter är viktiga för neurons överlevnad under åldrandet.
Det finns subtila och artspecifika variationer i rollerna av presenilin-1 och presenilin-2 i sammansatta gamma-sekretaskomplex, med många studier som tyder på en primär roll för presenilin-1. Hos människor skiljer sig de två presenilinerna åt i subcellulär lokalisering , och kan också vara celltyp och vävnadsspecifika .
Icke-katalytisk
Preseniliner har också ytterligare icke-katalytiska roller i andra cellulära signalprocesser, inklusive kalciumhomeostas , lysosomal försurning, autofagi och proteinhandel . Proteinernas roll i kalciumhomeostas i neuroner har varit föremål för intresse. Den genetiska inaktiveringen av preseniliner i hippocampus synapser har visat att detta påverkar selektivt den långsiktiga potentiering som orsakas av theta med inaktiveringen i presynaps men inte postsynapsen som försämrar kortsiktig plasticitet och synaptisk förenkling. Frisättningen av glutamat reducerades också i presynaptiska terminaler genom processer som involverar modulering av intracellulär Ca2 + -frisättning. Detta har föreslagits att "representera en allmän konvergent mekanism som leder till neurodegeneration".
Homologer har identifierats och kännetecknas av olika eukaryota organismer, inklusive modellorganismer Drosophila melanogaster och Caenorhabditis elegans , växter som Arabidopsis thaliana och Physcomitrella patens och slemformen Dictyostelium discoideum . I dessa funktioner tros preseniliner spela en roll som ställningsproteiner , som sannolikt anses vara proteinfamiljens förfäder.
Uttryck och distribution
Båda mänskliga preseniliner har ett utbrett uttryck i hjärnan . De två proteinerna skiljer sig åt i subcellulär lokalisering , med PS1 uttryckt bredare och närvarande vid cellmembranet , medan PS2 främst finns i sena endosomer och lysosomer .
Förening med Alzheimers sjukdom
De flesta fall av Alzheimers sjukdom är inte ärftliga. Det finns dock en liten delmängd av fall som har en tidigare ålder och har ett starkt genetiskt element. Hos patienter som lider av Alzheimers sjukdom ( autosomalt dominant ärftlig), mutationer i presenilin -proteinerna (PSEN1; Psen2) eller amyloidprekursorprotein kan (APP) hittas. Majoriteten av dessa fall bär mutanta presenilingener. En viktig del av sjukdomsprocessen vid Alzheimers sjukdom är ackumulering av Amyloid beta (Aβ) protein. För att bilda Aβ måste APP skäras av två enzymer , betasekretaser och gammasekretas . Presenilin är delkomponenten i gammasekretas som är ansvarig för skärning av APP.
Gammasekretas kan skära APP vid flera punkter inom ett litet område av proteinet, vilket resulterar i Aβ av olika längder. Längderna associerade med Alzheimers sjukdom är 40 och 42 aminosyror långa. Aβ 42 är mer sannolikt att aggregera för att bilda plack i hjärnan än Aβ 40. Presenilin -mutationer leder till en ökning av förhållandet mellan Aβ 42 som produceras jämfört med Aβ 40, även om den totala mängden producerad Aβ förblir konstant. Detta kan uppstå genom olika effekter av mutationerna på gammasekretas.
Upptäckt
Generna för presenilinerna upptäcktes 1995 genom kopplingsstudier med mutationer som förekommer i familjära Alzheimers sjukdomar . Ungefär samtidigt identifierades presenilinhomologen i Caenorhabditis elegans , sel-12 , oberoende som en bidragsgivare till Notch-signalering . Även om funktionen hos proteinprodukterna för dessa gener inte var omedelbar uppenbar, blev det klart från efterföljande arbete att mutationerna var associerade med högre andel Aβ 42 jämfört med den mindre amyloidogena Aβ40. Presenilins roll som den katalytiska komponenten i gammasekretasproteinkomplexet fastställdes i början av 2000 -talet.
Referenser
externa länkar
- Den Merops online-databas för peptidaser och deras hämmare: presenilin 1 A22.001 , Presenilin 2 A22.002
- Dominant ärftligt Alzheimer -nätverk (DIAN)
- Dominant ärftligt Alzheimer -nätverk (DIAN) Utökat register
- Preseniliner vid US National Library of Medicine Medical Subject Headings (MeSH)
