Resistens-nodulering-celldelning superfamilj - Resistance-nodulation-cell division superfamily
| RND permeas superfamiljen | |
|---|---|

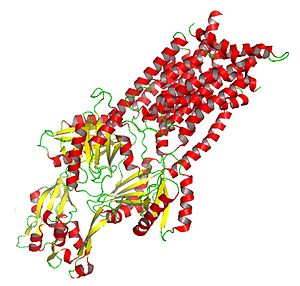
Kristalliserad AcrB : Ett HAE-RND-underklassprotein involverat i läkemedels- och amfifiliskt utflöde
| |
| Identifierare | |
| Symbol | RND_Permease |
| Pfam- klan | CL0322 |
| TCDB | 2.A.6 |
| OPM-superfamilj | 16 |
| OPM-protein | 2gif |
Resistance-nodulation-division ( RND ) familjetransportörer är en kategori av bakteriella utflödespumpar , särskilt identifierade i gramnegativa bakterier och lokaliserade i det cytoplasmiska membranet, som aktivt transporterar substrat. RND- superfamiljen omfattar sju familjer: tungmetallutflödet (HME), hydrofob / amfifilutflödet-1 (gramnegativa bakterier), noduleringsfaktor-exportörfamiljen (NFE), SecDF-proteinutsöndringsproteinfamiljen, hydrofoben / amfifil efflux-2 familjen, den eukaryota sterol homeostas familjen, och den hydrofoba / amfifil efflux-3 familjen. Dessa RND-system är inblandade i bibehållande av cellens homeostas , avlägsnande av toxiska föreningar och export av virulensdeterminanter . De har ett brett substratspektrum och kan leda till minskad aktivitet hos orelaterade läkemedelsklasser om de överuttrycks. De första rapporterna om läkemedelsresistenta bakterieinfektioner rapporterades på 1940-talet efter den första massproduktionen av antibiotika . De flesta av RND-superfamiljetransportsystemen är tillverkade av stora polypeptidkedjor. RND-proteiner finns främst i gramnegativa bakterier men kan också hittas i gram-positiva bakterier , archaea och eukaryoter .
Fungera
RND-proteinet dikterar substratet för de färdiga transportsystemen inklusive: metalljoner , xenobiotika eller läkemedel . Transport av hydrofoba och amfifila föreningar utförs av underfamiljen HAE-RND. Medan utflödet av tungmetaller förformas HME-RND.
Mekanism och struktur
RND-proteiner är stora och kan inkludera mer än 1000 aminosyrarester . De är i allmänhet sammansatt av två homologa subenheter (antyder de uppstod som ett resultat av en intragen tandemduplicering händelse som inträffat i det primordial systemet före divergens av familjemedlemmarna) var och en innehållande en periplasmisk slinga intill 12 transmembrana helixar . Av de tolv spiralerna finns en enda transmembranyckel (TMS) vid N-terminalen följt av en stor extracytoplasmatisk domän, sedan ytterligare sex TMS, en andra stor extracytoplasmatisk domän och fem slutliga C-terminala TMS. TM4 styr specificiteten för ett visst substrat i ett givet RND-protein. Därför kan TM4 vara en indikator för RND-specificitet utan uttrycklig kunskap om resten av proteinet.
RND-pumpar är den cytoplasmatiska uppehållsdelen av ett komplett trepartskomplex (fig. 1) som sprider sig över det yttre membranet och det inre membranet hos gramnegativa bakterier, även kallat CBA-utflödessystemet. RND-proteinet associeras med en yttre membrankanal och ett periplasmiskt adapterprotein, och associeringen av alla tre proteinerna gör det möjligt för systemet att exportera substrat till det externa mediet, vilket ger en stor fördel för bakterierna .
CusA-proteinet, en HME-RND-medlemstransportör, kunde kristalliseras och gav värdefull strukturell information om HME-RND-pumpar. CusA existerar som en homotrimer där varje enhet består av 12 transmembrana spiraler (TM1-TM12). Den periplasmiska domänen består av två spiraler, TM2 och TM8. Dessutom består den periplasmatiska domänen av sex underdomäner, PN1, PN2, PC1, PC2, DN, DC, som bildar en central por och en dockningsdomän. Den centrala poren bildas av PN1, PN2, PC1, PC2 och stabiliserar tillsammans den trimera organisationen av homotrimeren .
Metalljonutflöde (HME-RND)
HME-RND-familjen fungerar som den centrala proteinpumpen i metalljonutflöde som drivs av en protonsubstrat antiport . Familjen inkluderar pumpar som exporterar monovalenta metaller - Cus-systemet och pumpar som exporterar tvåvärda metaller - Czc-systemet.
Tungmetallresistens av RND-familjen upptäcktes först i R. metallidurans genom CzcA och senare CnrA-proteinet. De bäst karakteriserade RND-proteinerna inkluderar CzcCBA (Cd2 + , Zn2 + och Co2 + ), CnrCBA (Ni2 + och Co2 + ) och NccCBA (Ni2 + , Co2 + och Cd2 + ) i Cupriavidus , Czr (Cd 2+ och Zn 2+ resistens) i Pseudomonas aeruginosa , och Czn (Cd 2+ , Zn 2+ och Ni 2+ resistens) i Helicobacter pylori . Det har föreslagits att metalljonutflödet sker från cytoplasman och periplasman baserat på lokaliseringen av flera substratbindningsställen på RND-proteinet.
CznCBA
Czn-systemet upprätthåller homeostas av kadmium- , zink- och nickelmotstånd ; det är involverat i Urease- modulering och gastrisk kolonisering av H. pylori . CznC- och CznA-proteinerna spelar den dominerande rollen i nickelhomeostas.
CzcCBA
Czc ger motstånd mot kobolt , zink och kadmium . CzcCBA-operonen innefattar: CzcA (det RND-familjespecifika proteinet), membranfusionsproteinet (MFP) CzcB och det yttre membranfaktorproteinet (OMF) CzcC, som alla bildar det aktiva trepartskomplexet och czcoperon . Uttryck av operon regleras genom metalljoner.
Läkemedelsresistens (HAE-RND)
RND-familjen spelar en viktig roll för att producera inneboende och förhöjd multiläkemedelsresistens hos gramnegativa bakterier. Exporten av amfifila och hydrofoba substrat styrs av HAE-RND-familjen. I E. coli har fem RND-pumpar identifierats specifikt: AcrAB, AcrAD, AcrEF, MdtEF och MdtAB. Även om det inte är klart hur trepartskomplexet fungerar i bakterier har två mekanismer föreslagits: Adapter Bridging Model och Adapter Wrapping Model .
HAE-RND: s inblandning i avgiftning och export av organiska substrat möjliggjorde nyligen karakterisering av specifika pumpar på grund av deras ökande medicinska relevans. Hälften av antibiotikaresistensen som demonstrerats i in vivo sjukhusstammar av Pseduomonas aeruginosa tillskrevs RND-utflödesproteiner. P. aeruginosa innehåller 13 RND-transportsystem, inklusive en HME-RND och de återstående HAE-RND. Bland de bäst identifierade är Mex-proteinerna: MexB, MexD och MexF, som avgiftar organiska ämnen . Det föreslås att MexB-systemen visar substratspecificitet för beta-laktamer ; medan MexD-systemet uttrycker specificitet för cefemföreningar.
E. coli - AcrB
I E. coli utvecklas multiläkemedelsresistens från en mängd olika mekanismer. Särskilt beträffande är förmågan hos utflödesmekanismer att ge motstånd mot bredband. RND-utströmningspumpar ger extrudering för en rad föreningar. Fem proteintransportörer i E. coli- celler som tillhör HAE-RND-underfamiljen har klassificerats, inklusive multiläkemedelsflödesproteinet AcrB, det yttre membranproteinet TolC och det periplasmiska adapterproteinet AcrA. TolC- och AcrA-proteinerna används också i trepartskomplexet i andra identifierade RND-utflödesproteiner. AcrAB-TolC-utflödessystemet är ansvarigt för utflödet av antimikrobiella läkemedel som penicillin G , cloxacillin , nafcillin , makrolider , novobiocin , linezolid och fusidinsyra- antibiotika. Andra substrat inkluderar färgämnen, tvättmedel, vissa organiska lösningsmedel och steroidhormoner . Sätten på vilka de lipofila domänerna i substratet och RND-pumparna är inte fullständigt definierade.
Det kristalliserade AcrB-proteinet ger insikt i verkningsmekanismen för HAE-RND-proteiner och andra RND-familjeproteiner.
Multidrug transport (Mdt) efflux
Mdt (A) är en utflödespump som ger resistens mot en mängd olika läkemedel. Det uttrycks i L. lactis , E. coli och olika andra bakterier. Till skillnad från andra RND-proteiner innehåller Mdt (A) ett förmodat ATP-bindningsställe och två C-motiv konserverade i dess femte TMS. Mdt är effektivt för att ge bakterierna resistens mot tetracyklin , kloramfenikol , linkosamider och streptomycin . Energikällan för aktivt utflöde av Mdt (A) är för närvarande okänd.