Office for Human Research Protections - Office for Human Research Protections
Den Byrån för mänskliga forsknings Protections (OHRP) är ett litet kontor i USA Department of Health and Human Services (DHHS), speciellt tjänstgörande biträdande sekreterare för hälsovård i Office of Secretary of DHHS, som behandlar etiska förbiseenden inom klinisk forskning utförd av institutionen, mestadels genom National Institutes of Health (NIH).
Kontorets primära uppgift är att implementera 45 CFR 46 , en uppsättning föreskrifter för Institutional Review Boards (IRB) som återspeglar USA: s Food and Drug Administration (FDA) förordning som omfattar klinisk forskning som utförs av läkemedelsföretag samt andra föreskrifter enligt vägledning av den federala policyn för skydd av mänskliga ämnen, som också kallas "den gemensamma regeln ".
Institutioner som bedriver DHHS-sponsrad forskning måste ha en "Federal-Wide Assurance" (FWA), ett avtal med OHRP angående etisk tillsyn. OHRP ger också utbildning för IRB, ger vägledning om forskningsetik och rådar HHS -sekreteraren i frågor om medicinsk etik .
| Byråöversikt | |
|---|---|
| Bildad | Juni 2000 |
| Föregående | |
| Huvudkontor | 1101 Wootton Parkway, Suite 200 Rockville, MD 20852 |
| Föräldraavdelning | United States Department of Health and Human Services |
| Hemsida | https://www.hhs.gov/ohrp/ |
Historia
Mänskliga experiment före OHRP
Oetiskt mänskligt experiment i USA har praktiserats i USA under en lång tid innan OHRP skapades. En viktig egenskap hos experiment som gjordes under denna tid var ignoransen för lidande som drabbats av patienter. På 1840 -talet utförde J. Marion Sims hundratals kirurgiska operationer på förslavade afrikanska kvinnor utan anestesi. Robert Bartholow applicerade elektriska strömmar i patientens exponerade hjärnämne. Ett allvarligt exempel var 1874 när en dam kom in för behandling av ett cancersår på hennes skalle som gjorde ett 2-tums hål. Bartholow satte in elektroder i hennes hjärna och orsakade henne stor nöd. Damen gick i koma och dog 4 dagar senare. Ett annat tema för mänskliga experiment under 1800- och början av 1900 -talet var orättvis behandling av etniska minoritetspatienter. I början av 1900 -talet infekterade amerikanska arméläkare 34 filippinska fångar med bubonic pest och beriberi. Mellan 1932 och 1972 observerade Tuskegee syfilis -experimentet den naturliga utvecklingen av syfilis hos 600 afroamerikanska män (varav 399 hade syfilis och 201 kontrollpersoner som inte hade syfilis). I utbyte mot deras deltagande lovades männen gratis medicinska undersökningar, varma måltider och en begravningsfond. Männen fick aldrig veta att de hade syfilis och de fick inte behandling när penicillin blev tillgängligt som ett effektivt botemedel 1947. Vid slutet av studien 1972 var bara 74 av testpersonerna vid liv. Av de ursprungliga 399 män med syfilis hade 28 dött av sjukdomen, 100 hade dött av syfilisrelaterade komplikationer. Dessutom hade 40 fruar smittats och 19 barn hade fötts med medfödd syfilis. En vanlig missuppfattning av Tuskegee Syphilis Experiment är att försökspersoner injicerades med syfilis.
Anmärkningsvärda precursory forskningsetiska enheter
Innan OHRP grundades gick USA igenom flera prekursoriska enheter vars mål var att hantera etik i mänskliga experiment. Många var övergående kommittéer som inte varade mer än ett eller två år, till exempel rådgivande kommittén för mänskliga strålningsexperiment och Etics Advisory Board. En av de tidiga och mångåriga grupper som rör experimentell ämnesäkerhet var American Psychological Association (APA), som först publicerade sina ”Etiska normer för psykologer” 1953. APA har sedan publicerat många versioner av sin etiska kod och fungerar för närvarande under kod godkänd 2002 Den nationella forskningslagen inrättade sedan National Commission for the Protection of Human Subjects of Biomedical and Behavioral Research , som var den första nationella kommissionen vars hela fokus var skyddet av experimentella ämnen. År 1978 lade Food and Drug Administration till sina första föreskrifter om skydd av ämnen inom mänskliga forskningsområden, som reviderades 1981. National Bioethics Advisory Commission undertecknades av president Bill Clinton i oktober 1995 och avslutades i oktober 2001.
Grundande
Den 13 juni 2000 skapade USA: s sekreterare för hälsa och mänskliga tjänster , Donna Shalala OHRP som en del av Office of Public Health and Science , med huvudfunktionen att övervaka forskning som utförts på mänskliga testämnen och säkerställa dess efterlevnad av bestämmelser som fastställts av US Department of Health and Human Services . OHRP ersatte kontoret för skydd mot forskningsrisker och Greg Koski utsågs till den första direktören. OHRP: s chef skulle rapportera till USA: s biträdande hälsosekreterare under Department of Health and Human Services (dåvarande David Satcher ).
Fallinblandning
Sedan dess grundades har OHRP blandat sig i flera fall som involverar forskningsförsök på människor, där kränkningar gjordes av deltagarnas hälsa och rättigheter, liksom de regler som införts för mänsklig forskning. År 2001 avbröt OHRP tillfälligt forskningslicensen från Johns Hopkins University och dess tillhörande forskningsanläggningar efter att en deltagare dog i ett hexametoniuminhalationsexperiment. Experimentet visade sig bryta mot bestämmelserna genom att forskarna inte underrättade deltagarna om de möjliga farorna med hexametonium samt fick korrekt information om effekten av hexametonium före experiment. I ett annat fall som inträffade 2013 utmanade OHRP praxis med Surfactant, Positive Pressure and Oxygenation Randomized Trial (SUPPORT), ett forskningsprojekt där 1300 för tidiga spädbarn användes som försökspersoner för att testa de optimala nivåerna av syresättning som skulle användas för korrekt vård av för tidigt födda barn på sjukhus. Detta experiment bestämde sig för att bryta mot federala bestämmelser genom att föräldrarna till dessa spädbarn inte informerades om experimentets möjliga effekter på deras barn, vilket inkluderade blindhet eller död, och därför inte kunde ge informerat samtycke .
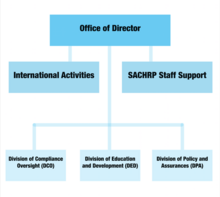
Organisationsstruktur
Direktörens kontor
Som ledare inom DHHS övervakar direktörens kontor alla funktioner i OHRP och arbetar nära DHHS -tjänstemän, inklusive hälso- och sjukvårdssekreteraren och assisterande hälsosekreterare för att säkerställa att forskning, policyer och förfaranden för mänsklig forskning möts etiska normer. De kommittéer som omfattas av direktörens kontor inkluderar internationella aktiviteter och sekreterarens rådgivande kommitté för skydd mot mänsklig forskning (SACHRP).
Sekreterarens rådgivande kommitté för skydd mot mänsklig forskning (SACHRP)
SACHRP är en kommitté inom direktörens kontor och består huvudsakligen av forskare och advokater som hjälper hälso- och sjukvårdssekreteraren med sina expertråd. Den assisterande hälsosekreteraren fungerar som en mellanhand och presenterar kommitténs råd för sekreteraren för övervägande. Dessutom håller SACHRP också tre årliga möten som är öppna för allmänheten och frågor.
Internationella aktiviteter
Denna kommitté arbetar för att förbättra etiska policyer och förfaranden som skyddar mänskliga forskningsämnen runt om i världen. Dessa globala insatser säkerställer att de människor som deltar i all forskning som finansieras och utförs av DHHS ges ett skydd lika med dem som deltar i USA.
Division of Compliance Oversight
Avdelningen för efterlevnad Tillsyn är ansvarig för utvärdering av materiella avsteg rapporter baserade på Health and Human Services (HHS) regler . Baserat på skriftliga utredningsrapporter avgör kontoret om det kommer att krävas reglerande åtgärder för att skydda de mänskliga forskningsämnena. Både utvärderingar av överensstämmelse och icke-orsak orsakas av utvärderingar.
Avdelningen för utbildning och utveckling (DED)
DED ansvarar för mycket av OHRP: s publicitet. Dess uppgifter innefattar att vara värd för evenemang, ge råd till forskare som är involverade i anslutna experiment och sprida utbildningsmaterial om skydd av mänskliga forskningsämnen. Utbildningsmaterial presenteras också online via den officiella OHRP -webbplatsen.
Uppdelning av policy och försäkringar
Division of Policy and Assurances utarbetar policyn, riktlinjerna och kraven för skydd av mänskliga ämnen och tillhandahåller informationen till forskarsamhället. Det ansvarar också för administrationen av Federal-wide Assurances of Compliance och registrering av institutionella granskningsnämnder.
Ansvar
Belmont -rapport
Office for Human Research Protections följer principerna i Belmont -rapporten för att kunna utföra sitt ansvar. Den Belmont Report är en uppsättning riktlinjer som skapats av nationella kommissionen för skydd av de mänskliga ämnen i Biomedical och Behavioral Research. Belmont -rapporten är avsedd att fungera som etiska parametrar för dem som bedriver forskning som involverar människor, och har tre huvudaspekter: gränser mellan praktik och forskning, grundläggande etiska principer och tillämpning av dessa principer.
Det är stor skillnad mellan regler för tillämpning av godkända förfaranden och forskning. Som sådan definierar Belmont -rapporten varje term för att avgöra vad som utgör vad. Övning definieras som en etablerad metod som är utformad för att förbättra individens tillstånd med förtroende för framgång. Forskning definieras som ett förfarande för att testa en hypotes och dra slutsatser i en experimentell stil. OHRP granskar endast aktivitet som kategoriserats som forskning.
De tre grundläggande etiska principerna som beskrivs i Belmont -rapporten är respekt för personer, välgörenhet och rättvisa. Respekt för personer innefattar betoning på ämnena och deras autonomi, vilket innebär deras förmåga att fatta beslut i forskningen. För att få autonomi måste ämnen ge informerat samtycke. Det betyder att de måste vara mogna nog till och mentalt kapabla till självbestämmande, måste fullt ut förstå sin roll i procedurerna och måste vara helt frivilliga att delta. Beneficence kräver att forskningen har för avsikt att ge fördelar, eller potential för fördelar, för individen eller andra med liknande förhållanden som uppväger alla risker som kan vara involverade. Rättvisa avgränsar ett behov av rättvis fördelning i valet av ämnen, vilket innebär att partiskhet hos deltagarna minimeras. Deltagare kan inte vara alla från en sårbar eller lättillgänglig befolkning utan att bryta mot rättviseprincipen.
45 CFR . 46
Grundläggande HHS -policy för skydd av mänskliga forskningsämnen
Del A, eller mer allmänt känd som " Common Rule ", i 45 CFR 46 är de grundläggande riktlinjerna för etik i all mänsklig forskning. Varje anläggning som vill forska om människor måste lämna in ett dokument som säger att de kommer att följa denna policy och all relevant politik till den federala avdelningen eller myndigheten med myndighet. Den IRB måste först granska och godkänna forskning och i det fall studien godkänns av IRB kommer sedan att fortsätta att övervaka forskningen. Om forskningen vid något tillfälle inte följer de riktlinjer som godkänts av IRB , har IRB befogenhet att avbryta eller avsluta forskningen. Den ansvariga avdelningen eller byrån har också befogenhet att avbryta forskningen. Under studiens gång måste IRB dokumentera alla möten och aktiviteter.
De riktlinjer som en forskningsstudie måste följa innan de godkänns innefattar: informerat samtycke från försökspersonerna, minimal risk för försökspersonerna och inget missbruk av ”utsatta ämnen”. Informerat samtycke måste inkludera alla aspekter av forskningen som inkluderar den övergripande förutsättningen, risker, fördelar, alternativa förfaranden, konfidentialitet och eventuella kompensationer som kan finnas tillgängliga. Ämnet måste officiellt uppge att de frivilligt väljer att delta i experimentet under alla omständigheter som anläggningen tillhandahåller. Detta informerade samtycke dokumenteras av IRB och signeras av testpersonen.
Ytterligare skydd för gravida kvinnor, mänskliga foster och nyfödda
Det amerikanska avdelningen för hälsa och mänskliga tjänster sätter nödvändiga villkor för all forskning som görs på gravida kvinnor eller foster.
För forskning om gravida kvinnor och foster inkluderar tillståndsämnen prekliniska riskstudier, minimering av risk, inga pengar (eller andra fördelar) som ges för att avbryta graviditeten, direkt potentiell nytta för gravida kvinnor och foster (annars krävs särskilda samtycksbestämmelser), gravida barn ( kräver särskilda medgivandebestämmelser), och forskningsdeltagares oförmåga att varken välja hur en graviditet avbryts eller om en nyfödd (ett spädbarn under 4 veckor) är livskraftigt.
För forskning specifikt om nyfödda skiljer sig regler från beroende på om barnet har viss livskraft, viss osäkerhet eller osäker livskraft. För osäker lönsamhet måste forskningen maximera sannolikheten för lönsamhet och följa bestämmelserna om förälders samtycke. För icke-livskraftiga nyfödda kan forskningen inte avsluta hjärtslag eller andning, och de kan inte heller artificiellt upprätthålla vitala funktioner; det kan inte läggas någon risk till det nyfödda, och föräldrarnas samtycke krävs. Levande nyfödda har ett samtyckesförfarande.
Det finns också särskilda villkor för forskning som involverar placenta, fostermaterial eller fostermaterial efter förlossningen. Dessa kräver studier för att följa federala, statliga och lokala lagar. Dessutom, om individer från forskningen på något sätt kan identifieras, är dessa individer forskningsämnen och måste behandlas med alla nödvändiga lagkrav.
Om en studie inte kan godkännas av dessa villkor men erbjuder en stor potential för gravida kvinnors, fosters eller nyfödda hälsa, finns det en speciell process genom vilken sekreteraren kanske godkänner studien. denna process innebär samråd med en panel av experter, samt etiska och samtycke koder.
Ytterligare skydd för fångar
Vägledningen om fångars inblandning i forskning ger skydd till fångar. Det är viktigt att notera att fångar kan vara involverade i biomedicinsk eller beteendeforskning om och endast om forskningen är särskilt godkänd. "Fånge" definieras av HHS -föreskrifterna vid 45 CFR del 46.303 (c) som "varje enskild person som ofrivilligt är inhäktad eller kvarhållen i en straffinstitution. Uttrycket är avsett att omfatta individer som dömts till en sådan institution enligt en brottslig eller civil lag, individer häktade. i andra anläggningar i kraft av stadgar eller åtagandeförfaranden som ger alternativ till straffrättsligt åtal eller fängelse i en straffinstitution, och individer kvarhållna i avvaktan på anhållande, rättegång eller straff. " Det gäller också situationen där en person blir fång efter att forskningen har påbörjats.
Underdelen B påpekar att om en fånges förmåga att ge samtycke påverkas, det vill säga att den här fångens beslut verkligen inte är frivilligt och utan tvång, bör ytterligare skyddsåtgärder ges för säkerhets skull. Dessutom bör IRB: s medlemmar (1) i allmänhet inte ha någon koppling till de inblandade fängelserna och (2) ha minst en av dem för att vara fånge. Generellt sett är skyddet för fångar liknande det för andra minoritetsgrupper, och själva forskningen bör få tillstånd från OHRP.
Ytterligare skydd för barn
När det gäller mänsklig forskning är "barn" personer som inte har uppnått laglig ålder för samtycke till behandlingar eller förfaranden som är involverade i forskningen, enligt gällande lag i den jurisdiktion där forskningen kommer att bedrivas. " För det mesta är skyddet för minderåriga mestadels desamma som för alla andra mänskliga ämnen. Underdel D i 45 CFR 46 markerar dock flera skillnader när det gäller att få samtycke/samtycke och arten av forskningen som involverar barn. Enligt de faktiska reglerna för informerat samtycke från IRB för den aktuella forskningen kan barn samtycke och föräldrars samtycke krävas för att bedriva forskning om minderåriga. Beroende på IRB: s föreskrifter, om någon av parterna inte ger sitt samtycke, kan det hända att det inte görs forskning om barnet.
I allmänhet får forskning endast göras om barn om det inte kommer att innebära någon betydande risk för barnet. Denna regel kan kringgås om barnet får en direkt fördel för sin hälsa även om förfarandet kan ha större risk än minimal. Även om det inte finns någon direkt fördel för den minderårige och risken kan vara större än minimal kan IRB godkänna forskningen om generaliserad kunskap om ämnets tillstånd eller om kunskap om barns hälsa kan komma ur forskning om barnet.
Registrering av IRB
IRB , institutionell granskningsnämnd, är en typ av kommitté som granskar människobaserad bioforskning. Under 45 CFR 46 måste varje IRB som utsetts av en institution vara registrerad hos Office for Human Research Protections (OHRP) vid Department of Health and Human Services (HHS). Vid registrering av en IRB måste följande information lämnas till OHRP: information om institutionen, inklusive dess namn och postadress, personuppgifter om den ansvariga för IRB , det uppskattade antalet aktiva protokoll som IRB har genomfört en första granskning eller kommer att göra en granskning, och antalet heltidsanställningar för IRB . All registreringsprocess måste göras elektroniskt via OHRP: s officiella webbplats. Efter registrering kommer all information som kommer att granskas av OHRP. Den IRB kommer att förbli effektivt under tre år efter det att officiellt godkänd och accepterad. Informationen måste förnyas vart tredje år. Om det skulle bli någon ändring av ordförandens information måste dessutom en uppdatering skickas till OHRP inom 90 dagar. Om institutionen eller organisationen beslutar att avveckla en för närvarande fungerande och fungerande IRB måste en rapport skickas till OHRP inom 30 dagar.