Na + /K + -ATPase -Na+/K+-ATPase
| Na⁺/K⁺-ATPase-pump | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Natrium-kaliumpump, E2-Pi-tillstånd. Beräknade kolvätegränser för lipiddubbelskiktet visas som blå (intracellulära) och röda (extracellulära) plan
| |||||||||
| Identifierare | |||||||||
| EG -nr. | 7.2.2.13 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz -vy | ||||||||
| BRENDA | BRENDA -inträde | ||||||||
| ExPASy | NiceZyme -vy | ||||||||
| KEGG | KEGG -post | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB -strukturer | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Na * / K ^ -ATPas ( natrium - kalium adenosin triphosphatase , även känd som den Na * / K + pump eller natrium-kaliumpumpen ) är ett enzym (en elektrogen transmembran ATPas ) som finns i membranet av alla djurceller. Den utför flera funktioner inom cellfysiologi .
Na⁺/K⁺-ATPase-enzymet är aktivt (dvs. det använder energi från ATP ). För varje ATP -molekyl som pumpen använder exporteras tre natriumjoner och två kaliumjoner importeras; det finns därför en nettoexport av en enda positiv laddning per pumpcykel.
Natrium -kaliumpumpen upptäcktes 1957 av den danska forskaren Jens Christian Skou , som tilldelades ett Nobelpris för sitt arbete 1997. Upptäckten markerade ett viktigt steg framåt i förståelsen av hur joner kommer in och ut ur celler, och det har särskild betydelse för exciterbara celler som nervceller , som är beroende av denna pump för att svara på stimuli och överföra impulser.
Alla däggdjur har fyra olika natriumpumpundertyper, eller isoformer. Var och en har unika egenskaper och vävnadsuttrycksmönster. Detta enzym tillhör familjen av ATPaser av P-typ .
Fungera
Den Na / K ^ -ATPas bidrar till att upprätthålla vilopotential påverkar transport och reglerar cellvolym . Det fungerar också som en signalomvandlare/integrator för att reglera MAPK -vägen , reaktiva syrearter (ROS), liksom intracellulärt kalcium. Faktum är att alla celler förbrukar en stor bråkdel av ATP de producerar (vanligtvis 30% och upp till 70% i nervceller) för att behålla sina erforderliga cytosoliska Na- och K -koncentrationer. För neuroner kan Na⁺/K⁺-ATPas stå för upp till 3/4 av cellens energiförbrukning. I många typer av vävnader har ATP-förbrukning av Na⁺/K⁺-ATPaserna relaterats till glykolys . Detta upptäcktes först i röda blodkroppar (Schrier, 1966), men har senare visats i njurceller, släta muskler som omger blodkärlen och hjärt -purkinje -celler. Nyligen har glykolys också visat sig vara av särskild betydelse för Na⁺/K⁺-ATPaser i skelettmuskler, där hämning av glykogennedbrytning (ett substrat för glykolys ) leder till minskad Na⁺/K⁺-ATPas-aktivitet och lägre kraftproduktion .
Vilande potential

För att upprätthålla cellmembranpotentialen behåller cellerna en låg koncentration av natriumjoner och höga kaliumjoner i cellen ( intracellulär ). Natrium -kaliumpumpmekanismen flyttar ut 3 natriumjoner och flyttar in 2 kaliumjoner och tar därmed totalt bort en positiv laddningsbärare från det intracellulära utrymmet (se Mekanism för detaljer). Dessutom finns det en kortslutningskanal (dvs en mycket K-permeabel jonkanal) för kalium i membranet, så spänningen över plasmamembranet är nära kaliumets Nernst-potential .
Omvänd potential
Även om både K⁺- och Na⁺ -joner har samma laddning kan de fortfarande ha mycket olika jämviktspotentialer för både yttre och/eller inre koncentrationer. Natriumkaliumpumpen rör sig mot ett jämviktstillstånd med de relativa koncentrationerna av Na2 och K2 för både inuti och utsidan av cellen. Exempelvis är koncentrationen av K2 i cytosol 100 mM, medan koncentrationen av Na2 är 10 mM. Å andra sidan, i extracellulärt utrymme, är koncentrationen av K5 5mM, medan koncentrationen av Na2 är 150mM.
Transport
Natriumexport från cellen är drivkraften för flera sekundära aktiva transportörer membrantransportproteiner , som importerar glukos , aminosyror och andra näringsämnen till cellen genom användning av natriumgradienten.
En annan viktig uppgift för Na⁺-K⁺-pumpen är att tillhandahålla en Na2-gradient som används av vissa bärarprocesser. I tarmen , till exempel, transporteras natrium ut från reabsorberande cell på blodsidan (interstitiell vätska) via Na⁺-K⁺-pumpen, medan reabsorberande (lumenal) sida använder Na⁺- glukosymporatorn skapade Na⁺ -gradient som energikälla för att importera både Na⁺ och glukos, vilket är mycket effektivare än enkel diffusion. Liknande processer finns i njurrörsystemet .
Kontrollera cellvolymen
Om Na⁺-K⁺-pumparna misslyckas kan det leda till svullnad av cellen. En cells osmolaritet är summan av koncentrationerna av de olika jonarterna och många proteiner och andra organiska föreningar inuti cellen. När detta är högre än osmolariteten utanför cellen rinner vatten in i cellen genom osmos . Detta kan få cellen att svälla upp och lysera . Na⁺-K⁺-pumpen hjälper till att bibehålla rätt koncentration av joner. Vidare, när cellen börjar svälla, aktiverar detta automatiskt Na⁺-K⁺-pumpen eftersom den ändrar de interna koncentrationerna av Na⁺-K⁺ som pumpen är känslig för.
Fungerar som signalgivare
Under det senaste decenniet har många oberoende laboratorier visat att, förutom den klassiska jontransporten, kan detta membranprotein också vidarebefordra extracellulär ouabainbindande signal till cellen genom reglering av proteintyrosinfosforylering. Till exempel i Ramnanan CJ. 2006 undersöker studien funktionen av Na+/K+ATPas i fotmuskel och hepatopankreas i landsnigel O.Lactea som jämför de aktiva och utvecklande tillstånden. De drog slutsatsen att reversibel fosforylering kan styra samma sätt att koordinera ATP-användning av denna jonpump med hastigheterna för ATP-generationen genom kataboliska vägar vid uppkomst av O. Lactea . Nedströmsignalerna genom ouabain-triggade proteinfosforyleringshändelser inkluderar aktivering av mitogen- aktiverade proteinkinas (MAPK) signalkaskader, mitokondriell reaktiv syre (ROS) produktion, samt aktivering av fosfolipas C (PLC) och inositol trifosfat (IP3) receptor ( IP3R ) i olika intracellulära fack.
Protein-protein-interaktioner spelar en mycket viktig roll vid Na⁺-K⁺-pumpmedierad signaltransduktion. Till exempel interagerar Na⁺-K⁺-pump direkt med Src , ett icke-receptortyrosinkinas, för att bilda ett signalreceptorkomplex. Src-kinas inhiberas av Na2-K2-pump, medan Src-kinas-domänen kommer att frigöras och därefter aktiveras efter en tidig bindning. Baserat på detta scenario utvecklades NaKtide, en peptid Src-hämmare som härrör från Na⁺-K⁺-pump, som en funktionell ouabain-Na⁺-K⁺-pumpmedierad signaltransduktion. Na⁺-K⁺-pump interagerar också med ankyrin , IP3R, PI3K , PLC-gamma och kofilin .
Kontroll av neuronaktivitetstillstånd
Na⁺-K⁺-pumpen har visat sig styra och ställa in det egna aktivitetsläget för cerebellära Purkinje-neuroner , tillbehörs luktlök- mitralceller och förmodligen andra neurontyper. Detta tyder på att pumpen kanske inte bara är en homeostatisk , "hushållande" molekyl för joniska gradienter, utan kan vara ett beräkningselement i lillhjärnan och hjärnan . Faktum är att en mutation i Na⁺ -K⁺ -pumpen orsakar snabb dystoni - parkinsonism , som har symptom som indikerar att det är en patologi för cerebellär beräkning. Dessutom resulterar ett ouabain-block av Na⁺-K⁺-pumpar i cerebellum hos en levande mus i att det uppvisar ataxi och dystoni . Alkohol hämmar natrium -kaliumpumpar i lillhjärnan och det är troligtvis så att det skadar cerebellär beräkning och kroppskoordination. Fördelningen av Na⁺-K⁺-pumpen på myeliniserade axoner, i mänsklig hjärna, visade sig ligga längs det interodala axolemmat, och inte inom det nodala axolemma som tidigare trott.
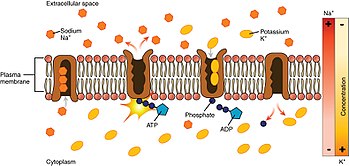
Mekanism
Tittar på processen utifrån cellens inre.
- Pumpen har en högre affinitet för Na⁺ -joner än K⁺ -joner, och binder således 3 intracellulära Na2 -joner efter bindning av ATP .
- ATP hydrolyseras , vilket leder till fosforylering av pumpen vid en mycket konserverad aspartatrest och efterföljande frisättning av ADP . Denna process leder till en konformationsförändring i pumpen.
- Konformationsförändringen utsätter Najonerna för utsidan. Den fosforylerade formen av pumpen har låg affinitet för Na⁺ -joner, så att de frigörs; däremot har den hög affinitet för K⁺ -jonerna.
- Pumpen binder 2 extracellulära K⁺ -joner. Detta orsakar defosforylering av pumpen, återställer den till dess tidigare konformationstillstånd och frigör därmed K⁺ -jonerna i cellen.
- Den ofosforylerade formen av pumpen har en högre affinitet för Na⁺ -joner. ATP binder och processen startar om.
Förordning
Endogen
Na⁺/K⁺-ATPas uppregleras av cAMP . Således uppreglerar ämnen som orsakar en ökning av cAMP Na2/K2-ATPas. Dessa inkluderar liganderna enligt G s -kopplade GPCR. Däremot nedreglerar ämnen som orsakar en minskning av cAMP Na⁺/K⁺-ATPas. Dessa inkluderar liganderna enligt G i -kopplade GPCR. Obs: Tidiga studier indikerade motsatt effekt, men dessa visade sig senare vara felaktiga på grund av ytterligare komplicerande faktorer.
Na⁺/K⁺-ATPas regleras endogent negativt av inositolpyrofosfatet 5-InsP7, en intracellulär signalmolekyl genererad av IP6K1 , som avlastar en autoinhibitorisk domän för PI3K p85α för att driva endocytos och nedbrytning.
Na⁺/K⁺-ATPas regleras också av reversibel fosforylering. Forskning har visat att Na est/K⁺-ATPas i estiverande djur finns i fosforylerad och låg aktivitet. Deposforylering av Na2/K2-ATPas kan återställa det till formen med hög aktivitet.
Exogen
Na⁺/K⁺-ATPas kan farmakologiskt modifieras genom administrering av läkemedel exogent. Dess uttryck kan också modifieras genom hormoner som triiodothyronine , ett sköldkörtelhormon .
Till exempel är Na⁺/K⁺-ATPas som finns i membranet i hjärtceller ett viktigt mål för hjärtglykosider (till exempel digoxin och ouabain ), inotropa läkemedel som används för att förbättra hjärtats prestanda genom att öka dess kontraktionskraft.
Muskelkontraktion är beroende av en 100- till 10 000 gånger högre än vilande intracellulär Ca²⁺- koncentration, vilket orsakas av att Ca²⁺ frigörs från muskelcellernas sarkoplasmatiska retikulum. Omedelbart efter muskelkontraktion återförs intracellulärt Ca²⁺ snabbt till sin normala koncentration av ett bärarenzym i plasmamembranet och en kalciumpump i sarkoplasmatisk retikulum , vilket får muskeln att slappna av.
Enligt Blaustein-hypotesen använder detta bärarenzym (Na⁺/Ca²⁺-växlare, NCX) Na-gradienten som genereras av Na⁺-K⁺-pumpen för att avlägsna Ca²⁺ från det intracellulära utrymmet och därmed sakta ner Na⁺-K ⁺ pump resulterar i en permanent förhöjd Ca²⁺-nivå i muskeln , vilket kan vara mekanismen för den långsiktiga inotropa effekten av hjärtglykosider som digoxin. Problemet med denna hypotes är att vid farmakologiska koncentrationer av digitalis, mindre än 5% av Na / K-ATPas-molekyler-specifikt α2 isoformen i hjärtat och arteriell glatt muskulatur ( K d = 32 nM) - inhiberas, inte tillräckligt för att påverkar den intracellulära koncentrationen av Na2. Bortsett från populationen av Na/K-ATPas i plasmamembranet-ansvarigt för jontransport-finns det dock en annan population i grottorna som fungerar som digitalisreceptor och stimulerar EGF-receptorn .
Farmakologisk reglering
Under vissa tillstånd, såsom vid hjärtsjukdom, kan Na⁺/K⁺-ATPas behöva hämmas via farmakologiska medel. En vanligt förekommande hämmare som används vid behandling av hjärtsjukdomar skulle vara digoxin som väsentligen binder "till den extracellulära delen av enzymet, dvs som binder kalium, när det är i fosforylerat tillstånd, för att överföra kalium inuti cellen" Efter denna väsentliga bindning inträffar, en defosforylering av alfa -subenheten inträffar vilket minskar effekten av hjärtsjukdom. Det är via hämning av Na⁺/K⁺-ATPas som natriumnivåerna kommer att börja öka i cellen vilket slutligen ökar koncentrationen av intracellulärt kalcium via natrium-kalciumbytaren. Denna ökade närvaro av kalcium är det som gör det möjligt att öka kontraktionskraften. För patienter där hjärtat inte pumpar tillräckligt hårt för att ge det som behövs för kroppen möjliggör detta tillvägagångssätt tillfällig övervinnande av detta.
Upptäckt
Na⁺/K⁺-ATPase upptäcktes av Jens Christian Skou 1957 medan han arbetade som biträdande professor vid Institutionen för fysiologi, University of Aarhus , Danmark . Han publicerade sitt verk det året.
År 1997 fick han hälften av Nobelpriset i kemi "för den första upptäckten av ett jontransporterande enzym, Na⁺, K⁺-ATPase."
Gener
- Alfa: ATP1A1 ATP1A1 , ATP1A2 ATP1A2 , ATP1A3 ATP1A3 , ATP1A4 ATP1A4 . #1 dominerar i njure. #2 är också känt som "alfa (+)"
- Beta: ATP1B1 ATP1B1 , ATP1B2 , ATP1B3 ATP1B3 , ATP1B4
Hos insekter
Mutagenesstudier utförda av Susanne Dobler har identifierat de bevarade hårnålarna M3-M4 och M5-M6. Vid position 312 skilde sig insekter som föder Apocynum- arter från Na2/K2-ATPas från däggdjur genom förändringen av glutaminsyra till asparaginsyra. Således befanns insekterna ha en högre grad av bevarande i C-terminalen i ouabain- bindningsfickan. Dobler et al. fann 87% aminosyraidentitet bland insektsekvenser, vilket visar en hög molekylär konvergens bland fyra ordningar av insektsätare. Således ger vissa substitutioner motståndskraft mot kardenolider som en anpassning även över fylogenetiska grenar.
Ytterligare bilder
Se även
Referenser
externa länkar
- Natrium,+Kalium+ATPas vid US National Library of Medicine Medical Subject Headings (MeSH)
- RCSB Proteindatabank: Natrium -Kaliumpump
- En video av Khan Academy .