Akrylsyra - Acrylic acid
|
|
|
|
| Namn | |
|---|---|
|
IUPAC -namn
Akrylsyra
|
|
|
Föredraget IUPAC -namn
Prop-2-enoic acid |
|
| Andra namn | |
| Identifierare | |
|
3D -modell ( JSmol )
|
|
| 635743 | |
| ChEBI | |
| CHEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard |
100.001.071 |
| EG -nummer | |
| 1817 | |
| KEGG | |
|
PubChem CID
|
|
| RTECS -nummer | |
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C 3 H 4 O 2 | |
| Molmassa | 72,063 g/mol |
| Utseende | Klar, färglös vätska |
| Odör | Frän |
| Densitet | 1,051 g/ml |
| Smältpunkt | 14 ° C (57 ° F; 287 K) |
| Kokpunkt | 141 ° C (286 ° F; 414 K) |
| Blandbar | |
| logg P | 0,28 |
| Ångtryck | 3 mmHg |
| Surhet (p K a ) | 4,25 (H 2 O) |
| Viskositet | 1,3 cP vid 20 ° C (68 ° F) |
| Faror | |
| Säkerhetsdatablad | MSDS |
| GHS -piktogram |
   
|
| GHS Signalord | Fara |
| H226 , H302 , H312 , H314 , H332 , H400 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+312 , P301+330+331 , P302+352 , P303+361+353 , P304+312 , P304+340 , P305+351+338 , P310 , P312 , P321 , P322 , P330 | |
| NFPA 704 (eldiamant) | |
| Flampunkt | 68 ° C (154 ° F; 341 K) |
| 429 ° C (804 ° F; 702 K) | |
| Explosiva gränser | 2,4–8,02% |
| NIOSH (amerikanska hälsoexponeringsgränser): | |
|
PEL (tillåtet)
|
Ingen |
|
REL (rekommenderas)
|
TWA 2 ppm (6 mg/m 3 ) [hud] |
|
IDLH (Omedelbar fara)
|
ND |
| Relaterade föreningar | |
|
Andra anjoner
|
akrylat |
|
Relaterade karboxylsyror
|
ättiksyra propionsyra mjölksyra 3-hydroxipropionsyra malonsyra smörsyra krotonsyra |
|
Relaterade föreningar
|
allylalkohol propionaldehyd akrolein metylakrylat |
|
Om inte annat anges, ges data för material i deras standardtillstånd (vid 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Infobox -referenser | |
Akrylsyra ( IUPAC : propensyra ) är en organisk förening med formeln CH 2 = CHCOOH. Det är den enklaste omättade karboxylsyran , som består av en vinylgrupp som är direkt ansluten till en karboxylsyraterminal . Denna färglösa vätska har en karakteristisk syrlig eller syrlig lukt. Det är blandbart med vatten , alkoholer , etrar och kloroform . Mer än en miljon ton produceras årligen.
Historia
Ordet "akryl" myntades 1843 för ett kemiskt derivat av akrolein , en syrligt luktande olja härledd från glycerol .
Produktion
Akrylsyra produceras genom oxidation av propylen , som är en biprodukt av produktionen av eten och bensin:
- 2 CH 2 = CHCH 3 + 3 O 2 → 2 CH 2 = CHCO 2 H + 2 H 2 O
Historiska metoder
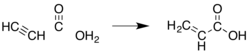
Eftersom akrylsyra och dess estrar länge har värderats kommersiellt har många andra metoder utvecklats. De flesta har övergivits av ekonomiska eller miljömässiga skäl. En tidig metod var hydrokarboxylering av acetylen (" Reppe -kemi"):
Denna metod kräver nickelkarbonyl , höga tryck av kolmonoxid och acetylen, vilket är relativt dyrt jämfört med propylen.
Akrylsyra tillverkades en gång genom hydrolys av akrylnitril , ett material som härrör från propen genom ammoxidation, men denna väg övergavs eftersom den kogenererar ammoniumbiprodukter, som måste kasseras. Andra nu övergivna föregångare till akrylsyra inkluderar ethenon och etylencyanohydrin.
Forskning
Propan är en betydligt billigare råvara än propen, så en alternativ väg som utforskas är selektiv oxidation av propan i ett steg.
Karboxylering av eten till akrylsyra under överkritisk koldioxidtillstånd är termodynamiskt möjligt, men effektiva katalysatorer har inte utvecklats. 3-hydroxipropionsyra (3HP), en akrylsyra-föregångare genom uttorkning, kan framställas från sockerarter, men processen är inte konkurrenskraftig.
Reaktioner och användningsområden
Akrylsyra genomgår de typiska reaktionerna för en karboxylsyra . När den reageras med en alkohol bildar den motsvarande ester . Estrarna och salterna av akrylsyra är gemensamt kända som akrylater (eller propenoater). De vanligaste alkylestrarna av akrylsyra är metyl, butyl, etyl och 2-etylhexylakrylat.
Akrylsyra och dess estrar kombineras lätt med sig själva (för att bilda polyakrylsyra ) eller andra monomerer (t.ex. akrylamider , akrylonitril , vinylföreningar , styren och butadien ) genom att reagera vid sin dubbelbindning och bilda homopolymerer eller sampolymerer som används vid tillverkningen av olika plaster , beläggningar , lim , elastomerer , samt golvpoleror och färger.
Akrylsyra används i många industrier som blöjindustrin , vattenbehandlingsindustrin eller textilindustrin. På global nivå beräknas konsumtionshastigheten för akrylsyra nå mer än uppskattningsvis 8 000 kiloton år 2020. Denna ökning förväntas inträffa till följd av att denna produkt används i nya applikationer, inklusive produkter för personlig vård , tvättmedel och produkter som används för inkontinens hos vuxna .
Substituenter
Som en substituent kan akrylsyra återfinnas som en acylgrupp eller en karboxialkylgrupp, beroende på avlägsnande av gruppen från molekylen.
Mer specifikt är dessa:
- Den akryloylgrupp , med avlägsnande av -OH från kol-1.
- Den 2-karboxietenyl-grupp , med avlägsnande av en -H från kol-3. Denna substituentgrupp finns i klorofyll .
Säkerhet
Akrylsyra är allvarligt irriterande och frätande på huden och luftvägarna. Ögonkontakt kan resultera i allvarlig och irreversibel skada. Låg exponering kommer att orsaka minimala eller inga hälsoeffekter, medan hög exponering kan leda till lungödem . Den LD 50 är 340 mg / kg (råtta, oralt).
Akrylsyra är en beståndsdel i tobaksrök .