Ligandbindningsanalys - Ligand binding assay
En ligandbindningsanalys ( LBA ) är en analys , eller en analytisk procedur, som förlitar sig på bindningen av ligand -molekyler till receptorer , antikroppar eller andra makromolekyler . En detektionsmetod används för att bestämma närvaron och omfattningen av de bildade ligandreceptorkomplexen, och detta bestäms vanligtvis elektrokemiskt eller genom en fluorescensdetekteringsmetod . Denna typ av analytiskt test kan användas för att testa förekomsten av målmolekyler i ett prov som är känt för att binda till receptorn.
Det finns många typer av ligandbindningsanalyser, både radioaktiva och icke-radioaktiva. Som sådan är ligandbindningsanalyser en superset av radiobindningsanalyser , som är den konceptuella inversen av radioimmunanalyser (RIA). Vissa nyare typer kallas "mix-and-measure" -analyser eftersom de inte kräver separation av bunden från obunden ligand.
Ligandbindningsanalyser används främst inom farmakologi för olika krav. Specifikt, trots människokroppens endogena receptorer , hormoner och andra signalsubstanser , använder farmakologer analyser för att skapa läkemedel som är selektiva eller efterliknar de endogent hittade cellulära komponenterna. Å andra sidan finns sådana tekniker också tillgängliga för att skapa receptorantagonister för att förhindra ytterligare kaskader. Sådana framsteg ger forskare möjligheten att inte bara kvantifiera hormoner och hormonreceptorer, utan också att bidra med viktig farmakologisk information i läkemedelsutveckling och behandlingsplaner.
Historia
Historiskt sett användes ligandbindningsanalystekniker i stor utsträckning för att kvantifiera hormon- eller hormonreceptorkoncentrationer i plasma eller i vävnad. Den ligand -bindande analysmetodik kvantifierades koncentrationen av hormon i testmaterialet genom att jämföra effekterna av testprovet till resultaten av olika mängder av kända protein ( ligand ).
Grunden för vilka ligandbindningsanalys har byggts är ett resultat av Karl Landsteiner 1945 och hans arbete med immunisering av djur genom produktion av antikroppar för vissa proteiner. Landsteiners arbete visade att immunanalysteknik gjorde det möjligt för forskare att analysera på molekylär nivå. Den första framgångsrika ligandbindningsanalysen rapporterades 1960 av Rosalyn Sussman Yalow och Solomon Berson . De undersökte bindningsinteraktionen för insulin och en insulin-specifik antikropp, förutom att utveckla den första radioimmunanalysen (RIA) för insulin. Dessa upptäckter gav värdefull information om både känsligheten och specificiteten hos proteinhormoner som finns i blodbaserade vätskor. Yalow och Berson fick Nobelpriset i medicin som ett resultat av deras framsteg. Genom utvecklingen av RIA-teknik har forskare kunnat gå bortom användningen av radioaktivitet, och istället använda flytande och fast fas, konkurrenskraftiga och immunoradiometriska analyser. Som ett direkt resultat av dessa monumentala fynd har forskare fortsatt utvecklingen av ligandbindningsanalyser inom många aspekter inom biologi, kemi och liknande.
Ansökningar
Ligandbindningsanalyser ger ett mått på de interaktioner som uppstår mellan två molekyler, såsom proteinbindningar, liksom graden av affinitet (svag, stark eller ingen koppling) för vilken reaktanterna binder samman. Väsentliga aspekter av bindningsanalyser inkluderar, men är inte begränsade till, koncentrationsnivån för reaktanter eller produkter ( se radioaktivt avsnitt ), bibehållande av jämviktskonstanten för reaktanter genom hela analysen och tillförlitligheten och giltigheten av länkade reaktioner. Även om bindningsanalyser är enkla, kan de inte ge information om huruvida föreningen som testas påverkar målets funktion eller inte.
Radioligandanalyser
Radioligander används för att mäta ligandbindningen till receptorer och bör helst ha hög affinitet, låg ospecifik bindning, hög specifik aktivitet för att detektera låga receptortätheter och receptorspecificitet.
Nivåer av radioaktivitet för en radioligand (per mol) kallas den specifika aktiviteten (SA), som mäts i Ci/mmol. Den faktiska koncentrationen av en radioligand bestäms av den specifika lagermix som radioliganden härstammar från (från tillverkarna.) Följande ekvation bestämmer den faktiska koncentrationen:
Mättnadsbindning
Mättnadsanalys används i olika typer av vävnader, såsom fraktioner av delvis renat plasma från vävnadshomogenat , celler transfekterade med klonade receptorer och celler som antingen är i odling eller isolerade före analys. Mättnadsbindningsanalys kan bestämma receptoraffinitet och densitet. Det kräver att den valda koncentrationen måste bestämmas empiriskt för en ny ligand.
Det finns två vanliga strategier som antas för denna typ av experiment: Ökning av mängden tillsatt radioligand samtidigt som den konstanta specifika aktiviteten och den konstanta koncentrationen av radioligand bibehålls, eller minskningen av den specifika aktiviteten för radioliganden på grund av tillsatsen av en omärkt ligand.
Scatchard tomt
En Scatchard -plot (Rosenthal -plot) kan användas för att visa radioligandaffinitet. I denna typ av tomt ritas förhållandet mellan bunden/fri radioligand mot den bundna radioliganden. Den lutning av linjen är lika med den negativa reciproka värdet av affinitetskonstanten (K). Linjens avlyssning med X -axeln är en uppskattning av Bmax. Scatchard -diagrammet kan standardiseras mot en lämplig referens så att det kan ske en direkt jämförelse av receptortäthet i olika studier och vävnader. Denna provdiagram indikerar att radioliganden binder med en enda affinitet. Om liganden skulle ha bundit till flera platser som har olika radioligandaffiniteter, skulle Scatchard -tomten istället ha visat en konkav linje.
Olinjär kurvmontering
Icke-linjära kurvpassningsprogram, såsom Equilibrium Binding Data Analysis (EBDA) och LIGAND, används för att beräkna uppskattningar av bindningsparametrar från mättnad och tävlingsbindande experiment. EBDA utför den första analysen, som omvandlar uppmätt radioaktivitet till molära koncentrationer och skapar Hill sluttningar och Scatchard transformationer från data. Analysen från EBDA kan sedan användas av LIGAND för att uppskatta en specifik modell för bindningen.
Tävlingsbindande
Tävlingsbindning används för att bestämma närvaron av selektivitet för en viss ligand för receptorsubtyper, vilket möjliggör bestämning av densitet och andel av varje undertyp i vävnaden. Tävlingskurvor erhålls genom att plotta specifik bindning, vilket är procentandelen av den totala bindningen, mot logkoncentrationen av den konkurrerande liganden. En brant tävlingskurva är vanligtvis en indikation på bindning till en enda population av receptorer, medan en grund kurva, eller en kurva med tydliga böjpunkter, är indikativ för flera populationer av bindningsställen.
Icke-radioaktiva bindningsanalyser
Trots de olika teknikerna som används för icke-radioaktiva analyser kräver de att ligander uppvisar liknande bindningskarakteristika som dess radioaktiva ekvivalent. Således kommer resultaten i både icke-radioaktiva och radioaktiva analyser att förbli konsekventa. En av de största skillnaderna mellan radioaktiva och icke-radioaktiva ligandanalyser gäller faror för människors hälsa. Radioaktiva analyser är skadliga genom att de producerar radioaktivt avfall; medan icke-radioaktiva ligandanalyser använder en annan metod för att undvika att producera giftigt avfall. Dessa metoder inkluderar, men är inte begränsade till, fluorescenspolarisering (FP), fluorescensresonansenergiöverföring (FRET) och ytplasmonresonans (SPR). För att mäta processen för ligand-receptorbindning kräver de flesta icke-radioaktiva metoder att märkning undviker att störa molekylära interaktioner.
Fluorescenspolarisering
Fluorescenspolarisering (FP) är synonymt med fluorescensanisotropi . Denna metod mäter förändringen i rotationshastigheten för en fluorescerande märkt ligand när den är bunden till receptorn. Polariserat ljus används för att excitera liganden och mängden ljus som avges mäts. Depolarisering av det utsända ljuset beror på att ligand är bunden (t.ex. till receptor). Om liganden är obunden kommer den att ha en stor depolarisering (ligand kan snurra snabbt och rotera ljuset). Om liganden är bunden resulterar den kombinerade större storleken i långsammare rotation och därför minskad depolarisering. En fördel med den här metoden är att den bara kräver ett märkningssteg. Denna metod är dock mindre exakt vid låga nanomolära koncentrationer.
Fluorescensresonans energiöverföring
Fluorescensresonans energiöverföring (FRET) använder energi som överförs mellan givaren och acceptormolekylerna som finns i närheten. FRET använder en fluorescensmärkt ligand, som med FP. Energioverföring inom FRET börjar med att spänna givaren. Den dipol-dipol växelverkan mellan donatorn och acceptorn molekylen överför energin från donatorn till acceptormolekylen. Om liganden är bunden till receptor-antikroppskomplexet, kommer acceptorn att avge ljus. Vid användning av FRET är det kritiskt att det finns ett avstånd mindre än 10 nm mellan acceptorn och givaren, förutom ett överlappande absorptionsspektrum mellan acceptor och donator, och att antikroppen inte stör eller blockerar ligandbindningsstället.
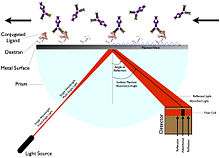
Ytplasmonresonans
Surface Plasmon Resonance (SPR) kräver inte märkning av liganden. Istället fungerar det genom att mäta förändringen i vinkeln vid vilket det polariserade ljuset reflekteras från en yta ( brytningsindex ). Vinkeln är relaterad till förändringen i massa eller tjocklek, såsom immobilisering av en ligand som förändrar resonansvinkeln, vilket ökar det reflekterade ljuset. Anordningen för vilken SPR härleds inkluderar ett sensorchip, en flödescell, en ljuskälla, ett prisma och en fast vinkel lägesdetektor.
Vätskefasbindningsanalyser
Immunutfällning
Vätskefasligandbindningsanalysen för immunutfällning (IP) är en metod som används för att rena eller berika ett specifikt protein, eller en grupp proteiner, med användning av en antikropp från en komplex blandning. Extraktet av störd vävnad eller celler blandas med en antikropp mot antigenet av intresse, vilket producerar antigen-antikroppskomplexet. När antigenkoncentrationen är låg kan antigen-antikroppskomplexutfällningen ta timmar eller till och med dagar och blir svårt att isolera den lilla mängd fällning som bildas.
Den enzymkopplade immunosorbentanalysen ( ELISA ) eller Western blotting är två olika sätt att det renade antigenet (eller flera antigener) kan erhållas och analyseras. Denna metod innefattar rening av ett antigen med hjälp av en fäst antikropp på en fast (pärlstav) bärare, såsom agarosharts. Det immobiliserade proteinkomplexet kan åstadkommas antingen i ett enda steg eller successivt.
IP kan också användas i samband med biosyntetisk radioisotopmärkning. Med hjälp av denna teknikkombination kan man avgöra om ett specifikt antigen syntetiseras av en vävnad eller av en cell.
Fastfasbindningsanalyser
Flerbrunnars tallrik
Flerbrunnsplattor är flera petriskålar inkorporerade i en behållare, med antalet enskilda brunnar från 6 till över 1536. Multivälplattanalyser är praktiska för att hantera nödvändiga doser och replikat. Det finns ett brett utbud av platttyper som har ett standardiserat fotavtryck, stödutrustning och mätsystem. Elektroder kan integreras i botten av plattorna för att fånga information som ett resultat av bindningsanalyserna. Bindningsreagensen immobiliseras på elektrodytan och kan sedan analyseras.
Flerbrunnsplattorna är tillverkade för att tillåta forskare att skapa och manipulera olika typer av analyser (dvs bioanalyser , immunanalyser , etc.) inom varje flerbrunnsplatta. På grund av variationen i plattformatering med flera brunnar är det inte ovanligt att artefakter uppstår. Artefakter beror på de olika miljöer som finns i de olika brunnarna på plattan, särskilt nära kanterna och mitten av brunnarna. Sådana effekter är kända som brunnseffekter, kanteffekter och platteffekter. Således betonas behovet av att placera analysdesign på korrekt sätt både inom och mellan varje platta.
Användning av flerbrunnsplattor är vanligt vid mätning av in vitro biologisk analysaktivitet eller mätning av immunreaktivitet genom immunanalyser. Artefakter kan undvikas genom att bibehålla plattformens enhetlighet genom att applicera samma dos av det specifika mediet i varje brunn, förutom att bibehålla atmosfärstryck och temperaturhastigheter för att minska luftfuktigheten.
Pärlbindning
On-Bead Ligand-bindningsanalyser är isoleringsmetoder för basproteiner, DNA/RNA eller andra biomolekyler som finns i odefinierade suspensioner och kan användas i flera biokromatografiska tillämpningar. Bioaffinligander är kovalent bundna till kiseldioxidpärlor med terminala negativt laddade silanolgrupper eller polystyrenkulor och används för isolering och rening av basproteiner eller adsorption av biomolekyler. Efter bindning utförs separationen genom centrifugering (densitetsseparation) eller genom magnetfältattraktion (endast för magnetiska partiklar). Pärlorna kan tvättas för att ge renheten av den isolerade molekylen innan den löses upp med jonbytesmetoder. Direkt analysmetoder baserade på enzymatisk/fluorescerande detektering (t.ex. HRP, fluorescerande färgämne) kan användas för bestämning eller kvantifiering av bundna biomolekyler.
Kolonnbindning
Filtrera
Filteranalyser är en fastfasligandbindningsanalys som använder filter för att mäta affiniteten mellan två molekyler. I en filterbindningsanalys används filtren för att fånga cellmembran genom att suga mediet genom dem. Denna snabba metod sker med en snabb hastighet där filtrering och återvinning kan uppnås för den hittade fraktionen. Tvättfilter med en buffert tar bort kvarvarande obundna ligander och andra närvarande ligander som kan tvättas bort från bindningsställena. De receptor-ligandkomplex som finns när filtret tvättas kommer inte att dissociera nämnvärt eftersom de kommer att fångas helt av filtren. Filtrets egenskaper är viktiga för varje jobb som utförs. Ett tjockare filter är användbart för att få en mer fullständig återvinning av små membranbitar, men kan kräva en längre tvättid. Det rekommenderas att förbehandla filtren för att fånga negativt laddade membranbitar. Blötläggning av filtret i en lösning som skulle ge filtret en positiv ytladdning skulle attrahera de negativt laddade membranfragmenten.
Cellbindning i realtid
I denna typ av analys följs bindningen av en ligand till celler över tiden. Den erhållna signalen är proportionell mot antalet ligander bundna till en målstruktur, ofta en receptor, på cellytan. Information om ligand-mål-interaktion erhålls från signalen förändras över tiden och kinetiska parametrar såsom associationshastighetskonstanten k a , dissociationshastigheten konstanten k d och affiniteten K D kan beräknas. Genom att mäta interaktionen direkt på celler behövs ingen isolering av målproteinet, vilket annars kan vara utmanande, särskilt för vissa membranproteiner. För att säkerställa att interaktionen med den avsedda målstrukturen mäts rekommenderas lämpliga biologiska kontroller, såsom celler som inte uttrycker målstrukturen.
Mätningar i realtid med etikettfria eller etikettbaserade metoder har använts för att analysera biomolekylära interaktioner på fixerade eller på levande celler.
Fördelen med att mäta ligand-receptorinteraktioner i realtid är att bindande jämvikt inte behöver uppnås för exakt bestämning av affiniteten.
Bindande specificitet
Effekterna av ett läkemedel är ett resultat av deras bindningsselektivitet med makromolekylära egenskaper hos en organism, eller affiniteten med vilken olika ligander binder till ett substrat. Mer specifikt ger specificiteten och selektiviteten för en ligand till dess respektive receptor forskare möjlighet att isolera och producera specifika läkemedelseffekter genom manipulation av ligandkoncentrationer och receptortätheter. Hormoner och signalsubstanser är viktiga endogena reglerande ligander som påverkar fysiologiska receptorer inom en organism. Läkemedel som verkar på dessa receptorer är otroligt selektiva för att producera erforderliga svar från signalmolekyler.
Specifik bindning avser bindningen av en ligand till en receptor, och det är möjligt att det finns mer än ett specifikt bindningsställe för en ligand. Icke -specifik bindning avser bindning av en ligand till något annat än dess utpekade receptor, såsom olika andra receptorer eller olika typer av transportörer i cellmembranet. Till exempel kan olika antagonister binda till flera typer av receptorer. När det gäller muskarinantagonister kan de också binda till histaminreceptorer. Sådana bindningsmönster anses tekniskt specifikt, eftersom ligandens destination är specifik för flera receptorer. Forskare kan dock inte vara fokuserade på sådana beteenden jämfört med andra bindande faktorer. Ändå är ospecifikt bindande beteende mycket viktig information att skaffa. Dessa uppskattningar mäts genom att undersöka hur en ligand binder till en receptor samtidigt som den reagerar på ett substitutmedel (antagonist) som förhindrar att specifik bindning uppstår.
Specifika bindningstyper till ligand- och receptorinteraktioner:
| Efterliknar endogena effekter | Hämmar endogena effekter |
|---|---|
| Agonist | Antagonist |
| Partiell agonist | Negativa antagonister (se: Invers agonist ) |
Teknologiska framsteg
Tekniker för ligandbindningsanalys fortsätter att avancera relaterat till ökningen av hastigheten och till att hålla kostnadseffektiva förfaranden samtidigt som man bibehåller och ökar noggrannheten och känsligheten. Vissa tekniska framsteg inkluderar nya bindningsreagens som alternativ till antikroppar, alternativa färgämneslösningar och mikroplattesystem och utveckling av en metod för att hoppa över filtreringssteget, vilket krävs i många ligandbindningsanalysprocesser.
En framträdande signalmolekyl i celler är kalcium , (Ca 2+ ), som kan detekteras med ett Fluo-4- acetoximetylfärgämne. Det binder till fria Ca 2+ joner, vilket i sin tur ökar fluorescensen av Fluo-4 AM något. Nackdelen med Fluo-4-färgämnesformuleringen är att ett tvättsteg krävs för att avlägsna extracellulärt färgämne, vilket kan ge oönskade bakgrundssignaler. Tvätt lägger till exempel extra stress på cellerna, och det tar tid, vilket förhindrar en analys i tid. Nyligen har en alternativ färglösning och mikroplattesystem utvecklats som kallas FLIPR® (fluorometrisk bildplåtläsare), som använder ett kalcium 3 -analysreagens som inte kräver ett tvättsteg. Som ett resultat kan förändring av färgämnesfluorescens ses i realtid utan fördröjning med hjälp av en excitatorisk laser och en laddningskopplad enhet .
Många ligandbindningsanalyser kräver ett filtreringssteg för att separera bundna och obundna ligander före screening. En metod som kallas Scintillation proximity assay (SPA) har nyligen utvecklats, vilket eliminerar detta annars avgörande steg. Det fungerar genom kristallgitterpärlor, som är belagda med ligandkopplingsmolekyler och fyllda med ceriumjoner . Dessa avger ljusskott när de stimuleras av en isotop, som enkelt kan mätas. Ligander radiomärks med antingen 3H eller 125I och släpps ut i analysen. Eftersom endast radioliganderna som direkt binder till pärlorna initierar en signal, stör inte fria ligander under screeningsprocessen.
Begränsningar
Av natur måste analyser utföras i en kontrollerad miljö in vitro, så denna metod ger inte information om receptorbindning in vivo. De erhållna resultaten kan bara verifiera att en specifik ligand passar en receptor, men analyser ger inget sätt att känna fördelningen av ligandbindande receptorer i en organism.
In vivo ligandbindning och receptordistribution kan studeras med Positron Emission Tomography (PET), som verkar genom induktion av en radionuklid i en ligand, som sedan släpps ut i kroppen av en undersökt organism. De radiomärkta liganderna placeras rumsligt av en PET -skanner för att avslöja områden i organismen med höga koncentrationer av receptorer.