Hexobarbital - Hexobarbital
 | |
 | |
| Kliniska data | |
|---|---|
| Handelsnamn | Hexobarbital, Hexobarbitone, Methylhexabital, Methexenyl, Evipal |
| ATC -kod | |
| Rättslig status | |
| Rättslig status | |
| Farmakokinetiska data | |
| Proteinbindning | 25% |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| CHEMBL | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard |
100.000.241 |
| Kemiska och fysiska data | |
| Formel | C 12 H 16 N 2 O 3 |
| Molmassa | 236,271 g · mol −1 |
| 3D -modell ( JSmol ) | |
| Kiralitet | Racemisk blandning |
| Densitet | 1,1623 g / cm 3 |
| Smältpunkt | 146,5 ° C (295,7 ° F) |
| Kokpunkt | 378,73 ° C (713,71 ° F) |
| Vattenlöslighet | 0,435 mg/ml (20 ° C) |
| |
| |
| (kontrollera) | |
Hexobarbital eller hexobarbiton , som säljs både i syra- och natriumsaltformer som Citopan , Evipan och Tobinal , är ett barbituratderivat med hypnotiska och lugnande effekter. Det användes på 1940- och 1950-talet som ett medel för att framkalla anestesi för kirurgi, liksom en snabbverkande, kortvarig hypnotisk för allmänt bruk, och har en relativt snabb effekt och kort varaktighet. Det användes också för att mörda kvinnliga fångar i koncentrationslägret Ravensbrück . Moderna barbiturater (som Thiopental ) har i hög grad ersatt användningen av hexobarbital som bedövningsmedel, eftersom de möjliggör bättre kontroll av anestesidjupet. Hexobarbital används fortfarande i viss vetenskaplig forskning.
Historia
Den kemiska klassen av barbiturater är en av de äldsta sedativa-hypnotiska medel som är kända, som går tillbaka från introduktionen av barbital i början av 1900-talet. I Östeuropa har hexobarbital (och andra barbiturater) regelbundet använts som droger av gravida kvinnor som försöker ta självmord. Hexobarbital trodde länge ha potentiellt teratogena och fetotoxiska effekter. Den FDA har klassificerat dem som graviditet kategori D eller C. Viss forskning tyder dock på att intag av hexobarbital kan orsaka medfödd abnormalitie.
Under andra världskriget var Herta Oberheuser en nazistisk läkare och dömd krigsförbrytare , och undersökte effekterna av hexobarbital. Experimenten utfördes mestadels på kvinnliga fångar i koncentrationslägret Ravensbrück .
Ansökan inom forskning
Hexobarbital används som narkotika i Hexobarbital Sleep Test (HST). HST identifierar gnagare med hög eller låg intensitet av mikrosomal oxidation, så snabb (FM) eller långsam metaboliserare (SM). Sömntestet används till exempel för att förutsäga mottaglighet och resistens mot PTSD eller för att bestämma effekten av giftiga föreningar på sömntiden.
Syntes
Hexobarbital kan syntetiseras genom reaktion av metyl (cyklohexen-1-yl) cyanoacetat med guanidin och natriummetylat . En hexobarbitalnatriumprekursor bildas sedan som kan metyleras med dimetylsulfat .
En annan väg för hexobarbital-syntes är reaktion av metylcyklohexenylcyanoättiksyraetylester med N-metylurea. Denna reaktion utförs i två steg, i det första steget tillsätts reaktanterna med tert-butylat i tert-butylalkohol vid 20-50 ° C. I det andra steget tillsätts väteklorid med etanol och vatten som lösningsmedel .
Reaktivitet
En av cytokrom P450 -isozymerna kodas av genen CYP2B1, där hexobarbital är substratet. Hexobarbital och isozymet kan bilda ett enzym-substrat-komplex genom en hydroxyleringsreaktion , som är involverad i metabolismen av xenobiotika . koncentrationen av hexobarbital spelar också en roll i oxygenas- och oxidasaktiviteten hos hepatiskt mikrosomalt cytokrom P450.
Triacetyloleandomycin, en hämmare för isozym CYP3A4, hämmar också hexobarbitalmetabolism och biologisk aktivitet, vilket indikerar ett nära samband mellan hexobarbital och cytokrom P450.
Giftighet
Handlingsmekanism
De biologiska effekterna av hexobarbital beror främst på dess förmåga att penetrera centrala nervsystemet . Hexobarbital kan förstärka GABA A -receptorer , som alla barbiturater . Det har visat sig genom åren att S (+) enantiomeren av hexobarbital förstärker GABA A- receptorer mer effektivt än dess R (-) enantiomer. När GABA binder till GABA A -receptorn öppnar kloridjonkanalerna så att kloridjoner kan strömma in i neuron . Detta orsakar en hyperpolarisering i neuronens membranpotential , vilket gör det mindre troligt att neuronen startar en åtgärdspotential . Därför är denna typ av receptor den viktigaste hämmande neurotransmittorreceptorn i däggdjurens centrala nervsystem. Som en GABA A -receptorpotentiator binder hexobarbital till barbituratbindningsstället lokaliserat i kloridjonkanalen och ökar därigenom bindningen av GABA och bensodiazepiner till deras respektive bindningsställe, allosteriskt. Dessutom orsakar hexobarbital kloridjonkanalöppningen till sitt längsta öppna tillstånd på 9 milli sekunder, vilket orsakar att den postsynaptiska inhiberande effekten förlängs. Till skillnad från GABA är glutamat den viktigaste excitatoriska signalsubstansen i däggdjurshjärnan. Förutom den inhiberande effekten blockerar hexobarbital, som alla barbiturater, AMPA -receptorer , kainatreceptorer , neurala acetylkolinreceptorer . Och framför allt hämmar barbiturater glutamatfrisättning genom att orsaka ett öppet kanalblock på P/Q -typ högspänningsaktiverade kalciumkanaler . Sammantaget orsakar hexobarbital en CNS-depressiv effekt på hjärnan genom att hämma glutamatfrisättningen och förstärka GABA-effekten.
Ämnesomsättning
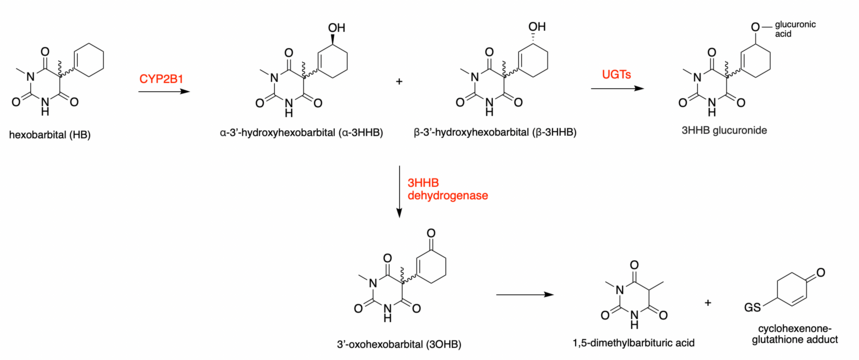
Levermetabolismen för hexobarbital (HB) kan delas upp i olika vägar som alla bildar olika metaboliter. S (+) enantiomeren av HB metaboliseras företrädesvis till β-3'-hydroxihexobarbital och R (-) enantiomeren metaboliseras företrädesvis till a-3'-hydroxihexobarbital, reaktionen är således stereoselektiv. Båda enantiomererna bildar emellertid både a- och p-isomerer. Totalt kan fyra enantiomerer för 3'-hydroxihexobarbital (3HHB) metaboliseras. Denna reaktion katalyseras av ett cytokrom P450 , CYP2B1. Alla 3HHB -isomerer som bildas kan genomgå ytterligare metabolism via glukuronidering eller dehydrogenering .
Om 3HHB undergår en glukuronidering reaktion, via UDP-glukoronosyl transferaser (UGT: er), är den lätt utsöndras. 3HHB kan också genomgå dehydrogenering och bilda en reaktiv keton , 3'-oxohexobarbital (3OHB). Den biotransformation av 3HHB in 3OHB är via enzymet 3HHB dehydrogenas (3HBD), en NAD (P) + länkad oxidation. Detta enzym är en del av aldo-keto reduktas (AKR) superfamilj. Hos människor har 3HBD en hög preferens för NAD + . Dessa reaktioner är också stereospecifika, R (-) -konformationen bildar företrädesvis 3OHB eftersom 3HBD har den högsta aktiviteten för denna enantiomer i både alfa- och beta-form.
Nya bevis bevisade den ytterligare metabolismen av 3OHB till 1,5-dimetylbarbitursyra och en cyklohexenon-glutationaddukt. Detta biotransformationssteg sker via en epoxid-diolmekanism. Bildningen av en reaktiv epoxid leder till bildandet av de nämnda föreningarna.
Experiment på människa indikerade att huvudmetaboliterna var 3HHB, 3OHB och 1,5-dimetylbarbitursyra.
Hälsoeffekter hos människan
Exkretion
Plasmahalveringstiden för HB hos människa uppskattas till 222 ± 54 min. Clearance av HB skiljer sig mellan de två enantiomererna och människans ålder. Clearance för R (-) enantiomeren är nästan 10 gånger större än clearance för S (+) enantiomer. Clearance i genomsnitt hos äldre, jämfört med unga, är långsammare. Utsöndring sker huvudsakligen via urin, för de tre huvudmetaboliterna. Cyklohexenon -glutationadduktet utsöndras i gallan.
Symtom
En berusning hos en människa med hexobarbital kan leda till tröghet, inkoordination, svårigheter att tänka, talets långsamhet, felaktig bedömning, dåsighet eller koma, ytlig andning och svindlande. I vissa allvarliga fall kan koma och död vara resultatet av en överdos.
Effekter på djur
Följande tabell presenterar studierna om effekterna av hexobarbital på djur, som gjordes under 1900 -talet. De flesta av dessa studier visade att hexobarbital har kortsiktiga toxicitetseffekter och att det kan framkalla hypnotiska effekter hos möss, kaniner och grodor.
| Organism | Testtyp | Rutt | Dos | Effekt | Referens |
|---|---|---|---|---|---|
| råtta | LD50 | intraperitoneal | 330 mg/kg (330 mg/kg) | ||
| råtta | LDLo | subkutan | 400 mg/kg (400 mg/kg) | ||
| mus | LD50 | oral | 468 mg/kg (468 mg/kg) | Förlängning av sovtiden | |
| mus | LD50 | intraperitoneal | 270 mg/kg (270 mg/kg) | Förlängning av sömntid och orörlighet, som förstärks av L-asparagin | |
| mus | LDLo | subkutan | 250 mg/kg (250 mg/kg) | ||
| mus | LD50 | intravenös | 133 mg/kg (133 mg/kg) | Beteende: somnolens (allmän deprimerad aktivitet) | Archives Internationales de Pharmacodynamie et de Therapie., 163 (11), 1966 |
| mus | LDLo | intrapleural | 340 mg/kg (340 mg/kg) | Hypnotisk effekt, som förstärks av 4,5-dihydro-6-metyl-2 [2- (4-pyridyl) -etyl] -3-pyridazinon (U-320) | |
| mus | LD50 | parenteral | 160 mg/kg (160 mg/kg) | Farmakologi och toxikologi. Engelsk översättning av FATOAO., 20 (569), 1957 | |
| kanin | LDLo | oral | 1200 mg/kg (1200 mg/kg) | Ultrakorta skådespelare; hypnotisk effekt
Minimal dödlig dos: 1200 mg/kg Minimal hypnotisk dos: 15 mg/kg |
|
| kanin | LDLo | intravenös | 80 mg/kg (80 mg/kg) | Ultrakorta skådespelare; hypnotisk effekt
Minimal dödlig dos: 80 mg/kg Minimal hypnotisk dos: 15 mg/kg |
|
| kanin | LDLo | rektal | 175 mg/kg (175 mg/kg) | Ultrakorta skådespelare; hypnotisk effekt
Minimal dödlig dos: 175 mg/kg Minimal hypnotisk dos: 15 mg/kg |
|
| groda | LDLo | intraperitoneal | 30 mg/kg (30 mg/kg) | ||
| groda | LD50 | parenteral | 148 mg/kg (148 mg/kg) | Farmakologi och toxikologi. Engelsk översättning av FATOAO., 20 (569), 1957 |
I populärkulturen
I Agatha Christies 1937 -mysteriekort på bordet används Hexobarbital tillsammans med Veronal för att framkalla överdosering. Det kallas av Hercule Poirot som både N-metyl-cyklo-hexenyl-metyl-malonylurea och Evipan.