Buffert-lösning - Buffer solution
En buffertlösning (mer specifikt, pH -buffert eller vätejon buffert) är en vattenhaltig lösning bestående av en blandning av en svag syra och dess konjugatbas , eller vice versa. Dess pH förändras väldigt lite när en liten mängd stark syra eller bas tillsätts till den. Buffertlösningar används som ett sätt att hålla pH vid ett nästan konstant värde i en mängd olika kemiska tillämpningar. I naturen finns det många system som använder buffring för pH -reglering. Till exempel används bikarbonatbuffertsystemet för att reglera blodets pH , och bikarbonat fungerar också som en buffert i havet .
Principer för buffring

Buffertlösningar motstår pH -förändring på grund av en jämvikt mellan den svaga syran HA och dess konjugerade bas A - :
- HA ⇌ H + + A -
När någon stark syra tillsätts till en jämviktsblandning av den svaga syran och dess konjugerade bas , tillsätts vätejoner (H + ) och jämvikten förskjuts till vänster, i enlighet med Le Châteliers princip . På grund av detta ökar vätejonkoncentrationen med mindre än den förväntade mängden för den tillsatta mängden stark syra. På samma sätt minskar vätejonkoncentrationen med mindre alkali tillsatt blandningen med mindre än den förväntade mängden för den tillsatta mängden alkali. Effekten illustreras av simulerad titrering av en svag syra med p K a = 4,7. Den relativa koncentrationen av icke -dissocierad syra visas i blått och dess konjugerade bas i rött. PH ändras relativt långsamt i buffertområdet, pH = p K a ± 1, centrerat vid pH = 4,7, där [HA] = [A - ]. Vätejonkoncentrationen minskar med mindre än den förväntade mängden eftersom det mesta av den tillsatta hydroxidjonen förbrukas i reaktionen
- OH - + HA → H 2 O + A -
och bara lite förbrukas i neutraliseringsreaktionen (vilket är reaktionen som resulterar i en ökning av pH)
- OH - + H + → H 2 O.
När syran är mer än 95% deprotoniserad stiger pH snabbt eftersom det mesta av den tillsatta alkalien förbrukas i neutraliseringsreaktionen.
Buffertkapacitet
Buffertkapacitet är ett kvantitativt mått på resistansen mot förändring av pH i en lösning som innehåller ett buffertmedel med avseende på en förändring av syra- eller alkalikoncentrationen. Det kan definieras enligt följande:
var är en oändlig mängd tillsatt bas, eller
där är en oändlig mängd tillsatt syra. pH definieras som −log 10 [H + ], och d (pH) är en oändlig förändring av pH.
Med antingen definition buffertkapaciteten för en svag syra HA med dissociationskonstanten K en kan uttryckas som
där [H + ] är koncentrationen av vätejoner, och är den totala koncentrationen av tillsatt syra. K w är jämviktskonstanten för vattnets autoprotolys , lika med 1,0 x 10 -14 . Observera att i lösning H + existerar som hydroniumjonen H 3 O + , och ytterligare vattenbildning av hydroniumjonen har försumbar effekt på dissociationsjämvikt, utom vid mycket hög syrakoncentration.
Denna ekvation visar att det finns tre regioner med ökad buffertkapacitet (se figur).
- I kurvens centrala område (färgat grönt på tomten) är den andra termen dominerande och Buffertkapaciteten stiger till ett lokalt maximalt vid pH = pK a . Höjden på denna topp beror på värdet av pK a . Buffertkapaciteten är försumbar när koncentrationen [HA] av buffertmedlet är mycket liten och ökar med ökande koncentration av buffertmedlet. Vissa författare visar bara denna region i diagram över buffertkapacitet.Buffertkapaciteten sjunker till 33% av maxvärdet vid pH = p K a ± 1, till 10% vid pH = p K a ± 1,5 och till 1% vid pH = p K a ± 2. Av denna anledning är det mest användbara området är ungefär p K a ± 1. När du väljer en buffert för användning vid ett specifikt pH bör den ha ap K ett värde så nära som möjligt till det pH -värdet.
- Med starkt sura lösningar, pH mindre än cirka 2 (rött färgat på tomten), dominerar den första termen i ekvationen och buffertkapaciteten stiger exponentiellt med sjunkande pH: Detta beror på det faktum att andra och tredje termerna blir försumbara vid mycket lågt pH. Denna term är oberoende av närvaron eller frånvaron av ett buffertmedel.
- Med starkt alkaliska lösningar, pH mer än cirka 12 (färgat blått på tomten), dominerar den tredje termen i ekvationen, och buffertkapaciteten stiger exponentiellt med stigande pH: Detta beror på det faktum att de första och andra termerna blir försumbara vid mycket högt pH. Denna term är också oberoende av närvaron eller frånvaron av ett buffertmedel.
Buffertapplikationer
PH -värdet för en lösning som innehåller ett buffertmedel kan endast variera inom ett snävt område, oavsett vad som annars kan finnas i lösningen. I biologiska system är detta en förutsättning för att enzymer ska fungera korrekt. Till exempel i mänskligt blod en blandning av kolsyra (H
2CO
3) och bikarbonat (HCO-
3) finns i plasmafraktionen ; detta utgör den viktigaste mekanismen för att upprätthålla blodets pH mellan 7,35 och 7,45. Utanför detta snäva område (7,40 ± 0,05 pH -enhet), utvecklas acidos och alkalos metaboliska tillstånd snabbt, vilket i slutändan leder till döden om rätt buffertkapacitet inte snabbt återställs.
Om pH -värdet för en lösning stiger eller sjunker för mycket, minskar effektiviteten av ett enzym i en process, känd som denaturering , som vanligtvis är irreversibel. Majoriteten av biologiska prover som används i forskning förvaras i en buffertlösning, ofta fosfatbuffrad saltlösning (PBS) vid pH 7,4.
Inom industrin används buffertmedel vid jäsningsprocesser och vid fastställande av rätt villkor för färgämnen som används i färgning av tyger. De används också i kemisk analys och kalibrering av pH -mätare .
Enkla buffertmedel
Buffertagent p K a Användbart pH -område Citronsyra 3,13, 4,76, 6,40 2.1–7.4 Ättiksyra 4.8 3,8–5,8 KH 2 PO 4 7.2 6.2–8.2 CHES 9.3 8.3–10.3 Borat 9.24 8,25–10,25
För buffertar i sura områden kan pH -värdet justeras till ett önskat värde genom tillsats av en stark syra, såsom saltsyra, till det särskilda buffertmedlet. För alkaliska buffertar kan en stark bas såsom natriumhydroxid tillsättas. Alternativt kan en buffertblandning framställas av en blandning av en syra och dess konjugerade bas. Exempelvis kan en acetatbuffert tillverkas av en blandning av ättiksyra och natriumacetat . På liknande sätt kan en alkalisk buffert framställas av en blandning av basen och dess konjugerade syra.
"Universella" buffertblandningar
Genom att kombinera substanser med p K a värden skiljer sig åt med endast två eller mindre och justering av pH, kan erhållas ett brett område av buffertar. Citronsyra är en användbar komponent i en buffertblandning för att det har tre p K a värden, separerade med mindre än två. Buffertintervallet kan utökas genom att lägga till andra buffertmedel. Följande blandningar ( McIlvaines buffertlösningar ) har ett buffertintervall av pH 3 till 8.
0,2 M Na 2 HPO 4 (ml) 0,1 M citronsyra (ml) pH 20.55 79,45 3.0 38,55 61.45 4.0 51,50 48,50 5.0 63.15 36,85 6,0 82,35 17.65 7,0 97,25 2,75 8.0
En blandning innehållande citronsyra , monokaliumfosfat , borsyra och dietylbarbitursyra kan göras för att täcka pH -området 2,6 till 12.
Andra universella buffertar är Carmody -bufferten och Britton – Robinson -bufferten , som utvecklades 1931.
Vanliga buffertföreningar som används inom biologi
För effektivt intervall, se Buffertkapacitet ovan.
| Vanligt namn (kemiskt namn) | Strukturera |
p K a , 25 ° C |
Temp. effekt, dpH/d T(K −1 ) |
Mol. vikt |
|---|---|---|---|---|
|
TAPS , ([tris (hydroximetyl) metylamino] propansulfonsyra) |
 |
8,43 | −0,018 | 243,3 |
|
Bicin , (2- (bis (2-hydroxietyl) amino) ättiksyra) |
 |
8,35 | −0,018 | 163.2 |
|
Tris , (tris (hydroximetyl) aminometan eller 2-amino-2- (hydroximetyl) propan-1,3-diol) |
 |
8,07 | −0,028 | 121,14 |
|
Tricine , (N- [tris (hydroximetyl) metyl] glycin) |
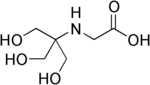 |
8,05 | −0,021 | 179,2 |
|
TAPSO , (3- [N-tris (hydroximetyl) metylamino] -2-hydroxipropansulfonsyra) |
 |
7,635 | 259,3 | |
|
HEPES , (4- (2-hydroxietyl) -1-piperazineetansulfonsyra) |
 |
7,48 | −0,014 | 238,3 |
|
TES , (2-[[1,3-dihydroxi-2- (hydroximetyl) propan-2-yl] amino] etansulfonsyra) |
 |
7.40 | −0,020 | 229,20 |
|
MOPS , (3- (N-morfolino) propansulfonsyra) |
 |
7.20 | −0,015 | 209,3 |
|
RÖR , (piperazin-N, N′-bis (2-etansulfonsyra)) |
 |
6,76 | -0,008 | 302.4 |
|
Kakodylat , (dimetylarsensyra) |
 |
6.27 | 138,0 | |
|
MES , (2- (N-morfolino) etansulfonsyra) |
 |
6.15 | −0,011 | 195,2 |
Beräkning av buffertens pH
Monoprotiska syror
Skriv först ner jämviktsuttrycket
- HA ⇌ A - + H +
Detta visar att när syran dissocieras produceras lika stora mängder vätejon och anjon. Jämviktskoncentrationerna för dessa tre komponenter kan beräknas i en ICE -tabell (ICE står för "initial, change, equilibrium").
ICE -bord för en monoprotinsyra [HA] [A - ] [H + ] I C 0 0 y C - x x x E C 0 - x x x + y
Den första raden, märkt I , anges de ursprungliga villkoren: koncentrationen av syra är C 0 , inledningsvis odissocierad, så koncentrationerna av A - och H + skulle vara noll; y är den initiala koncentrationen av tillsatt stark syra, såsom saltsyra. Om stark alkali, såsom natriumhydroxid, tillsätts, kommer y att ha ett negativt tecken eftersom alkali tar bort vätejoner från lösningen. Den andra raden, märkt C för "förändring", anger de förändringar som uppstår när syran dissocierar. Syrakoncentrationen minskar med en mängd - x , och koncentrationerna av A - och H + ökar båda med en mängd + x . Detta följer av jämviktsuttrycket. Den tredje raden, märkt E för "jämvikt", lägger ihop de två första raderna och visar koncentrationerna vid jämvikt.
För att hitta x , använd formeln för jämviktskonstanten när det gäller koncentrationer:
Ersätt koncentrationerna med värdena som finns på sista raden i ICE -tabellen:
Förenkla till
Med specifika värden för C 0 , K a och y kan denna ekvation lösas för x . Om vi antar att pH = −log 10 [H + ], kan pH beräknas som pH = −log 10 ( x + y ).
Polyprotiska syror

Polyprotiska syror är syror som kan förlora mer än en proton. Konstanten för dissociation av den första protonen kan betecknas som K a1 , och konstanterna för dissociation av successiva protoner som K a2 , etc. Citronsyra är ett exempel på en polyprotinsyra H 3 A, eftersom den kan förlora tre protoner.
Stegvis dissociationskonstanter Jämvikt Citronsyra H 3 A ⇌ H 2 A - + H + p K a1 = 3,13 H 2 A - ⇌ HA 2− + H + p K a2 = 4,76 HA 2− ⇌ A 3− + H + p K a3 = 6,40
När skillnaden mellan successiva p K a -värden är mindre än cirka 3, finns det överlappning mellan pH -värdet för artens existens i jämvikt. Ju mindre skillnaden, desto mer överlappning. När det gäller citronsyra är överlappningen omfattande och lösningar av citronsyra buffras över hela intervallet pH 2,5 till 7,5.
Beräkning av pH med en polyprotinsyra kräver en speciationsberäkning . När det gäller citronsyra innebär detta lösningen av de två ekvationerna för massbalans:
C A är det analytiska koncentrationen av syran, C H är det analytiska koncentrationen av tillsatta vätejoner, β q är de kumulativa associationskonstant . K W är konstant för vattnets autoprotolys . Det finns två icke-linjära samtidiga ekvationer i två okända mängder [A 3− ] och [H + ]. Många datorprogram är tillgängliga för att göra denna beräkning. Speciationsdiagrammet för citronsyra togs fram med programmet HySS.
OBS Numreringen av kumulativa, övergripande konstanter är motsatsen till numreringen av de stegvisa dissociationskonstanterna.
- Förhållandet mellan kumulativa associeringskonstant (β) -värden
och stegvisa dissociationskonstanta (K) -värden för en tribasinsyra.
Jämvikt Relation A 3− + H + ⇌ AH 2+ Logg β 1 = pk a3 A 3− + 2H + ⇌ AH 2 + Logg β 2 = pk a2 + pk a3 A 3− + 3H + ⇌ AH 3 Logg β 3 = pk a1 + pk a2 + pk a3
Kumulativa associeringskonstanter används i datorprogram för allmänna ändamål, t.ex. den som används för att erhålla speciationsdiagrammet ovan.
Se även
- Henderson – Hasselbalch ekvation
- Buffertagent
- Good's buffertar
- Common-ion-effekt
- Metalljonbuffert
- Mineral redox buffert
Referenser
externa länkar
"Biologiska buffertar" . REACH -enheter.





![{\ displaystyle \ beta = 2.303 \ left ([{\ ce {H+}}]+{\ frac {T _ {{\ ce {HA}}} K_ {a} [{\ ce {H+}}]}} {( K_ {a}+[{\ ce {H+}}])^{2}}}+{\ frac {K _ {\ text {w}}} {[{\ ce {H+}}]}} \ höger) ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf8b7c2c34d12f8145df3299a061593aaa76643a)


![{\ displaystyle \ beta \ approx 2.303 {\ frac {T _ {{\ ce {HA}}} K_ {a} [{\ ce {H+}}]} {(K_ {a}+[{\ ce {H+} }])^{2}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec0e3ba9d065bfb822350b58e375d1f4630c6235)


![{\ displaystyle K _ {\ text {a}} = {\ frac {[{\ ce {H+}}] [{\ ce {A-}}]} {[{\ ce {HA}}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/89cb17f8ab679cc14a5d23888ed230c1a71b7384)


![{\ displaystyle {\ begin {align} C _ {{\ ce {A}}} & = [{\ ce {A^3-}}]+\ beta _ {1} [{\ ce {A^3-} }] [{\ ce {H+}}]+\ beta _ {2} [{\ ce {A^3-}}] [{\ ce {H+}}]^{2}+\ beta _ {3} [{\ ce {A^3-}}] [{\ ce {H+}}]^{3}, \\ C _ {{\ ce {H}}} & = [{\ ce {H+}}]+ \ beta _ {1} [{\ ce {A^3-}}] [{\ ce {H+}}]+2 \ beta _ {2} [{\ ce {A^3-}}] [{\ ce {H+}}]^{2} +3 \ beta _ {3} [{\ ce {A^3-}}] [{\ ce {H+}}]^{3} -K _ {\ text {w }} [{\ ce {H+}}]^{-1}. \ end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/611bf20542dfc1dbd8256ee6465883f1534f527a)