Aprotinin - Aprotinin
 | |
| Kliniska data | |
|---|---|
| Andra namn | Trasylol, bovin trypsinhämmare i bukspottkörteln |
| AHFS / Drugs.com | Monografi |
| graviditet kategori |
|
| beroendet ansvar |
Ingen |
| Vägar administrering |
Intravenös |
| ATC-kod | |
| Rättslig status | |
| Rättslig status | |
| Farmakokinetiska data | |
| Biotillgänglighet | 100% ( intravenöst ) |
| Identifierare | |
| |
| CAS-nummer | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| ECHA InfoCard |
100.029.983 |
| Kemiska och fysiska data | |
| Formel | C 284 H 432 N 84 O 79 S 7 |
| Molmassa | 6 511, 51 g · mol −1 |
|
| |
Läkemedlet aprotinin (Trasylol, tidigare Bayer och nu Nordic Group-läkemedel), är en liten protein bovin pankreatisk trypsininhibitor ( BPTI ), eller basisk trypsinhämmare av bovin bukspottkörtel , som är en antifibrinolytisk molekyl som hämmar trypsin och relaterade proteolytiska enzymer . Under handelsnamnet Trasylol användes aprotinin som ett läkemedel som administrerades genom injektion för att minska blödningen under komplex kirurgi , såsom hjärt- och leverkirurgi. Dess huvudsakliga effekt är bromsningen av fibrinolys , processen som leder till nedbrytning av blodproppar. Syftet med dess användning var att minska behovet av blodtransfusioner under operationen, såväl som organskador på grund av hypotoni (lågt blodtryck) till följd av markant blodförlust. Läkemedlet togs tillfälligt ut över hela världen 2007 efter att studier antydde att dess användning ökade risken för komplikationer eller död detta bekräftades genom uppföljningsstudier. Trasylolförsäljningen avbröts i maj 2008 förutom mycket begränsad forskningsanvändning. I februari 2012 återkallade Europeiska läkemedelsmyndighetens (EMA) vetenskapliga kommitté sin tidigare ståndpunkt angående aprotinin och har rekommenderat att suspensionen upphävs. Nordic blev distributör av aprotinin 2012.
Kemi
| Bovin trypsinhämmare i bukspottkörteln | |||||||
|---|---|---|---|---|---|---|---|
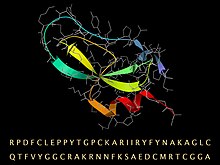 BPTI-sekvens, med sin vikta 3D-struktur representerad av ett band för den sekundära strukturen och en stickmodell (grå) för ryggraden och sidokedjorna.
| |||||||
| Identifierare | |||||||
| Organism | |||||||
| Symbol | PTI | ||||||
| Entrez | 404172 | ||||||
| FBF | 4PTI Fler strukturer | ||||||
| RefSeq (mRNA) | NM_001001554 | ||||||
| RefSeq (Prot) | NP_001001554 | ||||||
| UniProt | P00974 | ||||||
| Övriga uppgifter | |||||||
| Kromosom | 13: 75.02 - 75.03 Mb | ||||||
| |||||||
Aprotinin är en monomer (enkelkedjig) globulär polypeptid härrörande från bovin lungvävnad. Den har en molekylvikt på 6512 och består av 16 olika typer av aminosyror ordnade i en kedja med 58 rester långa som viks till en stabil, kompakt tertiär struktur av den "lilla SS-rika" typen, innehållande 3 disulfider, en tvinnad β-hårnål och en C-terminal a-helix .
Aminosyrasekvensen för bovint BPTI är RPDFC LEPPY TGPCK ARIIR YFYNA KAGLC QTFVY GGCRA KRNNF KSAED CMRTC GGA. Det finns 10 positivt laddade lysin (K) och arginin (R) sidokedjor och endast 4 negativa aspartat (D) och glutamater (E), vilket gör proteinet starkt basiskt , vilket står för det basiska i dess namn. (På grund av den vanliga källorganismen kallas BPTI ibland för bovin trypsinhämmare i bukspottkörteln.)
Molekylens höga stabilitet beror på de 3 disulfidbindningarna som länkar de 6 cysteinmedlemmarna i kedjan (Cys5-Cys55, Cys14-Cys38 och Cys30-Cys51). Den långa, basiska lysinkedjan 15 på den exponerade öglan (längst upp till vänster i bilden) binder mycket tätt i specificitetsfickan vid det aktiva stället för trypsin och hämmar dess enzymatiska verkan. BPTI syntetiseras som en längre föregångarsekvens, som viks upp och sedan klyvs i den mogna sekvensen som ges ovan.
BPTI är den klassiska medlemmen av proteinfamiljen av serinproteashämmare av Kunitz-typ . Dess fysiologiska funktioner inkluderar skyddshämning av det huvudsakliga matsmältningsenzymet trypsin när små mängder produceras genom klyvning av trypsinogenprekursorn under lagring i bukspottkörteln.
Mekanism för läkemedelsåtgärd
Aprotinin är en konkurrerande hämmare av flera serinproteaser , specifikt trypsin , chymotrypsin och plasmin i en koncentration av cirka 125 000 IE / ml och kallikrein vid 300 000 IE / ml. Dess verkan på kallikrein leder till hämning av bildandet av faktor XIIa . Som ett resultat hämmas både den inneboende koagulationsvägen och fibrinolysen. Dess verkan på plasmin bromsar oberoende fibrinolys.
Läkemedelseffektivitet
Vid hjärtkirurgi med hög risk för signifikant blodförlust minskade aprotinin avsevärt blödning, dödlighet och sjukhusvistelse. Gynnsamma effekter rapporterades också vid ortopedisk kirurgi med hög risk. Vid levertransplantation överskuggades de första fördelarna av nytta av farhågor om toxicitet.
I en metaanalys som utfördes 2004 minskade transfusionskraven med 39% vid kranskärlskirurgi (CABG). Vid ortopedisk kirurgi bekräftades också en minskning av blodtransfusioner.
Drogsäkerhet
Det har funnits oro för aprotinins säkerhet. Anafylaksi (en allvarlig allergisk reaktion) uppträder med en hastighet av 1: 200 vid första gången, men serologi (mätning av antikroppar mot aprotinin i blodet) utförs inte i praktiken för att förutsäga anafylaxrisk eftersom den korrekta tolkningen av dessa tester är svår.
Trombos , förmodligen från överaktiv inhibering av det fibrinolytiska systemet, kan förekomma i högre takt, men fram till 2006 fanns det begränsade bevis för denna association. På samma sätt, medan biokemiska mått på njurfunktion visade sig ibland försämras, fanns det inga bevis för att detta påverkade resultatet i hög grad. En studie som utfördes på hjärtkirurgiska patienter som rapporterades 2006 visade att det verkligen fanns en risk för akut njursvikt , hjärtinfarkt och hjärtsvikt samt stroke och encefalopati . Studieförfattarna rekommenderar äldre antifibrinolytika (som tranexaminsyra ) där dessa risker inte dokumenterades. Samma grupp uppdaterade sina uppgifter 2007 och visade liknande resultat.
I september 2006 fick Bayer AG fel av FDA för att under vittnesmål inte avslöjade förekomsten av en beställd retrospektiv studie av 67 000 patienter, av vilka 30 000 fick aprotinin och resten andra anti-fibrinolytika. Studien drog slutsatsen att aprotinin hade större risker. FDA varnade för studien av en av de inblandade forskarna. Även om FDA utfärdade ett bekymmerförklaring ändrade de inte sin rekommendation att läkemedlet kan gynna vissa delpopulationer hos patienter. I en rådgivande folkhälsouppdatering av den 3 oktober 2006 rekommenderade FDA att "läkare överväger att begränsa användningen av trasylol till de situationer där den kliniska nyttan av minskad blodförlust är nödvändig för medicinsk behandling och uppväger de potentiella riskerna" och noggrant övervakar patienter.
Den 25 oktober 2007 utfärdade FDA ett uttalande beträffande randomiserad studie med "BART-bevarande med antifibrinolytika" (BART) i en hjärtoperationspopulation. De preliminära resultaten tyder på att aprotinin jämfört med andra antifibrinolytiska läkemedel (epsilon-aminokapronsyra och tranexaminsyra) kan öka risken för dödsfall. Den 29 oktober 2006 utfärdade Food and Drug Administration en varning om att aprotinin kan ha allvarlig njure- och kardiovaskulär toxicitet. Producenten Bayer rapporterade till FDA att ytterligare observationsstudier visade att det kan öka risken för dödsfall, allvarlig njurskada, hjärtsvikt och stroke. FDA varnade kliniker att överväga att begränsa användningen till de situationer där den kliniska nyttan av minskad blodförlust är avgörande för medicinsk hantering och uppväger de potentiella riskerna. Den 5 november 2007 meddelade Bayer att man drar tillbaka aprotinin på grund av en kanadensisk studie som visade att den ökade risken för dödsfall när den användes för att förhindra blödning under hjärtkirurgi.
Två studier som publicerades i början av 2008, som båda jämförde aprotinin med aminokapronsyra , fann att dödligheten ökade med 32 respektive 64%. En studie fann en ökad risk i behov av dialys och revaskularisering.
Inga fall av överföring av aprotinin från bovin spongiform encefalopati har rapporterats, även om läkemedlet togs ut i Italien på grund av rädsla för detta.
In vitro-användning
Små mängder aprotinin kan tillsättas till rör med draget blod för att möjliggöra laboratoriemätning av vissa snabbt nedbrytade proteiner, såsom glukagon .
I cellbiologi används aprotinin som en enzymhämmare för att förhindra nedbrytning av proteiner under lys eller homogenisering av celler och vävnader.
Aprotinin kan märkas med fluoresceinisotiocyanat. Konjugatet behåller sina antiproteolytiska och kolhydratbindande egenskaper och har använts som ett fluorescerande histokemiskt reagens för färgning av glykokonjugat (slemämnen) som är rika på uron- eller sialinsyror.
Historia
Ursprungligen kallad "kallikrein inaktivator", aprotinin isolerades först från ko- parotidkörtlar 1930. och oberoende som en trypsininhibitor från bovin bukspottkörtel 1936. Det renades från bovin lung 1964. Eftersom det hämmar bukspottkörtelnzymer, användes det initialt i behandlingen för akut pankreatit , där förstörelse av körteln genom sina egna enzymer anses vara en del av patogenesen. Dess användning vid större operationer började på 1960-talet.
BPTI är ett av de mest grundligt studerade proteinerna när det gäller strukturell biologi , experimentell och beräkningsdynamik, mutagenes och vikningsväg . Det var en av de tidigaste proteinkristallstrukturerna som löstes 1970 i Robert Hubers laboratorium , och dess substratliknande interaktionsläge dechiffrerade i samband med bovint trypsinkomplex 1974. Det blev senare också känt som det första proteinet som hade dess struktur bestämdes av NMR-spektroskopi , i Kurt Wuthrichs laboratorium vid ETH i Zürich i början av 1980-talet.
Eftersom det är ett litet, stabilt protein vars struktur hade bestämts med hög upplösning 1975, var det den första makromolekylen av vetenskapligt intresse som simulerades med användning av molekylär dynamikberäkning 1977 av J. Andrew McCammon och Bruce Gelin i Karplus- gruppen vid Harvard. Den studien bekräftade det då överraskande faktum i NMR-arbetet att även välpackade aromatiska sidokedjor i det inre av ett stabilt protein kan vända ganska snabbt (mikrosekund till millisekund tidsskala). Hastighetskonstanter bestämdes av NMR för väteutbytet av enskilda peptid-NH-grupper längs kedjan, allt från för snabbt för att mäta på den mest exponerade ytan till många månader för de mest begravda vätebundna grupperna i mitten av β-arket, och dessa värden korrelerar också ganska bra med graden av rörelse som ses i dynamiksimuleringarna.
BPTI var viktigt i utvecklingen av kunskap om processen för proteinvikning , självmontering av en polypeptidkedja till ett specifikt arrangemang i 3D. Problemet med att uppnå korrekta parningar mellan de 6 Cys-sidokedjorna visade sig vara särskilt svårt för de två begravda, nära varandra SS nära BPTI-kedjeterminalerna, vilket krävde en icke-naturlig mellanprodukt för att vika den mogna sekvensen in vitro (det var senare upptäckte att föregångarsekvensen viks lättare in vivo ). BPTI var omslagsbilden på en proteinvikande kompendiumvolym av Thomas Creighton 1992.
Aktuella resultat
En vetenskaplig studie på råttor rapporterade att behandling med aprotinin förhindrar störningar av blod-hjärnbarriären under C. neoformans- infektionen. En annan studie i cellkulturer antyder att läkemedlet hämmar SARS-CoV-2-replikering.
