Ronald Breslow - Ronald Breslow
Ronald Breslow | |
|---|---|
 | |
| Född |
Ronald Charles D. Breslow
14 mars 1931 |
| Död | 25 oktober 2017 (86 år) |
| Alma mater | Harvard Universitet |
| Utmärkelser |
ACS Award in Pure Chemistry (1966) NAS Award in Chemical Sciences (1989) National Medal of Science (1991) Priestley Medal (1999) Othmer Gold Medal (2006) Perkin Medal (2010) AIC Gold Medal (2014) |
| Vetenskaplig karriär | |
| Fält | Kemi |
| Institutioner | Columbia University |
| Doktorandrådgivare | Robert Burns Woodward |
| Doktorander | |
| Andra anmärkningsvärda studenter | Anthony Czarnik |
Ronald Charles D. Breslow (14 mars 1931 - 25 oktober 2017) var en amerikansk kemist från Rahway, New Jersey . Han var universitetsprofessor vid Columbia University , där han var baserad på institutionen för kemi och ansluten till institutionerna för biologiska vetenskaper och farmakologi; han hade också varit på fakulteten vid institutionen för kemiteknik. Han hade undervisat i Columbia sedan 1956 och var tidigare ordförande för universitetets kemiavdelning.
Liv och karriär
Breslow föddes i Rahway, New Jersey, son till Gladys (Fellows) och Alexander E. Breslow. Han var intresserad av design och syntes av nya molekyler med intressanta egenskaper och studier av dessa egenskaper. Exempel innefattar cyklopropenyl katjon , det enklaste aromatiska systemet och den första aromatiska föreningen framställd med annat än sex elektroner i en ring. Hans banbrytande bidrag inkluderar den korrekta platsen för reaktivitet för tiamindifosfat i enzymer som främjar dekarboxylering av pyruvat - baserat på hans banbrytande användning av proton -NMR med små molekylanaloger - och den hastighetsförbättring som tillhandahålls genom bindning till cyklodextriner producerade stora teman för moderna studier i modern organisk och biologisk kemi. Han upptäckte också histondeacetylashämmaren SAHA ( Vorinostat ) som är FDA-godkänd för behandling av kutant T-celllymfom.
Breslow tog sin BA, MA och Ph.D. från Harvard University , där hans doktorandrådgivare var RB Woodward . Bland Breslows tidigare doktorand studenter är Robert Grubbs , som vann Nobelpriset i kemi 2005, och Doug La Follette , utrikesminister i Wisconsin.
Breslow fick många utmärkelser och utmärkelser, inklusive National Medal of Science 1991, Welch Award , Arthur C. Cope Award (1987), NAS Award i kemiska vetenskaper , American Chemical Society's ACS Award in Pure Chemistry (1966), den Othmer Gold Medal (2006), Priestley Medal och 2014 American Institute of Chemists (AIC) guldmedalj. Som ett erkännande av hans klassrumskunskaper tilldelade Columbia honom både sitt Mark Van Doren -pris och sitt stora lärarpris. Han tjänstgjorde som ordförande för ACS 1996 och ledde kemidivisionen vid National Academy of Sciences från 1974 till 1977. 1997 utsågs han till en av de 75 bästa bidragsgivarna till de senaste 75 årens kemiska företag av Chemical & Engineering News . Han var Myron L. Benders framstående föreläsare vid Northwestern University 1999. Ronald Breslow Award for Achievement in Biomimetic Chemistry, som årligen delas ut av ACS , har fått sitt namn.
Han var medlem i National Academy of Sciences , American Academy of Arts and Sciences , European Academy of Sciences och American Philosophical Society . Han är också en utländsk medlem i Royal Society och hedersmedlem i många andra vetenskapliga organ runt om i världen.
År 2012 drogs hans dokument "Evidence for the Likely Origin of Homochirality in Amino Acids, Sugars and Nucleosides on Prebiotic Earth" tillbaka från Journal of the American Chemical Society på grund av upphovsrättsliga oro, vilket ledde till en debatt om självplagiat och skillnad mellan en personlig recension och en uppsats.
Syntes av cyklopropenylkatjon
Först beredd genom att blanda 3-klorcyklopropen med antimonpentaklorid , aluminiumtriklorid eller silverfluorborat . Carbon-13 NMR visar singlets med en J C – H- kopplingskonstant på 265 ± 1 Hz. Författarna föreslår att denna kopplingskonstant är antydande att C -H -bindningen är 53% s karaktär . Det övergripande bindningsramverket består sedan av sp -orbitaler till alla väten, två sp 3 -orbitaler för varje sigmabinding och en p -orbital för π -ramverket.
D-Orbital-konjugering
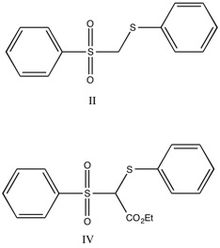
Det hade föreslagits att dubbla bindningar av karbanion-sulfon inte kommer att visa aromatisk karaktär-främst som ett resultat av noderna i d-orbitaler. Raka kedjeanaloger valdes baserat på jämförbar syra, kombinerat med tidigare studier som indikerar att steriska effekter i stort sett är försumbara. De raka kedjeanalogerna visas nedan.
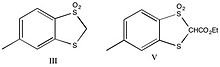
Förening II behandlades med dimetoxietan/D2O/trietylamin och befanns vara helt deutererad vid återhämtning. Den deutererade föreningen behandlades sedan med butyllitium i eter, med dimetoxietan och 2N HCl som regenererade utgångsmaterialet. Den cykliska analogen (III, visad nedan) deutererades på samma sätt, och tillsats av deutererad I, följt av kylning för att regenerera den protonerade formen, analyserades med NMR. Det fanns en protontopp, och den visade sig jämvikta mellan föreningar II och III, vilket indikerar att föreningar hade liknande surhet. Av detta resultat drog forskarna slutsatsen att förening III inte var aromatisk, eftersom stabiliserande effekt av aromatisitet på anjonen borde öka surheten hos föreningen.
Esteranalogerna framställdes (IV och V) och befanns vara tillräckligt sura för titrering. Föreningarna titrerades under kväve med 0,2 N NaOH med en Beckman-modell GS-mätare med en E-2-elektrod. Förening IV befanns ha en pKa på 8,9 +/- 0,1, medan förening V hade en pKa på 11,1 +/- 0,2.
Origins of Homochirality on Prebiotic Earth
Livets väsentliga byggstenar (aminosyror och nyckelsocker-ribos och deoxiribos) kan existera i en av två former-L eller D. Men livet har utvecklats så att de allra flesta aminosyrorna är L och sockret är D. Om aminosyrorna och sockerarterna i livet var racemiska (bestående av både L och D), då skulle proteiner, DNA och RNA inte anta en väldefinierad konformation, vilket resulterade i förlust av funktion. Frågan om hur denna preferens först inträffade har förbryllat forskare i flera år medan flera teorier har föreslagits; det finns fortfarande inget klart svar. Det finns växande bevis för att den kirala preferensen kom från yttre rymden när forskare upptäckte α-metylaminosyror inuti Murchison-meteoriten som har ett litet enantiomeriskt överskott (ee) för L-konformationen. Dessa a-metylaminosyror tros komma från yttre rymden som ett resultat av deras höga överflöd av 13C och deuterium. Vidare finns a-metylaminosyror i allmänhet inte närvarande i markkemi. En vanlig kritik är att dessa aminosyror inte skulle klara de höga temperaturerna när de kom in i jordens atmosfär när meteoriten kraschade in i planeten. Aminosyrorna har dock hittats inuti meteoriten, där meteoriten fungerar som en isolator. Till skillnad från vanliga aminosyror kan α-metylaminosyror inte racemisera genom enolisering på en evolutionär tidsskala, som visas nedan.
Det finns emellertid stor debatt om hur L-konformationen av a-metylaminosyror valdes ut för. Den mest accepterade teorin är att rätt cirkulärt polariserat ljus i yttre rymden (något) selektivt förstörde D -konformationen. I teorin producerar synkrotroner ljus av motsatt hand (höger och vänster) ovanför och under cirkulationsplanet. Detta har visats i experiment på jorden. Teorin fortsätter då att neutronstjärnor kan fungera som synkrotroner-med högerpolariserat ljus som pekar i vår riktning mot universum och vänsterpolariserat ljus som pekar i motsatt riktning. Andra astronomer hävdar dock att polarisationen endast sker i det infraröda området, som bara har tillräckligt med energi för att orsaka molekylära vibrationer och sträcker sig långt från att kunna förstöra molekyler. Ett andra problem med L α-metylaminosyrorna är hur man genererar enantiomeriskt rena aminosyror från det lilla överskottet. Frågan illustreras i figuren nedan.
Observera att ovanstående produkt kan protoneras från båda sidorna med samma sannolikhet. Den slutliga syran genereras genom hydrolys av iminen.
Det är värt att notera att alfa-ketosyran tros bildas av en Strecker-liknande reaktion, som visas nedan.
Från figur 5 ser vi att L-alfa-metylaminosyrorna inte direkt fungerar som en kiralstyrande grupp för att generera den normala L-aminosyran. Forskare hoppades att en andra molekyl av alfa-mety-aminosyran skulle kunna fungera som en styrande grupp, men de fann att D-enantiomeren var något gynnad när endast L-alfa-metylaminosyror var närvarande. Figuren nedan visar hur D enantiomeren gynnas.
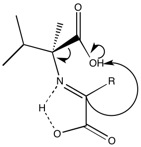
När forskare tillsatte koppar till reaktionen var den resulterande produkten L enantiomeren. Meteorer har visat sig innehålla både koppar och zink, vilket motiverar forskarnas användning av metallen. När zink användes i samma reaktion bildades emellertid inte L -enantiomeren företrädesvis. Baserat på beräkningsberäkningar bildar kopparen ett kvadratiskt plan komplex (visas nedan) och sterika underlättar protonering för att generera L -aminosyran.
När ett litet enantiomeriskt överskott föreligger kan lösligheten hos den rena och racemiska kristallen manipuleras för att generera stora ee: er av den rena enantiomeren. Om vi definierar vissa lösligheter som sådana: KL = [L] representerar lösligheten för den rena enantiomeren KDL = [D] [L] representerar löslighetsprodukten av den racemiska blandningen så att [D] = KDL/[L] Vi kan sedan definiera förhållandet mellan [L]/[D] = [L] 2/KDL När båda enantiomererna är närvarande bildas en racemisk kristallstruktur-den är dock lägre i energi, har en högre smältpunkt och är mindre löslig än enantiomeriskt ren kristallstruktur. Som ett resultat, när ett litet överskott av en enantiomer är närvarande, kan ee amplifieras genom avdunstning av lösningsmedel, vilket får racemat att fälla ut. Forskare har kunnat börja med en ee på 1% L och slutligen sluta med 95: 5 lösning av L: D. Resultaten som diskuterats ovan (särskilt synkrotronargumentet) fick Breslow att föreslå att D -aminosyror och L -sockerarter kan generera liv i andra delar av universum.