Radikal (kemi) - Radical (chemistry)
Inom kemi är en radikal en atom , molekyl eller jon som har minst en oparad valenselektron . Med några undantag gör dessa oparade elektroner radikaler mycket kemiskt reaktiva . Många radikaler dimeriserar spontant . De flesta organiska radikaler har kort livstid.
Ett anmärkningsvärt exempel på en radikal är hydroxylradikalen (HO · ), en molekyl som har en oparad elektron på syreatomen. Två andra exempel är triplet syre och triplet karben ( ꞉ CH
2) som har två oparade elektroner.
Radikaler kan genereras på ett antal sätt, men typiska metoder involverar redoxreaktioner . Joniserande strålning , värme, elektriska urladdningar och elektrolys är kända för att producera radikaler. Radikaler är mellanprodukter i många kemiska reaktioner, mer än vad som framgår av de balanserade ekvationerna.
Radikaler är viktiga vid förbränning , atmosfärisk kemi , polymerisation , plasmakemi , biokemi och många andra kemiska processer. En majoritet av de naturliga produkterna genereras av radikalgenererande enzymer. I levande organismer reglerar radikalerna superoxid och kväveoxid och deras reaktionsprodukter många processer, såsom kontroll av kärlton och därmed blodtryck. De spelar också en nyckelroll i förmedlingsmetabolismen för olika biologiska föreningar. Sådana radikaler kan till och med vara budbärare i en process som kallas redox -signalering . En radikal kan fastna i en lösningsmedelsbur eller vara bunden på annat sätt.
Bildning
Radikaler är antingen (1) bildade av spinnparade molekyler eller (2) från andra radikaler. Radikaler bildas från spinnparade molekyler genom homolys av svaga bindningar eller elektronöverföring, även känd som reduktion. Radikaler bildas av andra radikaler genom substitutions-, additions- och eliminationsreaktioner.
Radikal bildning från spinnparade molekyler
Homolys
Homolys gör två nya radikaler från en spinnparad molekyl genom att bryta en kovalent bindning och lämna vart och ett av fragmenten med en av elektronerna i bindningen. Eftersom brytning av en kemisk bindning kräver energi, sker homolys under tillsats av värme eller ljus. Den bindning dissociation energi associerad med homolys beror på stabiliteten hos en given förening, och några svaga bindningar kan homolyze vid relativt lägre temperaturer.
Vissa homolysreaktioner är särskilt viktiga eftersom de fungerar som en initiator för andra radikala reaktioner. Ett sådant exempel är homolys av halogener, som sker under ljus och fungerar som drivkraft för radikala halogeneringsreaktioner.
En annan anmärkningsvärd reaktion är homolysen av dibenzoylperoxid, vilket resulterar i bildandet av två bensoyloxiradikaler och fungerar som en initiator för många radikala reaktioner.
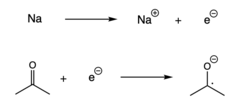
Minskning
Radikaler kan också bildas när en enda elektron läggs till en spinnparad molekyl, vilket resulterar i en elektronöverföring. Denna reaktion, även kallad reduktion, sker vanligtvis med en alkalimetall som donerar en elektron till en annan spinnparad molekyl.
Radikal bildning från andra radikaler
Abstraktion
Väteabstraktion beskriver när en väteatom avlägsnas från en vätegivarmolekyl (t.ex. tenn eller kiselhydrid) med dess ena elektron. Abstraktion ger en ny radikal och en ny spinnparad molekyl. Detta skiljer sig från homolys, vilket resulterar i två radikaler från en enda spinnparad molekyl och inte innehåller en radikal som dess reaktant. Väteabstraktion är en grundläggande process inom radikal kemi eftersom den fungerar som det sista förökningssteget i många kemiska reaktioner och omvandlar kolradikaler till stabila molekyler. Figuren till höger visar en radikal abstraktion mellan en bensoyloxiradikal och en vätebromidmolekyl, vilket resulterar i produktion av en bensoesyramolekyl och en bromradikal.
Tillägg
Radikaladdition beskriver när en radikal läggs till en spinnparad molekyl för att bilda en ny radikal. Figuren till höger visar tillsatsen av en bromradikal till en alken. Radikal tillsats följer Anti -Markovnikov -regeln , där substituenten sätts till den mindre substituerade kolatomen.
Eliminering
Radikal eliminering kan ses som motsatsen till radikal tillsats. Vid radikal eliminering bryts en instabil radikal förening ned i en spinnparad molekyl och en ny radikal förening. Nedan visas ett exempel på en radikal eliminationsreaktion, där en bensoyloxiradikal bryts ner till en fenylradikal och en koldioxidmolekyl.
Stabilitet
Stabilitet hos organiska radikaler

Även om organiska radikaler generellt sett är stabila i praktiken är deras existens praktiskt taget bara övergående eftersom de tenderar att dimerisera. Vissa är ganska långlivade. I allmänhet stabiliseras organiska radikaler av någon eller alla dessa faktorer: närvaro av elektronegativitet, delokalisering och steriskt hinder. Föreningen 2,2,6,6-tetrametylpiperidinyloxyl illustrerar kombinationen av alla tre faktorerna. Det är ett kommersiellt tillgängligt fast ämne som, förutom att det är magnetiskt, beter sig som en normal organisk förening.
Elektronnegativitet
Organiska radikaler är i sig elektronbristiga, alltså ju större elektronegativitet för atomen som den oparade elektronen befinner sig på, desto mindre stabil är radikalen. Mellan kol, kväve och syre, till exempel, är kol det mest stabila och syret det minst stabila.
Elektronegativitet påverkar också stabiliteten hos kolatomer i olika hybridiseringar. Större s-karaktär korrelerar till högre elektronegativitet hos kolatomen (på grund av närheten av s orbitaler till kärnan), och ju större elektronegativitet desto mindre stabil är en radikal. Sp-hybridiserade kol (50% s-karaktär) bildar de minst stabila radikalerna jämfört med sp3-hybridiserade kol (25% s-karaktär) som bildar de mest stabila radikalerna.
Delokalisering
Delokaliseringen av elektroner över strukturen hos en radikal, även känd som dess förmåga att bilda en eller flera resonansstrukturer, gör att elektronbristen kan spridas över flera atomer, vilket minimerar instabilitet. Delokalisering sker vanligtvis i närvaro av elektrondonerande grupper, såsom hydroxylgrupper (-OH), etrar (-OR), intilliggande alkener och aminer (-NH2 eller -NR) eller elektronuttagande grupper, såsom C = O eller C≡N.
Delokaliseringseffekter kan också förstås med molekylär orbitalteori som en lins, närmare bestämt genom att undersöka den intramolekylära interaktionen mellan den oparade elektronen med en donationsgrupps elektronpar eller den tomma π* orbitalen i en elektronuttagande grupp i form av en molekylär orbital diagram. HOMO för en radikal är enskilt ockuperat, därför kallas orbitalet lämpligen SOMO, eller Singly-Occupied Molecular Orbital. För en elektrondonerande grupp interagerar SOMO med det ensamma paret med lägre energi för att bilda en ny lägre energi fylld bindnings-orbital och en enskilt fylld ny SOMO, högre i energi än originalet. Medan energin hos den oparade elektronen har ökat, uppväger energiförminskningen hos det ensamma paret som bildar det nya bindningsbanan ökningen av energi för den nya SOMO, vilket resulterar i en nettonedgång av molekylens energi. Därför hjälper elektrondonerande grupper att stabilisera radikaler.
Med en grupp som istället är elektronuttagande interagerar SOMO sedan med den tomma π* orbitalen. Det finns inga elektroner som upptar den högre energibana som bildas, medan en ny SOMO bildas som har lägre energi. Detta resulterar i en lägre energi och högre stabilitet hos de radikala arterna. Både donerande grupper och tillbakadragande grupper stabiliserar radikaler.
En annan välkänd om än svagare form av delokalisering är hyperkonjugering . Inom radikal kemi stabiliseras radikaler genom hyperkonjugering med angränsande alkylgrupper. Donationen av sigma (σ) CH -bindningar till de delvis tomma radikala orbitalerna hjälper till att differentiera stabiliteten hos radikaler på tertiära, sekundära och primära kolatomer. Tertiära kolradikaler har tre σ CH -bindningar som donerar, sekundära radikaler bara två och primära radikaler bara en. Därför är tertiära radikaler de mest stabila och primära radikalerna de minst stabila.
Steriskt hinder

Enkelt sagt, ju större steriskt hinder desto svårare är det för reaktioner att äga rum, och den radikala formen gynnas som standard. Jämför till exempel den väteabstraherade formen av N-Hydroxypiperidin med molekylen TEMPO . TEMPO, eller (2,2,6,6-tetrametylpiperidin-1-yl) oxyl, hindras alltför steriskt av de ytterligare metylgrupperna för att reagera vilket gör den stabil nog att säljas kommersiellt i sin radikala form. N-Hydroxypiperidin har emellertid inte de fyra metylgrupperna som hindrar vägen för en reagerande molekyl så strukturen är instabil.
Smidiga H-atomgivare
Stabiliteten hos många (eller de flesta) organiska radikaler är inte indikeras av deras isolability men manifesteras i deras förmåga att fungera som givare av H . . Denna egenskap återspeglar en försvagad bindning till väte, vanligtvis OH men ibland NH eller CH. Detta beteende är viktigt eftersom dessa H . givare fungerar som antioxidanter inom biologi och handel. Illustrativt är a-tokoferol ( vitamin E ). Själva tokoferolradikalen är otillräckligt stabil för isolering, men modermolekylen är en mycket effektiv H-atomgivare. CH -bindningen försvagas i trifenylmetyl (trityl) derivat.

Oorganiska radikaler
Ett stort antal oorganiska radikaler är stabila och i själva verket isolerbara. Exempel inkluderar de flesta övergångsmetallkomplex på första raden.
När det gäller huvudgruppsradikaler är den mest förekommande radikalen i universum också den mest förekommande kemikalien i universum, H · . De flesta huvudgruppsradikaler är dock inte isolerbara , trots deras inneboende stabilitet. Väteradikaler till exempel kombinera ivrigt till formulär H 2 . Kväveoxid (NO) är välkänt exempel på en isolerbar oorganisk radikal. Fremys salt (kaliumnitrosodisulfonat, (KSO 3 ) 2 NO) är ett besläktat exempel. Många tiazylradikaler är kända, trots begränsad omfattning av π -resonansstabilisering .
Många radikaler kan ses som produkterna för att bryta kovalenta bindningar genom homolys . De homolytiska bindning dissociation energier , vanligen förkortat "Δ H °" är ett mått på bindningsstyrka. Uppdelning H 2 in 2H · , till exempel, kräver ett Δ H ° av 435 k J · mol -1 , medan klyvning Cl 2 i två Cl · kräver en Δ H ° av 243 kJ · mol -1 . För svaga bindningar kan homolys induceras termiskt. Starka bindningar kräver fotoner med hög energi eller till och med lågor för att framkalla homolys.
Diradicals
Diradicals är molekyler som innehåller två radikala centra. Dioxygen (O 2 ) är det främsta exemplet på en stabil diradical. Singlet syre , det lägsta energin icke-radikala tillståndet av dioxygen, är mindre stabilt än diradical på grund av Hunds regel om maximal multiplicitet . Den relativa stabiliteten för syradiradiken beror främst på den spin-förbjudna karaktären av triplett-singlet-övergången som krävs för att den ska ta tag i elektroner, dvs " oxidera". Det diradiska tillståndet av syre resulterar också i dess paramagnetiska karaktär, vilket demonstreras av dess attraktion mot en yttre magnet. Diradicals kan också förekomma i metall-oxo-komplex , vilket låter sig användas för studier av spin-förbjudna reaktioner i övergångsmetallkemi . Carbener i deras triplettillstånd kan ses som diradicals centrerade på samma atom, medan dessa vanligtvis är mycket reaktiva persistenta karben är kända, med N-heterocykliska karben som det vanligaste exemplet.
Triplet karben och nitrener är diradicals. Deras kemiska egenskaper skiljer sig från egenskaperna hos deras singletanaloger.
Förekomst av radikaler
Förbränning
En välkänd radikal reaktion är förbränning . Den syremolekylen är en stabil diradikal , representeras bäst av · OO · . Eftersom snurrar för elektronerna är parallella, är denna molekyl stabil. Medan jordtillståndet för syre är detta oreaktiva spin-oparade ( triplet ) diradical, är ett extremt reaktivt spin-parat ( singlet ) tillstånd tillgängligt. För att förbränning ska ske måste energibarriären mellan dessa övervinnas. Denna barriär kan övervinnas av värme, som kräver höga temperaturer. Triplet-singlet-övergången är också " förbjuden ". Detta utgör en ytterligare barriär för reaktionen. Det betyder också att molekylärt syre är relativt oreaktivt vid rumstemperatur utom i närvaro av en katalytisk tung atom som järn eller koppar.
Förbränning består av olika radikala kedjereaktioner som singlettradikalen kan initiera. Den brandfarlighet av ett givet material beror starkt på koncentrationen av radikaler, som måste erhållas innan initierings- och propageringsreaktioner dominerar ledande till förbränning av materialet. När det brännbara materialet har förbrukats dominerar avslutningsreaktionerna igen och lågan dör ut. Som anges förändrar främjande av föröknings- eller avslutningsreaktioner brandfarligheten. Till exempel, eftersom bly i sig själv inaktiverar radikaler i bensin-luftblandningen, tillsattes tetraetyl-bly en gång till bensin. Detta förhindrar att förbränningen startar på ett okontrollerat sätt eller i oförbrända rester ( motorn knackar ) eller för tidig tändning ( förantändning ).
När ett kolväte bränns är ett stort antal olika syreradikaler inblandade. Initialt bildas hydroperoxylradikal (HOO). Dessa reagerar sedan vidare för att ge organiska hydroperoxider som bryts upp i hydroxylradikaler (HO).
Polymerisation
Många polymerisationsreaktioner initieras av radikaler. Polymerisering innebär att en initial radikal tillsätts till icke-radikal (vanligtvis en alken) för att ge nya radikaler. Denna process är grunden för den radikala kedjereaktionen . Polymerisationstekniken innefattar metoden genom vilken den initierande radikalen införs. Till exempel kan metylmetakrylat (MMA) polymeriseras för att producera poly (metylmetakrylat) (PMMA - plexiglas eller Perspex) via en upprepande serie radikala additionssteg :
Nyare radikalpolymerisationsmetoder är kända som levande radikalpolymerisation . Varianter inkluderar reversibel additionsfragmenteringskedjeöverföring ( RAFT ) och atomöverföringsradikalpolymerisation ( ATRP ).
Att vara en förhärskande radikal, O 2 reagerar med många organiska föreningar för att generera radikaler tillsammans med hydroperoxiden radikal. Torkande oljor och alkydfärger härdar på grund av radikal tvärbindning initierad av syre från atmosfären.
Atmosfäriska radikaler
Den vanligaste radikalen i den nedre atmosfären är molekylärt syre. Fotodissociation av källmolekyler producerar andra radikaler. I den nedre atmosfären produceras viktiga radikaler genom fotodissociering av kvävedioxid till en syreatom och kväveoxid (se ekv. 1 nedan), som spelar en nyckelroll i smogbildning - och fotodissociationen av ozon för att ge upphetsade syreatom O (1D) (se ekv. 1. 2 nedan). Netto- och avkastningsreaktionerna visas också ( ekv. 1. 3 respektive ekv. 1. 4 ).
-
( ekv. 1. 1 )
-
( ekv. 1. 2 )
-
( ekv. 1. 3 )
-
( ekv. 1. 4 )
I den övre atmosfären är fotodissociationen av normalt oreaktiva klorfluorkolväten (CFC) med ultraviolett strålning från solen en viktig radikalkälla (se ekv. 1 nedan). Dessa reaktioner ger klorradikal, Cl · , vilket katalyserar omvandlingen av ozon till O 2 , vilket sålunda underlättar ozonutarmnings ( ekv 2. 2. - . Ekv 2. 4 nedan).
-
( ekv. 2. 1 )
-
( ekv. 2. 2 )
-
( ekv. 2. 3 )
-
( ekv. 2. 4 )
-
( ekv. 2. 5 )
Sådana reaktioner orsakar utarmning av ozonskiktet , särskilt eftersom kloradikalen är fri att engagera sig i en annan reaktionskedja; Följaktligen har användningen av klorfluorkolväten som köldmedium begränsats.
Inom biologin

Radikaler spelar viktiga roller i biologin. Många av dessa är nödvändiga för livet, såsom intracellulärt dödande av bakterier genom fagocytiska celler som granulocyter och makrofager . Radikaler är inblandade i cell signalering processer, känd som redox signalering . Till exempel ger radikal attack av linolsyra en serie 13-hydroxioktadekadiensyra och 9-hydroxioktadekadiensyra , som kan verka för att reglera lokaliserade vävnadsinflammatoriska och/eller läkningssvar, smärtuppfattning och spridning av maligna celler. Radikala attacker mot arakidonsyra och docosahexaensyra ger ett liknande men bredare utbud av signalprodukter.
Radikaler kan också vara inblandade i Parkinsons sjukdom , senil och läkemedelsinducerad dövhet , schizofreni och Alzheimers . Det klassiska friradikalsyndromet, järnlagringssjukdomen hemokromatos , är typiskt förknippat med en konstellation av fria radikalerelaterade symtom inklusive rörelsestörning, psykos, hudpigmentära melaninavvikelser , dövhet, artrit och diabetes mellitus. Den fri-radikal-teorin av åldrande föreslår att radikaler ligger bakom åldrandeprocessen själv. På samma sätt antyder processen med mitohormes att upprepad exponering för radikaler kan förlänga livslängden.
Eftersom radikaler är nödvändiga för livet har kroppen ett antal mekanismer för att minimera radikalinducerad skada och reparera skador som uppstår, såsom enzymerna superoxiddismutas , katalas , glutationperoxidas och glutationreduktas . Dessutom spelar antioxidanter en nyckelroll i dessa försvarsmekanismer. Dessa är ofta de tre vitaminerna, vitamin A , vitamin C och vitamin E och polyfenolantioxidanter . Dessutom finns det goda bevis som tyder på att bilirubin och urinsyra kan fungera som antioxidanter för att neutralisera vissa radikaler. Bilirubin kommer från nedbrytningen av röda blodkroppar , medan urinsyra är en nedbrytningsprodukt av puriner . För mycket bilirubin kan dock leda till gulsot , vilket så småningom kan skada centrala nervsystemet, medan för mycket urinsyra orsakar gikt .
Reaktiva syrearter
Reaktiva syrearter eller ROS är arter som superoxid , väteperoxid och hydroxylradikal , vanligtvis associerade med cellskador. ROS bildar som en naturlig biprodukt av den normala metabolismen av syre och har viktiga roller i cellsignalering. Två viktiga syre-centrerade radikaler är superoxid och hydroxylradikal . De härrör från molekylärt syre under reducerande förhållanden. Men på grund av deras reaktivitet kan samma radikaler delta i oönskade sidreaktioner som resulterar i cellskador. Överdrivna mängder av dessa radikaler kan leda till cellskada och död , vilket kan bidra till många sjukdomar som cancer , stroke , hjärtinfarkt , diabetes och större störningar. Många former av cancer antas vara resultatet av reaktioner mellan radikaler och DNA , vilket potentiellt kan leda till mutationer som kan påverka cellcykeln negativt och potentiellt leda till malignitet. Några av symptomen på åldrande, såsom åderförkalkning, tillskrivs också radikal inducerad oxidation av kolesterol till 7-ketokolesterol. Förutom radikaler bidrar till alkohol -inducerad leverskada, kanske mer än alkohol i sig. Radikaler som produceras av cigarett rök är inblandade i inaktivering av alfa-1-antitrypsin i lungan . Denna process främjar utvecklingen av emfysem .
Oxybenzone har visat sig bilda radikaler i solljus och kan därför också vara associerat med cellskador. Detta inträffade bara när det kombinerades med andra ingredienser som vanligen finns i solskyddsmedel, som titanoxid och oktylmetoxycinnamat .
ROS angriper den fleromättade fettsyran , linolsyra , för att bilda en serie 13-hydroxioktadekadiensyra och 9-hydroxioktadekadiensyra produkter som fungerar som signalmolekyler som kan utlösa svar som motverkar vävnadsskada som orsakade deras bildning. ROS attackerar andra fleromättade fettsyror, t.ex. arakidonsyra och docosahexaensyra , för att producera en liknande serie av signalprodukter.
Historia och nomenklatur

Fram till slutet av 1900 -talet användes ordet "radikal" i kemi för att indikera alla anslutna grupper av atomer, till exempel en metylgrupp eller en karboxyl , oavsett om det var en del av en större molekyl eller en molekyl på egen hand. Kvalet "gratis" behövdes sedan för att specificera det obundna fallet. Efter de senaste nomenklaturrevisionerna kallas nu en del av en större molekyl för en funktionell grupp eller substituent , och "radikal" innebär nu "fri". Den gamla nomenklaturen kan dock fortfarande finnas i vissa böcker.
Begreppet radikal användes redan när den nu föråldrade radikalteorin utvecklades. Louis-Bernard Guyton de Morveau introducerade frasen "radikal" 1785 och frasen användes av Antoine Lavoisier 1789 i hans Traité Élémentaire de Chimie . En radikal identifierades sedan som rotbas för vissa syror (det latinska ordet "radix" som betyder "rot"). Historiskt sett användes termen radikal i radikal teori också för bundna delar av molekylen, särskilt när de förblir oförändrade i reaktioner. Dessa kallas nu funktionella grupper . Till exempel beskrivs metylalkohol som bestående av en metyl "radikal" och en hydroxyl "radikal". Inte heller är radikaler i modern kemisk mening, eftersom de är permanent bundna till varandra och inte har några oparade, reaktiva elektroner; de kan emellertid observeras som radikaler i masspektrometri när de bryts isär genom bestrålning med energiska elektroner.
I ett modernt sammanhang den första organiska (kolhaltiga) -radikal identifierats var trifenylmetyl radikal , (Ci- 6 H 5 ) 3 C · . Denna art upptäcktes av Moses Gomberg år 1900. År 1933 föreslog Morris S. Kharasch och Frank Mayo att fria radikaler var ansvariga för antimarkovnikov-tillsats av vätebromid till allylbromid .
Inom de flesta kemiska områden hävdar den historiska definitionen av radikaler att molekylerna har elektron -noll -noll. Men inom områden inklusive spektroskopi , kemisk reaktion och astrokemi är definitionen något annorlunda. Gerhard Herzberg , som vann Nobelpriset för sin forskning om radikalernas elektronstruktur och geometri, föreslog en lösare definition av fria radikaler: "alla övergående (kemiskt instabila) arter (atom, molekyl eller jon)". Den viktigaste punkten i hans förslag är att det finns många kemiskt instabila molekyler som har noll spinn, såsom C 2 , C 3 , CH 2 och så vidare. Denna definition är mer bekväm för diskussioner om övergående kemiska processer och astrokemi; därför föredrar forskare inom dessa områden att använda denna lösa definition.
Avbildning i kemiska reaktioner
I kemiska ekvationer betecknas radikaler ofta med en punkt som placeras omedelbart till höger om atomsymbolen eller molekylformeln enligt följande:
Radikala reaktionsmekanismer använder enkla huvudpilar för att skildra rörelsen av enstaka elektroner:
Den homolytiska klyvningen av brytningsbindningen ritas med en "fiskkrok" -pil för att skilja från den vanliga rörelsen hos två elektroner som avbildas av en standardkrullningspil. Den andra elektronen i brytningsförbindelsen rör sig också för att kopplas ihop med den angripande radikala elektronen; detta anges inte uttryckligen i detta fall.
Radikaler deltar också i radikal tillsats och radikal substitution som reaktiva mellanprodukter . Kedjereaktioner som involverar radikaler kan vanligtvis delas in i tre olika processer. Dessa är initiering , förökning och avslutning .
- Initieringsreaktioner är de som resulterar i en nettoökning av antalet radikaler. De kan innefatta bildning av radikaler från stabila arter som i reaktion 1 ovan eller de kan involvera reaktioner av radikaler med stabila arter för att bilda fler radikaler.
- Förökningsreaktioner är de reaktioner som involverar radikaler där det totala antalet radikaler förblir detsamma.
- Avslutningsreaktioner är de reaktioner som resulterar i en netto minskning av antalet radikaler. Typiskt två radikaler kombineras för att bilda en mer stabil arter, till exempel: 2CI · → Cl 2
Se även
- Elektronpar
- Globalt harmoniserat system för klassificering och märkning av kemikalier
- Hofmann – Löffler -reaktion
- Forskning om fria radikaler











![{\ displaystyle {\ ce {NO2 -> [h \ nu] NO + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5da627b27ee3e5b4dc45b156c54a91e1d79ffbd1)

![{\ displaystyle {\ ce {NO2 + O2 -> [h \ nu] NO + O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eae7fc4c91c01822b8db1423a88911a1eb56a171)

![{\ displaystyle {\ ce {CFCS -> [h \ nu] Cl.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcc02008a4a0f755ebbd69f8cfaf0ddfcfb751ac)

![{\ displaystyle {\ ce {O3 -> [h \ nu] O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd85b4a5f671e0a421576bf91c3352bec070c1)

![{\ displaystyle {\ ce {2O3 -> [h \ nu] 3O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afc621f0abb1c9cfc08b3cf82f43d9fc60a29c40)


