Ozanimod - Ozanimod
 | |
 | |
| Kliniska data | |
|---|---|
| Handelsnamn | Zeposia |
| Andra namn | RPC-1063 |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a620029 |
| Licensdata | |
| graviditet kategori |
|
| Vägar administrering |
Via mun |
| ATC-kod | |
| Rättslig status | |
| Rättslig status | |
| Farmakokinetiska data | |
| Elimination Halveringstiden | 19 timmar |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ECHA InfoCard |
100.247.081 |
| Kemiska och fysiska data | |
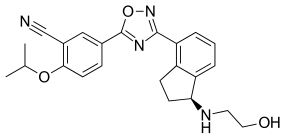
| Formel | C 23 H 24 N 4 O 3 |
| Molmassa | 404,470 g · mol −1 |
| 3D-modell ( JSmol ) | |
| |
| |
Ozanimod , som säljs under varumärket Zeposia , är ett immunmodulerande läkemedel för behandling av återfallande multipel skleros (RMS) och ulcerös kolit . Det fungerar som en sfingosin-1-fosfat (S1P) -receptoragonist , som sekvestrerar lymfocyter till perifera lymfoida organ och bort från deras platser för kronisk inflammation.
De vanligaste biverkningarna är övre luftvägsinfektion, förhöjning av levertransaminas, ortostatisk hypotoni, urinvägsinfektion, ryggont och högt blodtryck.
Ozanimod godkändes för medicinsk användning i USA i mars 2020, i Europeiska unionen i maj 2020 och i Australien i juli 2020.
Medicinsk användning
I USA är ozanimod indicerat för behandling av vuxna med återfallande former av multipel skleros (MS) för att inkludera kliniskt isolerat syndrom, återfall-remitterande sjukdom och aktiv sekundär progressiv sjukdom; och med måttligt till svår aktiv ulcerös kolit (UC).
I Europeiska unionen och i Australien är ozanimod indicerat för behandling av vuxna med återfallande remitterande multipel skleros (RRMS).
Farmakologi
Farmakodynamik
Ozanimod är en agonist för S1P1- och S1P5-receptorerna. Det visar denna effekt på ett dosberoende sätt, med 10-faldig styrka för tre komparatorer. Detta är en förbättring av selektiviteten jämfört med sin föregångare, fingolimod , som inte är specifik för alla 5 isotyperna. S1P-agonismen orsakar direkt dess internalisering och nedbrytning genom ubikvitinproteosomvägen . Förlusten av S1P leder till en minskning av det totala antalet lymfocyter i cirkulation, specifikt CD4 + CCR7 + och CD8 + CCR7 + T-celler.
Farmakokinetik
Ozanimod har en hög oral biotillgänglighet, en cirkulerande halveringstid på cirka 19 timmar och når högsta plasmakoncentrationer i blodet efter cirka 6 timmar. Ozanimod dehydreras av två CYP-enzymer till två aktiva metaboliter, alla med liknande farmakokinetik. Minskningen i lymfocytantalet varar i cirka 14 dagar efter avslutad behandling. Till skillnad från fingolimod kräver det inte fosforylering för aktivering, och det visar inte heller på hjärtavvikelser eller levertoxicitet.
Historia
Ozanimod upptäcktes av The Scripps Research Institute och licensierades till bioteknikföretaget Receptos Inc. som förvärvades av Celgene Corp och sedan förvärvades av Bristol Myers Squibb .
US Food and Drug Administration (FDA) godkände ozanimod baserat på bevis från två kliniska prövningar (prövning 1 / NCT02294058 och prövning 2 / NCT02047734) på 1767 personer med återfallande former av multipel skleros. Försöken genomfördes på 173 centra i USA, Vitryssland, Polen, Ryssland och Ukraina. Patienter fick ozanimod eller komparator ( interferon β1a , en produkt godkänd för behandling av återfallande former av multipel skleros) i upp till ett år (i försök 1) eller upp till två år (i försök 2). Varken försökspersonerna eller vårdgivarna visste vilken behandling som gavs tills försöken var slutförda. Fördelen med ozanimod utvärderades baserat på andelen patienter som upplevde en minskning av sjukdomsåterfall jämfört med patienter som behandlades med interferon β1a.
I maj 2021 godkände FDA ozanimod för en ytterligare infektion för behandling av måttligt till svår aktiv ulcerös kolit.
Kliniska tester
Prövosten
Touchstone är en dubbelblind, placebokontrollerad fas II-klinik för behandling av ulcerös kolit. 197 patienter i åldrarna 18–75, med måttlig till svår UC (Mayo-poäng 6-10) rekryterades och fick antingen placebo, 0,5 mg eller 1 mg oral ozanimod följt av en veckas dosökning. Dosen på 1 mg visade en liten ökning i frekvensen av klinisk remission av UC och total lymfocytminskning jämfört med placebo, med de vanligaste biverkningarna som huvudvärk och anemi. Författarna noterade att begränsningarna av denna studie inkluderade en kort varaktighet och liten provstorlek, vilket innebär att de inte kunde bedöma säkerhet eller effekt.
Strålglans
Radiance är en dubbelblind, placebokontrollerad fas kombinerad II / III klinisk prövning för behandling av återfall multipel skleros. För fas II-studien tilldelades 258 patienter i åldrarna 18–55 år med RMS (genomsnittlig utvidgad funktionshinderstatusskala på 2,9) antingen placebo, 0,5 mg eller 1 mg oral ozanimod följt av en veckas dosökning. Ozanimod minskade signifikant MR-lesionsaktiviteten hos deltagare med återfallande multipel skleros under en period av 24 veckor. Båda doserna ozanimod nådde ett förväntat intervall på 60-70% minskat antal lymfocyter och tolererades väl, med en säkerhetsprofil som överensstämde med en tidigare fas 1-studie på friska frivilliga. De vanligaste biverkningarna jämfört med placebo var: nasofaryngit, huvudvärk och urinvägsinfektioner utan några allvarliga smittsamma eller hjärtbiverkningar. Med dessa resultat togs båda doserna ozanimod vidare till den 2-åriga fas III-studien och är färdig men opublicerad från och med november 2016.
Solstråle
Sunbeam är den andra kliniska RMS-fas III-studien för att fastställa dosen med ett optimalt säkerhets-nyttoförhållande, med en uppskattad storlek på 1200 patienter. Den började i november 2014 och har ett beräknat slutdatum i februari 2017.
Samhälle och kultur
Kommersiell
Efter att ha börjat börja i maj 2013 ökade aktierna i Receptos, Inc. med de kliniska uppgifterna ozanimod som ett S1P-immunmodulerande läkemedel. I augusti 2015 förvärvades Receptos av Celgene för 7,2 miljarder dollar genom en kombination av kontanta medel och ny skuld, vilket ledde till en ökning av deras aktievärde med 22%. Receptos, Inc. (Celgene) patenterade syntesen av ozanimod i juli 2016. Med utbyggnaden av Celgens inflammation och immunologiprofil hade företaget förväntat sig att generera 4 till 6 miljarder dollar i årlig försäljning från ozanimod; FDA avslog emellertid sin ansökan om godkännande av läkemedlet i februari 2018. Celgene omplacerades i mars 2019. Som den nya ägaren fick Bristol Myers Squibb FDA-godkännande den 26 mars 2020 för orala kapslar ozanimod (Zeposia) för att behandla vuxna med återfall former av multipel skleros (MS), inklusive återfall-remitterande MS (RRMS), aktiv sekundär progressiv MS (SPMS) och kliniskt isolerad syndrom (CIS). Ozanimod godkändes för medicinsk användning i Europeiska unionen i maj 2020 och i Australien i juli 2020.
Forskning
Ozanimod utvecklas för ytterligare immuninflammatoriska indikationer, inklusive ulcerös kolit och Crohns sjukdom.
Referenser
externa länkar
- "Ozanimod" . Portalen för läkemedelsinformation . US National Library of Medicine.
- "Ozanimod hydroklorid" . Portalen för läkemedelsinformation . US National Library of Medicine.
- Kliniskt prövningsnummer NCT02047734 för "Effektivitets- och säkerhetsstudie av Ozanimod vid återfallande multipel skleros (RADIANCE)" på ClinicalTrials.gov
- Kliniskt prövningsnummer NCT02435992 för "Säkerhets- och effektstudie av RPC1063 för måttlig till svår ulcerös kolit" på ClinicalTrials.gov
