Mitokondriell biogenes - Mitochondrial biogenesis
Mitokondriell biogenes är processen genom vilken celler ökar mitokondrielltal . Det beskrevs först av John Holloszy på 1960-talet när det upptäcktes att fysisk uthållighetsträning inducerade högre mitokondriella halter, vilket ledde till större glukosupptag av muskler. Mitokondriell biogenes aktiveras av många olika signaler under tider med cellulär stress eller som svar på miljöstimuli, såsom aerob träning .
Bakgrund
Mitokondrions förmåga att självreplikera är förankrad i dess evolutionära historia. Man tror ofta att mitokondrier härstammar från celler som bildade endosymbiotiska förhållanden med α-protobakterier , de har sitt eget genom för replikering. Nya bevis tyder dock på att mitokondrier kan ha utvecklats utan symbios. Mitokondrion är en nyckelregulator för cellens metaboliska aktivitet och är också en viktig organell i både produktion och nedbrytning av fria radikaler. Det antas att högre mitokondriellt kopieantal (eller högre mitokondriemassa) är skyddande för cellen.
Mitokondrier produceras från transkription och translation av gener både i kärngenomet och i mitokondriellt genom . Majoriteten av mitokondriellt protein kommer från det nukleära genomet, medan det mitokondriella genomet kodar delar av elektrontransportkedjan tillsammans med mitokondrie- rRNA och tRNA . Mitokondriell biogenes ökar metaboliska enzymer för glykolys, oxidativ fosforylering och i slutändan en större mitokondriell metabolisk kapacitet. Beroende på de tillgängliga energisubstraten och cellens REDOX-tillstånd kan cellen dock öka eller minska antalet och storleken på mitokondrier. Kritiskt varierar mitokondrielltal och morfologi beroende på celltyp och sammanhangsspecifikt behov, varvid balansen mellan mitokondriell fusion / fission reglerar mitokondriell distribution, morfologi och funktion.
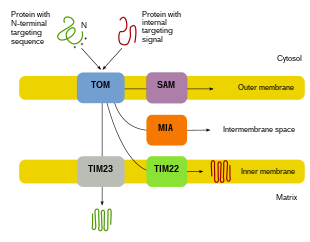
Proteinimport
Eftersom majoriteten av mitokondriellt protein kommer från det nukleära genomet måste proteinerna riktas in ordentligt och transporteras in i mitokondrier för att utföra sina funktioner. Först översätts mRNA i cellens cytosol. De resulterande veckade föregångarproteinerna kommer då att kunna nå sina respektive mitokondriella fack. Prekursorproteiner kommer att transporteras till ett av fyra områden i mitokondrierna, som inkluderar det yttre membranet, det inre membranet, intermembranutrymmet och matrisen. Alla proteiner kommer in i mitokondrierna genom ett translokas på det yttre mitokondriella membranet (TOM). Vissa proteiner kommer att ha en N-terminal målsignal, och dessa proteiner kommer att detekteras och transporteras in i matrisen, där de sedan klyvs och vikas. Andra proteiner kan ha inriktningsinformation i sina sekvenser och inkluderar inte en N-terminal signal. Under de senaste två decennierna har forskare upptäckt över trettio proteiner som deltar i mitokondriellt proteinimport. När forskare lär sig mer om dessa proteiner och hur de når respektive mitokondriella fack som använder dem blir det uppenbart att det finns en mängd processer som arbetar tillsammans i cellen för att möjliggöra mitokondriell biogenes.
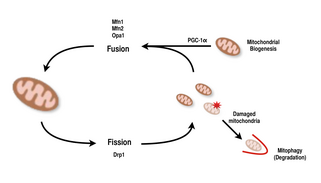
Fusion och fission
Mitokondrier är mycket mångsidiga och kan ändra form genom klyvning och fusionshändelser. Definition, fission är händelsen av att en enda enhet bryts sönder, medan fusion är händelsen av att två eller flera enheter går samman för att bilda en helhet. Processerna för klyvning och fusion motsätter varandra och låter det mitokondriella nätverket ständigt modernisera sig själv. Om en stimulans inducerar en förändring i klyvnings- och fusionsbalansen i en cell kan det förändra mitokondriellt nätverk avsevärt. Till exempel skulle en ökning av mitokondriell fission skapa många fragmenterade mitokondrier, vilket har visat sig vara användbart för att eliminera skadade mitokondrier och för att skapa mindre mitokondrier för effektiv transport till energikrävande områden. Därför uppnår en balans mellan dessa mekanismer en cell att ha rätt organisation av sitt mitokondriella nätverk under biogenes och kan ha en viktig roll i muskelanpassning till fysiologisk stress.
Hos däggdjur styrs mitokondriell fusion och fission båda av GTPaser av dynaminfamiljen. Processen med mitokondriell fission styrs av Drp1 , en medlem av den cytosoliska dynaminfamiljen. Detta protein bildar en spiral runt mitokondrier och samlas för att bryta isär både organellens yttre och inre membran. Å andra sidan styrs fusionsprocessen av olika membranförankrade dynaminproteiner vid olika nivåer av mitokondrierna. Fusion vid nivån av det yttre mitokondriella membranet medieras av Mfn1 och Mfn2 (Mitofusins 1 och 2), och fusion vid nivån av det inre mitokondriella membranet förmedlas av Opal . Flera forskningsstudier har observerat korrelerade ökningar mellan mitokondriell andningsförmåga med Mfn1, Mnf2 och Drp1 genuttryck efter uthållighetsövningar. Därför stöds det att omorganisation av det mitokondriella nätverket i muskelceller spelar en viktig roll som svar på träning.
Förordning
PGC-la , en medlem av den peroxisomproliferatoraktiverade receptorgamma (PGC) -familjen av transkriptionella koaktivatorer , är huvudregulatorn för mitokondriell biogenes. Det är känt att samaktivera nukleär andningsfaktor 2 (NRF2 / GABPA) , och tillsammans med NRF-2 samaktiverar nukleär andningsfaktor 1 ( NRF1 ). NRF: erna aktiverar i sin tur den mitokondriella transkriptionsfaktorn A (tfam) , som är direkt ansvarig för transkribering av kärnkodade mitokondriella proteiner. Detta inkluderar både strukturella mitokondriella proteiner såväl som de som är involverade i mtDNA-transkription, translation och reparation . PGC-1β, ett protein som liknar strukturellt PGC-la , är också involverat i att reglera mitokondriell biogenes, men skiljer sig åt genom att det inte blir ökat som svar på träning. Medan det har skett signifikanta ökningar av mitokondrier i vävnader där PGC-1a är överuttryckt, eftersom kofaktorn interagerar med dessa viktiga transkriptionsfaktorer, är knockout-möss med störd PGC-1α fortfarande livskraftiga och visar normalt mitokondriellt överflöd. Således krävs inte PGC-la för normal utveckling av mitokondrier hos möss, men när de utsätts för fysiologisk stress uppvisar dessa möss minskad tolerans jämfört med möss med normala nivåer av PGC-la. På liknande sätt visade mössen i knockout-möss med stört PGC-1β mestadels normala nivåer av mitokondriell funktion med minskad förmåga att anpassa sig till fysiologisk stress. Emellertid skapade ett dubbel knockout-experiment av PGC-1α / β möss som dog mestadels inom 24 timmar av defekter i mitokondriell mognad av hjärtvävnad. Dessa resultat tyder på att även om både PGC-1a och PGC-1β inte enbart skapar en cells förmåga att utföra mitokondriell biogenes, kan de tillsammans komplettera varandra för optimal mitokondriell mognad och funktion under perioder av fysiologisk stress.
AMP-aktiverat kinas (AMPK) reglerar också mitokondriell biogenes genom fosforylering och aktivering av PGC-la efter avkänning av en energibrist i muskler. Hos möss med reducerade ATP / AMP-förhållanden som skulle inträffa under träning har energiuttömningen visats korrelera med AMPK-aktivering. AMPK-aktivering fortsatte sedan att aktivera PGC-la och NRF i dessa möss, och mitokondriell biogenes stimulerades.
Åldrande
Kapaciteten för mitokondriell biogenes har visat sig minska med åldern, och en sådan minskad mitokondriell funktion har associerats med diabetes och hjärt-kärlsjukdom. Åldrande och sjukdom kan inducera förändringar i expressionsnivåerna av proteiner som är involverade i mitokondriernas fission och fusionsmekanismer, vilket skapar dysfunktionella mitokondrier. En hypotes för de skadliga resultaten av åldrande är associerad med förlusten av telomerer , ändsegmenten av kromosomer som skyddar genetisk information från nedbrytning. Telomerförlust har också associerats med minskad mitokondriell funktion. Brist på telomeras omvänd transkriptas (TERT) , ett enzym som spelar en roll för att bevara telomerer, har korrelerats med aktiverat p53, ett protein som undertrycker PGC-1α. Därför har förlusten av telomerer och TERT som följer med åldrande associerats med nedsatt mitokondriell biogenes. AMPK-uttryck har också visat sig minska med åldern, vilket också kan bidra till att undertrycka mitokondriell biogenes.
Referenser
Vidare läsning
- Smith JA, Stallons LJ, Collier JB, Chavin KD, Schnellmann RG (februari 2015). "Suppression av mitokondriell biogenes genom avgiftsliknande receptor 4-beroende mitogenaktiverat proteinkinaskinas / extracellulär signalreglerad kinas-signalering vid endotoxininducerad akut njurskada" . Journal of Pharmacology and Experimental Therapeutics . 352 (2): 346–57. doi : 10.1124 / jpet.114.221085 . PMC 4293437 . PMID 25503387 .
- Cameron RB, Beeson CC, Schnellmann RG (december 2016). "Utveckling av terapeutiska medel som inducerar mitokondriell biogenes för behandling av akuta och kroniska degenerativa sjukdomar" . Journal of Medicinal Chemistry . 59 (23): 10411-10434. doi : 10.1021 / acs.jmedchem.6b00669 . PMC 5564430 . PMID 27560192 .
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). "Mitokondriell biogenes som ett farmakologiskt mål: en ny metod för akuta och kroniska sjukdomar". Årlig granskning av farmakologi och toxikologi . 56 : 229–49. doi : 10.1146 / annurev-pharmtox-010715-103155 . PMID 26566156 .