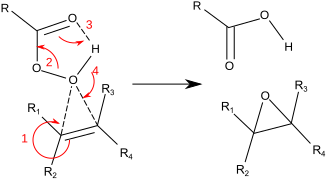Epoxid - Epoxide
En epoxid är en cyklisk eter med en treatomring. Den här ringen approximerar en liksidig triangel , vilket gör den ansträngd och därmed mycket reaktiv, mer än andra etrar. De produceras i stor skala för många applikationer. I allmänhet är epoxider med låg molekylvikt färglösa och opolära och ofta flyktiga.
Nomenklatur
En förening innehållande den epoxidfunktionella gruppen kan kallas epoxi, epoxid, oxiran och etoxylin. Enkla epoxider kallas ofta för oxider. Sålunda, epoxiden av eten (C 2 H 4 ) är etylenoxid (C 2 H 4 O). Många föreningar har triviala namn; till exempel kallas etylenoxid "oxiran". Vissa namn betonar närvaron av den epoxidfunktionella gruppen , som i föreningen 1,2-epoxiheptan , som också kan kallas 1,2-heptenoxid .
En polymer bildad av epoxidprekursorer kallas en epoxi , men sådana material innehåller inte epoxidgrupper (eller innehåller endast ett fåtal kvarvarande epoxigrupper som förblir oreagerade vid bildandet av hartset).
Syntes
De dominerande epoxiderna industriellt är etylenoxid och propylenoxid , som produceras på skalor på cirka 15 och 3 miljoner ton / år.
Heterogent katalyserad oxidation av alkener
Epoxideringen av eten involverar dess reaktion med syre . Enligt en reaktionsmekanism som föreslogs 1974 oxideras minst en etylenmolekyl totalt för varje sex som omvandlas till etylenoxid:
- 7 H 2 C = CH 2 + 6 O 2 → 6 C 2 H 4 O + 2 CO 2 + 2 H 2 O
Den direkta reaktionen av syre med alkener är endast användbar för denna epoxid. Modifierade heterogena silverkatalysatorer används typiskt. Andra alkener reagerar inte användbart, även propylen , även om TS-1-stödda Au-katalysatorer kan utföra propylenepoxidering selektivt.
Olefin (alken) oxidation med organiska peroxider och metallkatalysatorer
Bortsett från etylenoxid är de flesta epoxider genereras genom behandling av alkener med peroxid -innehållande reagens, vilka donerar en enda syreatom. Säkerhetshänsyn väger på dessa reaktioner eftersom organiska peroxider är benägna att spontant sönderdelas eller till och med förbränna.
Metallkomplex är användbara katalysatorer för epoxidationer som involverar väteperoxid och alkylhydroperoxider. Peroxikarboxylsyror, som är mer elektrofila, omvandlar alkener till epoxider utan metallkatalysatorernas ingripande. I specialapplikationer används andra peroxidinnehållande reagens, såsom dimetyldioxiran . Beroende på mekanismen för reaktionen och geometrin av alkenen utgångsmaterialet, cis- och / eller trans- epoxid diastereomerer kan bildas. Dessutom, om det finns andra stereocentrar närvarande i utgångsmaterialet, kan de påverka stereokemin i epoxideringen. Metallkatalyserade epoxidationer undersöktes först med användning av tert-butylhydroperoxid (TBHP). Förening av TBHP med metallen (M) genererar det aktiva metallperoxikomplexet som innehåller MOOR-gruppen, som sedan överför ett O-centrum till alkenen.
Organiska peroxider används för produktion av propylenoxid från propylen. Katalysatorer krävs också. Både t-butylhydroperoxid och etylbensenhydroperoxid kan användas som syrekällor.
Olefinperoxidering med användning av peroxikarboxylsyror
Mer typiskt för laboratorieoperationer används Prilezhaev-reaktionen . Detta tillvägagångssätt involverar oxidation av alkenen med en peroxisyra såsom m-CPBA . Illustrativt är epoxideringen av styren med perbensoesyra till styrenoxid :
Reaktionen fortsätter via det som är allmänt känt som "Butterfly Mechanism". Peroxiden ses som en elektrofil och alkenen en nukleofil . Reaktionen anses vara samordnad (siffrorna i mekanismen nedan är förenklade). Fjärilsmekanismen möjliggör idealisk positionering av OO sigma-stjärnbana för CC Pi-elektroner att attackera. Eftersom två bindningar bryts och bildas till epoxidsyret är detta formellt ett exempel på ett koarktatövergångstillstånd .
Hydroperoxider används också i katalytiska enantioselektiva epoxidationer, såsom Sharpless-epoxidering och Jacobsen-epoxidering . Tillsammans med Shi-epoxideringen är dessa reaktioner användbara för enantioselektiv syntes av kirala epoxider. Oxaziridinreagens kan också användas för att generera epoxider från alkener.
Homogent katalyserade asymmetriska epoxidationer
Arenoxider är mellanprodukter vid oxidering av aren genom cytokrom P450 . För prochirala arenor ( naftalen , toluen , bensoater , bensopyren ) erhålls epoxiderna ofta med hög enantioselektivitet.
Kirala epoxider kan ofta härledas enantioselektivt från prochirala alkener. Många metallkomplex ger aktiva katalysatorer, men det viktigaste involverar titan, vanadin och molybden.
Den Sharpless epoxideringsreaktionen är en av de främsta enantioselektiva kemiska reaktionerna . Det används för att bereda 2,3-epoxialkoholer från primära och sekundära allylalkoholer .

Intramolekylär S N 2 substitution
Denna metod innefattar dehydrohalogenering . Det är en variant av Williamson etersyntes . I detta fall förskjuter en alkoxidjon intramolekylärt klorid. Prekursorföreningarna kallas halohydriner och kan genereras genom halohydratisering av en alken. Från och med propylenklorhydrin uppstår det mesta av världens försörjning av propylenoxid via denna väg.
En intramolekylär epoxidbildningsreaktion är ett av de viktigaste stegen i Darzens-reaktionen .
I Johnson – Corey – Chaykovsky-reaktionen genereras epoxider från karbonylgrupper och sulfoniumylider . I denna reaktion är ett sulfonium den lämnande gruppen istället för klorid.
Nukleofil epoxidering
Elektronbristiga olefiner, såsom enoner och akrylderivat, kan epoxideras med användning av nukleofila syreföreningar såsom peroxider. Reaktionen är en tvåstegsmekanism. Först utför syret en nukleofil konjugattillsats för att ge en stabiliserad karbanion. Denna karbanion attackerar sedan samma syreatom och förskjuter en lämnande grupp från den för att stänga epoxidringen.
Biosyntes
Epoxider är ovanliga till sin natur. De uppstår vanligtvis via syresättning av alkener genom inverkan av cytokrom P450 . (men se även de kortlivade epoxyeikosatriensyrorna som fungerar som signalmolekyler. och liknande epoxidokosapentaensyror och epoxyeikosatetraensyror .)
Reaktioner
Ringöppningsreaktioner dominerar reaktiviteten hos epoxider.
Hydrolys och tillsats av nukleofiler
Alkoholer, vatten, aminer, tioler och många andra reagens lägger till epoxider. Denna reaktion är grunden för två kommersiella tillämpningar, bildandet av epoxilim och produktionen av glykoler. Under sura förhållanden påverkas nukleofil tillsats av steriska effekter, vilket normalt ses för SN2- reaktioner, såväl som stabiliteten för framväxande kolhydrater (som normalt ses för SN1- reaktioner). Hydrolys av en epoxid i närvaro av en syrakatalysator genererar glykolen .
Polymerisation och oligomerisering
Polymerisation av epoxider ger polyetrar . Exempelvis polymeriserar etylenoxid för att ge polyetylenglykol , även känd som polyetylenoxid. Reaktionen mellan en alkohol eller en fenol med etylenoxid, etoxylering , används i stor utsträckning för att framställa ytaktiva ämnen:
- ROH + n C 2 H 4 O → R (OC 2 H 4 ) n OH
Med anhydrider ger epoxider polyestrar.
Deoxygenation
Epoxider kan avoxideras med användning av oxofila reagens. Denna reaktion kan fortsätta med förlust eller bibehållande av konfigurationen. Kombinationen av volframhexaklorid och n- butyllitium ger alkenen .
Andra reaktioner
- Reduktion av en epoxid med litiumaluminiumhydrid eller aluminiumhydrid ger motsvarande alkohol . Denna reduktionsprocess är resultatet av den nukleofila tillsatsen av hydrid (H - ).
- Reduktiv klyvning av epoxider ger β-litioalkoxider.
- Reduktion med volframhexaklorid och n- butyllitium genererar alkenen
- Epoxider genomgår ringexpansionsreaktioner, illustrerat genom införande av koldioxid för att ge cykliska karbonater .
- Vid behandling med tiourea omvandlas epoxider till episulfiden, som kallas tiiraner .
Användningar
Bisfenol En diglycidyleter är en komponent i vanligt hushålls "epoxi".
Den kemiska strukturen hos epoxidglycidolen , en vanlig kemisk mellanprodukt.
Epotiloner är naturligt förekommande epoxider.
3,4-epoxicyklohexylmetyl-3 ', 4'-epoxicyklohexankarboxylat , föregångare till beläggningar.
Epoxiderat linolein , en huvudkomponent i epoxiderad sojabönolja (ESBO), ett kommersiellt viktigt mjukningsmedel .
Bensenoxid existerar i jämvikt med oxepin-isomeren.
Etylenoxid används i stor utsträckning för att generera tvättmedel och ytaktiva medel genom etoxylering . Dess hydrolys ger etylenglykol . Det används också för sterilisering av medicinska instrument och material.
Reaktionen av epoxider med aminer är grunden för bildandet av epoxilim och strukturmaterial. En typisk aminhärdare är trietylentetramin (TETA).
Säkerhet
Epoxider är alkyleringsmedel , vilket gör många av dem mycket giftiga.