Arseniktrioxid - Arsenic trioxide
 | |

| |
| Kliniska data | |
|---|---|
| Uttal | AR se nik tri OKS id |
| Handelsnamn | Trisenox, andra |
| Andra namn | Arsen (III) oxid, Arsenik sesquioxid , Arsenoxid, Ratsbane, Arseniksyraanhydrid, Vit arsenik, Aqua Tofani |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a608017 |
| Licensdata | |
| graviditet kategori |
|
| Vägar administrering |
Intravenös |
| Drogklass | Antineoplastiskt medel |
| ATC -kod | |
| Rättslig status | |
| Rättslig status | |
| Farmakokinetiska data | |
| Proteinbindning | 75% |
| Exkretion | Urin |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEMBL | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard |
100.014.075 |
| Kemiska och fysiska data | |
| Formel | Som 2 O 3 |
| Molmassa | 197,840 g · mol −1 |
| 3D -modell ( JSmol ) | |
| Densitet | 3,74 g / cm 3 |
| Smältpunkt | 312,2 ° C (594,0 ° F) |
| Kokpunkt | 465 ° C (869 ° F) |
| Vattenlöslighet | 20 g/L (25 ° C) (se text) |
| |
| |
| Datasida | |
| Arseniktrioxid (datasida) | |
Arsentrioxid , som bland annat säljs under varumärket Trisenox , är en oorganisk förening och medicinering. Som en industrikemikalie, vars främsta användningsområden är tillverkning av träskyddsmedel , bekämpningsmedel och glas . Som medicin används det för att behandla en typ av cancer som kallas akut promyelocytisk leukemi . För denna användning ges den genom injektion i en ven .
Vanliga biverkningar inkluderar kräkningar, diarré, svullnad, andfåddhet och huvudvärk. Allvarliga biverkningar kan inkludera APL -differentieringssyndrom och hjärtproblem. Användning under graviditet eller amning kan skada barnet. Arsentrioxid har formeln As
2O
3. Dess mekanism vid behandling av cancer är inte helt klar.
Arsentrioxid godkändes för medicinskt bruk i USA år 2000. Det finns på Världshälsoorganisationens lista över viktiga läkemedel . Cirka 50 000 ton produceras om året. På grund av dess toxicitet har ett antal länder regler kring tillverkning och försäljning.
Användningsområden
Medicinsk
Arseniktrioxid används för att behandla en typ av cancer som kallas akut promyelocytisk leukemi (APL). Det kan användas både i fall som inte svarar på andra medel, såsom all-trans-retinsyra (ATRA) eller som en del av den inledande behandlingen av nydiagnostiserade fall. Denna inledande behandling kan innefatta kombinationsbehandling av arseniktrioxid med all-trans-retinsyra (ATRA).
Effektiviteten verkar lik Realgar/Indigo naturalis , som kan tas i munnen och är billigare men mindre tillgänglig.
På 1970 -talet upptäckte den kinesiska forskaren Zhang Tingdong och kollegor denna användning. Det godkändes för leukemibehandling i USA år 2000. University of Hong Kong utvecklade en flytande form av arseniktrioxid som kan ges via munnen. Organoarseniska föreningar , såsom fodertillsatser ( roxarson ) och medicinering ( neosalvarsan ), härrör från arseniktrioxid.
Tillverkning
Industriell användning inkluderar användning som föregångare till skogsbruksprodukter, i färglös glasproduktion och inom elektronik. Är den viktigaste föreningen med arsenik , är trioxid prekursorn till elementärt arsenik, arseniklegeringar och arsenid halvledare . Bulk arsenikbaserade föreningar natriumarsenit och natriumkakodylat härrör från trioxiden.
En mängd olika tillämpningar utnyttjar arsenens toxicitet, inklusive användningen av oxiden som träkonserveringsmedel . Koppararsenat , som härrör från arseniktrioxid, används i stor skala som träskyddsmedel i USA och Malaysia, men sådana material är förbjudna i många delar av världen. Denna praxis är fortfarande kontroversiell. I kombination med koppar (II) acetat ger arseniktrioxid det pulserande pigmentet som kallas Paris grönt som används i färger och som gnagare. Denna ansökan har avbrutits.
Alternativ medicin
Trots arsenens välkända toxicitet användes arseniktrioxid i traditionell kinesisk medicin , där den är känd som pi-shuang ( kinesiska :砒霜; pinyin : pīshuāng ; lit. 'arsenic frost'). I homeopati kallas det arsenicum album . Vissa diskrediterade patentläkemedel , t.ex. Fowlers lösning , innehöll derivat av arsenoxid.
Toxikologi
Arsentrioxid absorberas lätt av matsmältningssystemet: toxiska effekter är också välkända vid inandning eller vid hudkontakt. Eliminering är snabb i början (halveringstid på 1-2 dagar), genom metylering till monometylarsonsyra och dimetylarsonsyra, och utsöndring i urinen, men en viss mängd (30-40% vid upprepad exponering) införlivas i ben, muskler, hud, hår och naglar (alla vävnader rika på keratin ) och elimineras under en period av veckor eller månader.
De första symptomen på akut arsenförgiftning vid förtäring är matsmältningsproblem: kräkningar, buksmärtor, diarré som ofta åtföljs av blödning. Sub-dödliga doser kan leda till kramper , kardiovaskulära problem, inflammation i lever och njurar och avvikelser i blodets koagulering. Dessa följs av uppkomsten av karakteristiska vita linjer ( Mees 'linjer ) på naglarna och av håravfall. Lägre doser leder till lever- och njurproblem och till förändringar i hudens pigmentering. Även utspädda lösningar av arseniktrioxid är farliga vid kontakt med ögonen.
De giftiga egenskaperna är välkända och föremål för en omfattande litteratur.
Kronisk arsenikförgiftning kallas arsenikos. Denna sjukdom påverkar arbetare i smältverk , i befolkningar vars dricksvatten innehåller höga halter arsenik (0,3–0,4 ppm) och hos patienter som behandlats under långa perioder med arsenikbaserade läkemedel. Likaså undersökningar av exponerade arbetstagare i koppar gjuterier i USA, Japan och Sverige visar på en risk för lungcancer 6-10 gånger högre för de mest exponerade arbetare jämfört med den allmänna befolkningen. Långsiktigt intag av arseniktrioxid antingen i dricksvatten eller som medicinsk behandling kan leda till hudcancer. Reproduktionsproblem (höga incidenter av missfall, låg födelsevikt, medfödda deformationer) har också indikerats i en studie av kvinnor som utsatts för damm av arseniktrioxid som anställda eller grannar till ett koppargjuteri.
I Österrike bodde de så kallade "arsenikätarna i Steiermark ", som intog doser långt bortom den dödliga dosen av arseniktrioxid utan någon uppenbar skada. Arsenik antas möjliggöra ansträngande arbete på stora höjder, t.ex. i Alperna.
I USA är OSHA 1910.1018 yrkesmässig tillåten exponeringsgräns för oorganiska arsenikföreningar i andningszonluften 0,010 mg/m 3 .
Produktion och förekomst

Arsentrioxid kan genereras genom rutinmässig bearbetning av arsenikföreningar inklusive oxidation (förbränning) av arsenik och arsenikinnehållande mineraler i luft . Illustrativt är rostning av orpiment , en typisk arsenisk sulfidmalm.
- 2 Som
2S
3+ 9 O
2→ 2 Som
2O
3+ 6 SO
2
Mest arsenoxid erhålls dock som en flyktig biprodukt vid bearbetning av andra malmer. Till exempel frigör arsenopyrit , en vanlig förorening i guld- och kopparhaltiga malmer, arsenitrioxid vid uppvärmning i luft. Bearbetningen av sådana mineraler har lett till många fall av förgiftningar. Endast i Kina bryts arsenmalm avsiktligt.
I laboratoriet bereds det genom hydrolys av arsenik triklorid :
- 2 ASCL 3 + 3 H 2 O → Som 2 O 3 + 6 HCl
Som
2O
3förekommer naturligt som två mineraler, arsenolit ( kubik ) och claudetit ( monoklin ). Båda är relativt sällsynta sekundära mineraler som finns i oxidationszoner i As-rika malmfyndigheter. Ark av As 2 O 3 står för en del av strukturer av de nyligen upptäckta mineralerna lucabindiit, (K, NH 4 ) As 4 O 6 (Cl, Br), och dess natrium-analoga torrecillasit.
Egenskaper och reaktioner
Arsentrioxid är en amfoterisk oxid, och dess vattenhaltiga lösningar är svagt sura . Således upplöses det lätt i alkaliska lösningar för att ge arseniter . Det är mindre lösligt i syror, även om det löser sig i saltsyra .
Med vattenfritt HF och HCl ger det AsF 3 och trikloriden:
- Som 2 O 3 + 6 HX → 2 AsX 3 + 3 H 2 O (X = F, Cl)
Endast med starka oxidationsmedel som ozon , väteperoxid och salpetersyra ger det arsenikpentoxid , Som
2O
5 eller dess motsvarande syra:
- 2 HNO 3 + As 2 O 3 + 2 H 2 O → 2 H 3 AsO 4 + N 2 O 3
När det gäller dess motståndskraft mot oxidation skiljer sig arsentrioxid från fosfortrioxid , som lätt förbränns till fosforpentoxid .
Reduktion ger elementärt arsenik eller arsin ( AsH
3) beroende på förhållanden:
- Som 2 O 3 + 6 Zn + 12 HNO 3 → 2 AsH 3 + 6 Zn (NO 3 ) 2 + 3 H 2 O
Denna reaktion används i Marsh -testet .
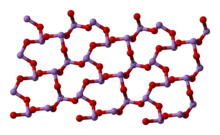
Strukturera
I vätske- och gasfasen under 800 ° C har arseniktrioxid formeln As
4O
6och är isostrukturell med P
4O
6. Över 800 ° C As
4O
6dissocierar signifikant till molekylär As
2O
3, som antar samma struktur som N
2O
3. Tre former ( polymorfer ) är kända i fast tillstånd: en hög temperatur (> 110 ° C) kubisk As
4O
6, innehållande molekylär As
4O
6och två besläktade polymera former. Polymererna, som båda kristalliseras som monokliniska kristaller, har ark av pyramidalt AsO
3 enheter som delar O -atomer.
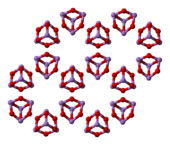
|

|
|
(kubik) |
(monoklin) |
(monoklinisk) |
Samhälle och kultur
Miljöpåverkan
Smältning och tillhörande malmbearbetning genererar ofta arseniktrioxid, vilket utgör en risk för miljön . Till exempel Giant Mine i Kanada bearbetade avsevärda mängder av arsenikkis kontaminerad guldmalmer.
Referenser
externa länkar
- "Arseniktrioxid" . Läkemedelsinformationsportal . US National Library of Medicine.
- Fallstudier inom miljömedicin: Arsenic toxicitet
- "Arsenik och arsenikföreningar" . Sammanfattningar och utvärderingar . International Agency for Research on Cancer (IARC). Februari 1998.
- Internationellt kemikaliesäkerhetskort 0378
- NIOSH fickguide för kemiska faror
- NTP -rapport om cancerframkallande ämnen - oorganiska arsenföreningar
- Institut national de recherche et de sécurité (1989). " Trioxyde d'arsenic. " Fiche toxicologique nr 89 . Paris: INRS. (på franska)
