Magnesiumhydrid - Magnesium hydride
|
|
|
|
| Namn | |
|---|---|
|
IUPAC-namn
Magnesiumhydrid
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard |
100.028.824 |
| EG-nummer | |
|
PubChem CID
|
|
| UNII | |
|
|
|
|
| Egenskaper | |
| MgH 2 | |
| Molmassa | 26,3209 g / mol |
| Utseende | vita kristaller |
| Densitet | 1,45 g / cm ^ |
| Smältpunkt | 327 ° C (621 ° F; 600 K) sönderdelas |
| bryts ner | |
| Löslighet | olöslig i eter |
| Strukturera | |
| tetragonal | |
| Termokemi | |
|
Värmekapacitet ( C )
|
35,4 J / mol K |
|
Std molar
entropi ( S |
31,1 J / mol K |
|
Std-entalpi av
bildning (Δ f H ⦵ 298 ) |
-75,2 kJ / mol |
|
Gibbs fri energi (Δ f G ˚)
|
-35,9 kJ / mol |
| Faror | |
| Huvud risker | pyroforisk |
| Relaterade föreningar | |
|
Andra katjoner
|
Berylliumhydrid Kalciumhydrid Strontiumhydrid Bariumhydrid |
| Magnesiummonohydrid Mg 4 H 6 | |
|
Om inget annat anges, ges data för material i standardtillstånd (vid 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Infoboxreferenser | |
Magnesiumhydrid är den kemiska föreningen med molekylformeln MGH 2 . Den innehåller 7,66 viktprocent väte och har studerats som ett potentiellt vätelagringsmedium.
Förberedelse
I 1951 beredning från elementen rapporterades först involverar direkt hydrering av Mg-metall vid högt tryck och temperatur (200 atmosfärer, 500 ° C) med Mgl 2 katalysator:
- Mg + H 2 → MGH 2
Lägre produktionstemperaturen från Mg och H 2 med användning av nanokristallin Mg producerad i kulkvarnar har undersökts. Andra preparat inkluderar:
- hydreringen av magnesiumantracen under milda förhållanden:
- Mg (antracen) + H 2 → MGH 2
- reaktionen av dietylmagnesium med litiumaluminiumhydrid
- produkten av komplex MGH 2 t.ex. MGH 2 .THF genom reaktion av fenylsilan och dibutylmagnesium i eter- eller kolvätelösningsmedel i närvaro av THF eller TMEDA som ligand.
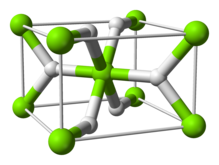
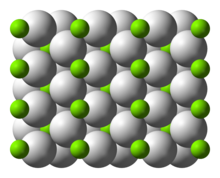
Struktur och limning
Rumstemperaturen formen α-MGH 2 har en rutil struktur. Det finns åtminstone fyra högtrycks former: γ-MGH 2 med α-PbO 2 struktur, kubisk β-MGH 2 med Pa-3 rymdgrupp, ortorombisk HP1 med Pbc2 en rymdgrupp och ortorombisk HP2 med Pnma rymdgruppen. Dessutom en icke stökiometrisk MGH (2-δ) har karaktäriserats, men detta verkar existera endast för mycket små partiklar
(bulk MGH 2 är i huvudsak stökiometrisk, eftersom det endast kan rymma mycket låga koncentrationer av H vakanser).
Bindningen i rutilform beskrivs ibland som delvis kovalent till sin natur snarare än rent jonisk; laddningsdensitetsbestämning genom synkrotron röntgendiffraktion indikerar att magnesiumatomen är helt joniserad och sfärisk i form och hydridjonen är långsträckt. Molekylära former av magnesium-hydrid, MGH, MGH 2 , Mg 2 H, Mg 2 H 2 , Mg 2 H 3 , och Mg 2 H 4 molekyler som identifieras av deras vibrationsspektra har hittats i matris isolerade prover vid under 10 K, bildat följande laserablation av magnesium i närvaro av väte. Mg 2 H 4 -molekylen har en överbryggad struktur som är analog till dimera aluminiumhydrid , Al 2 H 6 .
Reaktioner
MgH 2 reagerar lätt med vatten för att bilda vätgas:
- MGH 2 + 2 H 2 O → 2 H 2 + Mg (OH) 2
Vid 287 ° C den sönderdelas för att alstra H 2 vid en bar tryck, den höga temperatur som krävs ses som en begränsning i användningen av MGH 2 som en reversibel vätelagringsmediet:
- MGH 2 → Mg + H 2
Potentiell användning för vätelagring
Dess potential som ett reversibelt "lagringsmedium" för väte har lett till intresse för att förbättra hydrerings- och dehydrogeneringsreaktionskinetiken. Detta kan delvis uppnås genom dopning eller genom att minska partikelstorleken med hjälp av kulmalning . Ett alternativt tillvägagångssätt under utredning är produktionen av en pumpbar uppslamning av MGH 2 som är säker att hantera och släpper H 2 genom reaktion med vatten, med upparbetning av Mg (OH) 2 in i MGH 2 . [1] En serie amerikanska patent (US9123925B2, US8651268B2, US8651270B2, US9732906B2) och internationella patent har beviljats för ett uppladdningsbart lågtrycks-, lågtemperaturvätelagringssystem som använder nanostrukturerat magnesiumhydrid för högdensitetsväteabsorption och laseraktiverad desorption . Ett praktiskt system använder behandlade polymersubstrat i form av en skiva eller tejp för användning vid långvarig lagring, transport och gallerstabilisering. Systemet har en unik fördel i förmågan att passivt fånga väte från industriella skorstenar och avfallsbehandlingsanläggningar innan det kan bindas till bildning av växthusgaser.
