Adenylylation - Adenylylation
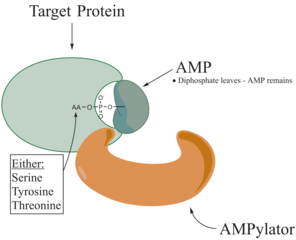
Adenylylering , mer allmänt känd som AMPylering , är en process där en adenosinmonofosfat (AMP) -molekyl är kovalent bunden till aminosyras sidokedja i ett protein . Denna kovalenta tillsats av AMP till en hydroxylsidokedja av proteinet är en posttranslationell modifiering . Adenylylation involverar en fosfodiesterbindning mellan en hydroxylgrupp i molekylen som undergår adenylylation, och fosfatgruppen av adenosinmonofosfat nukleotid (dvs adenylsyra). Enzymer som kan katalysera denna process kallas AMPylatorer.
De kända aminosyrorna som är riktade mot proteinet är tyrosin och treonin, och ibland serin. När laddningar på ett protein genomgår en förändring påverkar det proteinets egenskaper, normalt genom att ändra dess form via interaktioner mellan aminosyrorna som utgör proteinet. AMPylering kan ha olika effekter på proteinet. Dessa är egenskaper hos proteinliknande, stabilitet, enzymatisk aktivitet, ko-faktorbindning och många andra funktionella egenskaper hos ett protein. En annan funktion av adenylylering är aktivering av aminosyror, som katalyseras av tRNA -aminoacylsyntetas. Det vanligast identifierade proteinet för att få AMPylering är GTPaser och glutaminsyntetas .
Adenylylatorer
Enzymer som är ansvariga för AMPylering, kallade AMPylators eller Adenylyltransferase , faller in i två olika familjer, allt beroende på deras strukturella egenskaper och mekanism som används. AMPylator skapas av två katalytiska homologa halvor. Ena halvan är ansvarig för katalysering av adenylyleringsreaktionen, medan den andra halvan katalyserar den fosforolytiska deadenylyleringsreaktionen . Dessa två familjer är DNA- β- polymerasliknande och Fic-familjen.
DNA- β- polymerasliknande är en familj av nukleotidyltransferas . Det är mer specifikt känt som GlnE -familjen. Det finns ett specifikt motiv som används för att klargöra just denna familj. Motivet består av ett tresträngat β-ark som ingår i magnesiumjonkoordinering och fosfatbindning. Aspartat är avgörande för att aktiviteten ska ske i denna familj.
Fic -domänen tillhör Fido (Fic/Doc) superfamilyFic -familjen , som är en filamentation inducerad av cyklisk AMP -domän, är känd för att utföra AMPylering. Denna proteinfamilj finns på alla livsområden på jorden. Det medieras via en mekanism för ATP-bindande plats alfa-helixmotiv. Smittsamma bakterier använder denna domän för att avbryta fagocytos och orsaka celldöd. Fic -domäner är evolutionärt bevarade domäner i prokaryoter och eukaryoter som tillhör Fido -domänens superfamilj.
AMPylatorer har visat sig vara jämförbara med kinaser på grund av deras ATP -hydrolysaktivitet och reversibel överföring av metaboliten till en hydroxylsidokedja i proteinsubstratet. AMPylering katalyserar emellertid en nukleofil attack på a-fosfatgruppen, medan kinas i fosforyleringsreaktionen riktar sig mot y-fosfat. Den nukleofila attacken av AMPylation leder till frisättning av pyrofosfat och det AMP-modifierade proteinet är produkterna från AMPyleringsreaktionen.
Av-adenylylatorer
De-AMPylering är omvänd reaktion där AMP-molekylen lossnar från aminosyrasidan av ett kedjeprotein.
Det finns tre kända mekanismer för denna reaktion. Bakteriet GS-ATas (GlnE) kodar för ett bipartitprotein med separata N-terminala AMPylerings- och C-terminala de-AMPyleringsdomäner vars aktivitet regleras av P II och tillhörande posttranslationella modifieringar. De-AMPylering av dess substrat AMPylerat glutaminsyntetas fortsätter genom en fosforolytisk reaktion mellan adenyl-tyrosin av GS och ortofosfat , vilket leder till bildandet av ADP och omodifierat glutaminsyntetas.
SidD, ett protein som introduceras i värdcellen av de patogena bakterierna Legionella pneumophila, de-AMPylates Rab1 ett värdprotein AMPylerat av ett annat Legionella pneumophila-enzym, AMPylase SidM. Även om fördelen för patogenen med att införa dessa två antagonistiska effektorer i värden fortfarande är oklar, innebär den biokemiska reaktionen som utförs av SidD användning av en fosfatasliknande domän för att katalysera det hydrolytiska avlägsnandet av AMP från tyrosin 77 i värdens Rab1.
I djurceller katalyseras avlägsnandet av AMP från treonin 518 från BiP/Grp78 av samma enzym, FICD, som AMPylates BiP. Till skillnad från bakteriet GS-ATas utför FICD båda reaktionerna med samma katalytiska domän.
Prokaryot
Bakteriell homeostas
AMPylation är involverad i bakteriell homeostas. Det mest kända exemplet är AMPylator GS-ATase (GlnE), som bidrar till komplex reglering av kvävemetabolism genom AMPylering av glutaminsyntetas som introducerades i AMPylation och DeAMPylation-delarna.
Ett annat exempel på AMPylatorer som spelar en roll vid bakteriell homeostas är klass I Fic AMPylators (FicT), som modifierar GyrB -subenheten av DNA -gyras, den bevarade tyrosinresten för ATP -bindning av ParE -subenhet vid Topoisomeras IV. Denna DNA -gyrasinaktivering genom AMPylering leder till aktivering av SOS -svar, vilket är det cellulära svaret på DNA -skada. Aktiviteten för FicT AMPylation är reversibel och leder bara till tillväxtstopp, men inte celldöd. Därför spelar FicT AMPylation en roll för att reglera cellstress, vilket visas i Wolbachia -bakterierna att nivån av FicT ökar som svar på doxycyklin.
En klass III Fic AMPylator NmFic av N. meningtidis har också visat sig modifiera AMPylate GyrB vid det konserverade tyrosinet för ATP -bindning. Detta visar att Fic -domäner är mycket bevarade, vilket indikerar den viktiga roll AMPylation spelar för att reglera cellulär stress hos bakterier. Regleringen av NmFic innefattar den koncentrationsberoende monomeriseringen och autoAMPylering för aktivering av NmFic-aktivitet.
Bakteriell patogenicitet
Bakterieproteiner, även kända som effektorer, har visat sig använda AMPylation. Effekter som VopS, IbpA och DrrA har visat sig AMPylate -värd GTPaser och orsakar förändringar av aktincytoskelet. GTPaser är vanliga mål för AMPylators. Rho , Rab och Arf GTPase -familjer är inblandade i aktin -cytoskelet -dynamik och vesikulär handel. De spelar också roller i cellulära kontrollmekanismer som fagocytos i värdcellen.
De patogen förbättrar eller förhindrar dess internalise genom att antingen inducera eller inhibera värdcell fagocytos . Vibrio parahaemolyticus är en gramnegativ bakterie som orsakar matförgiftning till följd av rå eller underkokt skaldjurskonsumtion hos människor. VopS, en typ III -effektor som finns i Vibrio parahaemolyticus , innehåller en Fic -domän som har ett bevarat HPFx (D/E) GN (G/K) R -motiv som innehåller en histidinrest som är väsentlig för AMPylering. VopS blockerar aktinmontering genom att modifiera treoninrester i switch 1 -regionen i Rho GTPaser. Överföringen av en AMP -enhet med användning av ATP till treoninresten resulterar i steriskt hinder och förhindrar därmed Rho GTPaser från att interagera med nedströms effektorer. VopS adenylerar också RhoA och celldelningscykel 42 (CDC42), vilket leder till en uppdelning av aktinfilamentnätverket. Som ett resultat är värdcellens aktinkytoskeletkontroll inaktiverad, vilket leder till cellavrundning.
IbpA utsöndras i eukaryota celler från H. somni , en gramnegativ bakterie hos nötkreatur som orsakar luftvägsepitelinfektion. Denna effektor innehåller två Fic-domäner vid den C-terminala regionen. AMPylering av IbpA Fic -domänen hos Rho -familjens GTPaser är ansvarig för dess cytotoxicitet. Båda Fic -domänerna har liknande effekter på värdcellernas cytoskelet som VopS. AMPyleringen på en tyrosinrest i switch 1 -regionen blockerar interaktionen mellan GTPaserna och nedströms substrat såsom PAK.
DrrA är Dot/Icm typ IV translokationssystemsubstrat DrrA från Legionella pneumophila . Det är effektorn som utsöndras av L. pneumophila för att modifiera GTPaser i värdcellerna. Denna modifiering ökar överlevnaden av bakterier i värdceller. DrrA består av Rab1b- specifik guanin-nukleotidbytesfaktor (GEF) -domän, en C-terminal lipidbindande domän och en N-terminal domän med oklara cytotoxiska egenskaper. Forskningsarbeten visar att N-terminal och full längd DrrA visar AMPylators aktivitet mot värdens Rab1b-protein (Ras-relaterat protein), som också är substratet för Rab1b GEF-domänen. Rab1b -protein är GTPas Rab för att reglera vesikeltransport och membransmältning. Adenyleringen av bakterier AMPylatorer förlänger GTP-bundet tillstånd av Rab1b. Således är effekten av effektor DrrA kopplad till fördelarna med bakteriernas vakuoler för deras replikering under infektionen.
Eukaryot
Växter och jäst har inga kända endogena AMPyleringsenzymer, men djurgenomer är utrustade med en enda kopia av en gen som kodar för ett Fic-domän AMPylas, som sannolikt förvärvades av en tidig förfader till djur via horisontell genöverföring från en prokaryot. Det humana proteinet som vanligtvis kallas FICD, hade tidigare identifierats som Huntingtin-associerat protein E (HypE; en uppgift som härrör från en jäst-tvåhybrid-skärm, men av tvivelaktig relevans, eftersom Huntingtin och HypE/FICD är lokaliserade till olika cellfack) . CG9523 Homologer i Drosophila melanogaster (CG9523) och C. elegans (Fic-1) har också uppmärksammats. Hos alla djur har FICD en liknande struktur. Det är ett typ II transmembrandomänprotein , med en kort cytoplasmatisk domän följt av membrananker som håller proteinet i det endoplasmatiska retikulum (ER) och den långa C-terminala delen som finns i ER och omfattar tetratricopeptid-repetitioner (TPR) följt av en katalytisk Fic domän.
Endoplasmatiska retiklet
Upptäckten av en djurcell AMPylas, följt av upptäckten av dess ER -lokalisering och att BiP är ett framträdande substrat för dess aktivitet var viktiga genombrott. BiP (även känd som Grp78) hade länge varit känt för att genomgå en inaktiverande post-translationell modifiering, men dess natur förblir svårfångad. Det antas allmänt vara ADP-ribosylering , det visar sig vara FICD-medierad AMPylering, eftersom inaktivering av FICD-genen i celler avskaffade all mätbar posttranslationell modifiering av BiP.
BiP är en ER-lokaliserad proteinkaperon vars aktivitet är tätt reglerad på transkriptionell nivå via ett genuttrycksprogram som kallas Unfolded Protein Response (UPR). UPR är en homeostatisk process som kopplar transkriptionshastigheten för BiP (och många andra proteiner) till bördan av utfällda proteiner i ER (så kallad ER-stress) för att upprätthålla ER- proteostas . AMPylation lägger till ytterligare ett snabbt post-translationellt lager av kontroll av BiP: s aktivitet, eftersom modifiering av Thr518 av BiP: s substratbindande domän med en AMP låser chaperonen till en inaktiv konformation. Denna modifiering används selektivt som ER -stressavtagning för att inaktivera överskott av BiP. När ER-stressen stiger igen, katalyserar samma enzym, FICD, den motsatta reaktionen, BiP de-AMPylation.
Ett krav på den strukturella grunden för BiP AMPylering och de-AMPylation växer gradvis fram, liksom ledtrådar till allostery som kan reglera växeln i FICD: s verksamhet men viktiga detaljer om denna process som den förekommer i celler återstår att upptäcka.
FICD: s roll i BiP AMPylation (och de-AMPylation) på Thr518 stöds väl av biokemiska och strukturella studier. Bevis har också presenterats att FICD under vissa omständigheter kan AMPylera en annan rest, Thr366 i BiP: s nukleotidbindande domän.
Caenorhabditis elegans
Fic-1 är det enda Fic-proteinet som finns i den genetiska koden för C. elegans . Det finns främst i ER -kärnhöljet för vuxna könsceller och embryotiska celler, men små mängder kan hittas i cytoplasman. Denna extra-ER-pool av FICD's-1 krediteras AMPylering av kärnhistoner och eEF1-A- typ-översättningsfaktorer inom nematoden.
Även om olika AMPyleringsnivåer inte skapade några märkbara effekter inom nematodens beteende eller fysiologi var Fic-1 knockout-maskar mer mottagliga för infektion av Pseudomonas aeruginosa jämfört med motsvarigheter med aktiva Fic-1-domäner, vilket innebar en koppling mellan AMPylering av cellulära mål och immunsvar inom nematoder.
Drosophila melanogaster
Flugor som saknar FICD (CG9523) har beskrivits som blinda. Ursprungligen tillskrivs denna defekt en roll för FICD på cellytan av kapitatautskott - en förmodad plats för neurotransmittoråtervinning men en senare studie involverade FICD -medierad AMPylering av BiP Thr366 i det visuella problemet
Klinisk betydelse
Det presynaptiska proteinet a-synuklein befanns vara ett mål för FICD AMPylering. Under HypE-medierad adenylylering av αSyn minskar aggregeringen av αSyn och både neurotoxicitet och ER-stress upptäcktes minska in vitro . Således är adenylylering av αSyn möjligen ett skyddande svar på ER -stress och αSyn -aggregering. Eftersom aSyn och FICD bor i olika avdelningar behöver ytterligare forskning göras för att bekräfta betydelsen av dessa påståenden.
Upptäckt
Kemiska handtag
Kemiska handtag används för att detektera post-translationellt modifierade proteiner. Nyligen finns det en N6pATP som innehåller en alkynyltagg (propargyl) vid N6 -positionen för adeninet i ATP. Denna N6pATP kombineras med klickreaktionen för att detektera AMPylerade proteiner. För att detektera okänt modifierat protein och märka VopS -substrat används ATP -derivat med fluorofor vid adenin N6 NH2 för att göra det.
Antikroppsbaserad metod
Antikropp är känd för sin höga affinitet och selektivitet, så det är det bra sättet att upptäcka AMPylerade proteiner. Nyligen används ɑ- AMP-antikroppar för att direkt detektera och isolera AMPylerade proteiner (särskilt AMPylerat tyrosin och AMPylerat treonin) från celler och celllysat. AMPylation är en posttranslationell modifiering, så det kommer att modifiera proteingenskaper genom att ge polär karaktär AMP och hydrofobicitet. Således, i stället för att använda antikroppar som detekterar en hel peptidsekvens, är att höja AMP -antikroppar direkt riktade mot specifika aminosyror att föredra.
Masspektrometri
Tidigare använde många vetenskapliga verk masspektrometri (MS) i olika fragmenteringslägen för att detektera AMPylerade peptider. Som svar på de distinkta fragmenteringsteknikerna sönderdelades AMPylerade proteinsekvenser vid olika delar av AMP. Medan elektronöverföringsdissociation (ETD) skapar minimala fragment och mindre komplicerade spektra, genererar kollisionsinducerad dissociation (CID) och högenergikollision (HCD) fragmentering karakteristiska joner som är lämpliga för identifiering av AMPylerade proteiner genom att generera flera AMP-fragment. På grund av AMP: s stabilitet är peptidfragmenteringsspektra enkla att läsa manuellt eller med sökmotorer.
Hämmare
Inhibitorer av protein AMPylation med hämmande konstanten (K i ) i intervallet 6-50 uM och minst 30-faldig selektivitet versus HypE har upptäckts.