Spinal muskelatrofi - Spinal muscular atrophy
| Spinal muskelatrofi | |
|---|---|
| Andra namn | Autosomal recessiv proximal spinal muskelatrofi, 5q spinal muskelatrofi |
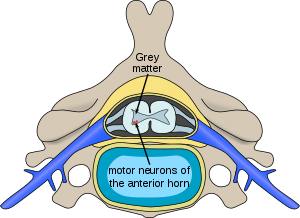 | |
| Plats för neuroner som påverkas av ryggmärgsatrofi i ryggmärgen | |
| Specialitet | Neurologi |
| Symtom | Progressiv muskelsvaghet |
| Komplikationer | Skolios , ledkontrakturer , lunginflammation |
| Typer | Skriv 0 till typ 4 |
| Orsaker | Mutation i SMN1 |
| Diagnostisk metod | Genetiska tester |
| Differentialdiagnos | Medfödd muskeldystrofi , Duchenne muskeldystrofi , Prader-Willis syndrom |
| Behandling | Stödjande vård , mediciner |
| Medicin | Nusinersen , onasemnogen abeparvovec , Risdiplam |
| Prognos | Varierar efter typ |
| Frekvens | 1 av 10 000 personer |
Spinal muskelatrofi ( SMA ) är en sällsynt neuromuskulär sjukdom som resulterar i förlust av motorneuroner och progressivt muskelsvinn . Det diagnostiseras vanligtvis i spädbarn eller tidig barndom och om det inte behandlas är det den vanligaste genetiska orsaken till spädbarnsdöd. Det kan också dyka upp senare i livet och sedan få ett mildare sjukdomsförlopp. Det gemensamma särdraget är progressiv svaghet i frivilliga muskler, med armar, ben och andningsmuskler som först påverkas. Tillhörande problem kan inkludera dålig huvudkontroll, svårigheter att svälja, skolios och ledkontrakturer .
Startåldern och svårighetsgraden av symtom utgör grunden för den traditionella klassificeringen av ryggradsmuskulär atrofi i ett antal typer.
Spinal muskelatrofi beror på en abnormitet ( mutation ) i SMN1 -genen som kodar för SMN , ett protein som är nödvändigt för överlevnad av motorneuroner . Förlust av dessa neuroner i ryggmärgen förhindrar signalering mellan hjärnan och skelettmusklerna . En annan gen, SMN2 , anses vara en sjukdomsmodifierande gen, eftersom vanligtvis ju mer SMN2 kopierar, desto mildare är sjukdomsförloppet. Diagnosen SMA är baserad på symtom och bekräftas genom genetisk testning .
Vanligtvis, mutationen i SMN1 är genen ärvs från båda föräldrarna i en autosomal recessiv sätt, även om i omkring 2% av fallen den inträffar under tidig utveckling ( de novo ). Förekomsten av ryggradsmuskulaturatrofi över hela världen varierar från cirka 1 av 4 000 födda till cirka 1 av 16 000 födda, med 1 av 7 000 och 1 av 10 000 som vanligtvis citeras för Europa respektive USA.
Utfall i det naturliga sjukdomsförloppet varierar från död inom några veckor efter födseln i de mest akuta fallen till normal livslängd i de utdragna SMA -formerna. Införandet av kausativa behandlingar 2016 har förbättrat resultaten avsevärt. Mediciner som riktar den genetiska orsaken till sjukdomen inkluderar nusinersen , risdiplam , och genterapi medicinering onasemnogene abeparvovec . Stödjande vård inkluderar sjukgymnastik , arbetsterapi, andningsstöd, näringsstöd, ortopediska ingrepp och rörlighetsstöd .
Klassificering
5q SMA är en enda sjukdom som uppträder över ett stort antal svårighetsgrader och påverkar spädbarn genom vuxna. Innan dess genetik förstodes, trodde man att dess varierande manifestationer var olika sjukdomar- Werdnig – Hoffmanns sjukdom när små barn drabbades och Kugelberg – Welanders sjukdom för sena fall.
1990 insåg man att dessa separata sjukdomar bildade ett spektrum av samma sjukdom. Ryggradsmuskulär atrofi klassificerades sedan i 3-5 kliniska typer baserat antingen på symtomåldern eller den maximala motoriska funktionen som uppnås. För närvarande är konsensus att fenotypen för ryggradsmuskulär atrofi spänner över ett kontinuum av symtom utan tydlig avgränsning av undertyper. Den traditionella klassificeringen, som beskrivs i tabellen nedan, används dock fortfarande idag både inom klinisk forskning och ibland kontroversiellt som ett kriterium för tillgång till terapier.
| Typ | Eponym | Vanlig startålder | Naturhistoria (utan farmakologisk behandling) | OMIM |
|---|---|---|---|---|
| SMA 0 | Prenatal | Symtom observeras vid födseln och blir ofta uppenbara under prenatalperioden som minskad fosterrörelse. Berörda barn har vanligtvis bara en enda kopia av SMN2 -genen och överlever vanligtvis bara några veckor, även med andningsstöd dygnet runt. Denna blankett är mycket sällsynt - står för ca. 2% av fallen. | ||
|
SMA 1 (Infantil) |
Werdnig – Hoffmanns sjukdom | 0–6 månader | Denna form diagnostiseras hos cirka 50% av patienterna, hos vilka sjukdomen manifesteras under de första veckorna eller månaderna av livet. SMA börjar då snabbt och oväntat, med olika muskelgrupper som misslyckas successivt. Spädbarn lär sig aldrig att sitta utan stöd och förlorar mest gradvis större delen av sin muskelfunktion. Död orsakas vanligtvis av svikt i andningsmusklerna som orsakas av lunginflammation (ofta aspirationspneumoni ). Om inte andningsstöd och/eller farmakologisk behandling erbjuds tidigt, överlever inte barn som diagnostiserats med SMA typ 1 i allmänhet över två års ålder. Med rätt andningsstöd är det känt att personer med mildare SMA typ 1-fenotyper, som står för cirka 10% av SMA 1-fallen, överlever till tonåren och vuxenlivet även utan farmakologisk behandling, även om de alltid kräver vård dygnet runt. | 253300 |
|
SMA 2 (mellanliggande) |
Dubowitz sjukdom | 6–18 månader | Mellanformen, som diagnostiserats hos cirka 20% av patienterna, betecknar människor som kunde behålla en sittande ställning åtminstone någon gång i livet men aldrig lärt sig att gå utan stöd. Svaghetens början märks vanligtvis en tid mellan 6 och 18 månaders liv. Framstegen är kända för att variera kraftigt, vissa människor blir gradvis svagare med tiden medan andra genom noggrant underhåll förblir relativt stabila. Kroppsmusklerna försvagas, och andningssystemet är ett stort bekymmer, liksom muskelkontrakturer och ryggradskrökning. Medellivslängden minskar, även om de flesta med SMA 2 lever långt in i vuxen ålder även utan behandling. | 253550 |
|
SMA 3 (ungdom) |
Kugelberg – Welanders sjukdom | > 12 månader | Ungdomsformen, som diagnostiseras hos cirka 30% av patienterna, manifesterar sig efter 12 månaders ålder, eller efter att barnen redan har lärt sig att göra åtminstone några oberoende steg. Sjukdomen utvecklas långsamt, och de flesta med SMA 3 förlorar gångförmågan någon gång i livet, vilket kräver rörelsestöd. Andningsinvolvering är sällsynt och livslängden är normal eller nästan normal. | 253400 |
|
SMA 4 (vuxenstart) |
Vuxen ålder | Detta betecknar den vuxna debutformen, ibland också klassificerad som en senstartad SMA typ 3. Det förekommer i ca. 5% av patienterna och uppträder vanligtvis under det tredje eller fjärde decenniet av livet. Symtomen består av gradvis försvagning av benmusklerna, vilket ofta gör det nödvändigt för patienten att använda gånghjälpmedel. Andra komplikationer är sällsynta och livslängden påverkas inte. | 271150 |
För enkelhets skull klassificerar vårdfokuserade publikationer patienter i "icke-sitter", "sitters" och "walkers" baserat på deras faktiska funktionella status.
Motorisk utveckling och sjukdomsprogression hos personer med SMA bedöms vanligtvis med hjälp av validerade funktionsskalor-CHOP-INTEND (Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders) eller HINE (Hammersmith Infant Neurological Examination) hos spädbarn; och antingen MFM (Motor Function Measure) eller en av flera varianter av HFMS (Hammersmith Functional Motor Scale) hos äldre patienter.
Den självtecknade etiketten Werdnig – Hoffmanns sjukdom (ibland felstavad med ett enda n ) hänvisar till de tidigaste kliniska beskrivningarna av barndomens SMA av Johann Hoffmann och Guido Werdnig . Sambenämnt begrepp Kugelberg – Welanders sjukdom är efter Erik Klas Hendrik Kugelberg (1913–1983) och Lisa Welander (1909–2001) som först dokumenterade den sena starten och skilde den från muskeldystrofi. Mycket sällan använd Dubowitz sjukdom (att inte förväxla med Dubowitz syndrom ) är uppkallad efter Victor Dubowitz , en engelsk neurolog som författat flera studier om den mellanliggande SMA -fenotypen.
tecken och symtom
Symtomen varierar beroende på SMA -typ, sjukdomsstadiet samt individuella faktorer. Tecken och symtom nedan är vanligast vid den allvarliga SMA typ 0/I:
- Areflexi , särskilt i extremiteter
- Övergripande muskelsvaghet , dålig muskelton , slapphet eller en tendens att floppa
- Svårigheter att uppnå utvecklingsmilstolpar, svårigheter att sitta/stå/gå
- Hos små barn: intagande av en groda-benställning när man sitter (höfterna bortförda och knäna böjda)
- Förlust av styrka i andningsmusklerna : svag hosta , svagt gråt (spädbarn), ansamling av sekret i lungorna eller halsen, andningssvårigheter
- Klockformad bål (orsakad av att endast använda magmusklerna för andning) vid svår SMA-typ
- Fascikulationer (ryckningar) i tungan
- Svårt att suga eller svälja, dålig matning
Orsaker
Spinal muskelatrofi orsakas av en genetisk mutation i SMN1 -genen .
Mänsklig kromosom 5 innehåller två nästan identiska gener på plats 5q13: en telomerisk kopia SMN1 och en centromerisk kopia SMN2 . Hos friska individer koder SMN1 -genen överlevnaden av motorneuronprotein (SMN) som, som namnet säger, spelar en avgörande roll för motorneurons överlevnad . Den SMN2 genen, å andra sidan - på grund av en variation i en enda nukleotid (840.C → T) - genomgår alternativ splitsning vid korsningen av intron 6 till exon 8, med endast 10-20% av SMN2 transkript som kodar en fullt funktionell överlevnad av motorneuronprotein (SMN-fl) och 80–90% av transkripten vilket resulterar i en stympad proteinförening (SMNΔ7) som snabbt bryts ned i cellen.
I individer som drabbats av SMA, den SMN1 genen muteras på ett sådant sätt att den är oförmögen att korrekt kod SMN-proteinet - på grund av antingen en deletion som inträffar vid exon 7 eller till andra punktmutationer (vilket ofta resulterar i den funktionella omvandlingen av SMN1 sekvens till SMN2 ). Nästan alla människor har dock minst en funktionell kopia av SMN2 -genen (där de flesta har 2–4 av dem) som fortfarande kodar 10–20% av den vanliga nivån av SMN -proteinet, vilket gör att vissa neuroner kan överleva. På sikt resulterar dock den minskade tillgängligheten av SMN -proteinet i gradvis död av motorneuronceller i det främre hornet i ryggmärgen och hjärnan. Skelettmuskler , som alla är beroende av dessa motoriska nervceller för neural ingång, har nu minskad innervation (även kallad denervation ) och har därför minskad input från centrala nervsystemet (CNS). Minskad impulsöverföring genom motorneuronerna leder till minskad kontraktil aktivitet hos den denerverade muskeln. Följaktligen genomgår denerverade muskler progressiv atrofi (bortfall).
Muskler i nedre extremiteterna påverkas vanligtvis först, följt av muskler i övre extremiteter, ryggrad och nacke och, i svårare fall, lung- och mastikationsmuskler. Proximala muskler påverkas alltid tidigare och i högre grad än distala muskler.
Svårighetsgraden av SMA -symptom är i stor utsträckning relaterad till hur väl de återstående SMN2 -generna kan kompensera för förlusten av funktion hos SMN1 . Detta beror delvis på antalet kopior av SMN2 -genen som finns på kromosomen. Medan friska individer vanligtvis bär två SMN2 -genkopior , kan personer med SMA ha allt mellan 1 och 5 (eller fler) av dem; ju fler SMN2 -kopior , desto mildare är sjukdomens svårighetsgrad. Således har de flesta SMA typ I -spädbarn en eller två SMN2 -kopior ; personer med SMA II och III har vanligtvis minst tre SMN2 -kopior ; och personer med SMA IV har normalt minst fyra av dem. Korrelationen mellan symptomens svårighetsgrad och SMN2 -kopiantalet är emellertid inte absolut och det verkar finnas andra faktorer som påverkar sjukdomsfenotypen.
Spinal muskelatrofi ärvs i ett autosomalt recessivt mönster, vilket innebär att den defekta genen ligger på en autosom . Två kopior av den defekta genen - en från varje förälder - krävs för att ärva sjukdomen: föräldrarna kan vara bärare och inte påverkas personligen. SMA verkar devovo (dvs utan ärftliga orsaker) i cirka 2–4% av fallen.
Spinal muskelatrofi påverkar individer i alla etniska grupper, till skillnad från andra välkända autosomala recessiva störningar, såsom sicklecellssjukdom och cystisk fibros , som har betydande skillnader i förekomst bland etniska grupper. Den övergripande prevalensen av SMA, av alla typer och i alla etniska grupper, ligger i intervallet 1 per 10 000 individer; genfrekvensen är cirka 1: 100, därför är ungefär var femte person bärare. Det finns inga kända hälsokonsekvenser av att vara transportör. En person kan bara lära sig bärarstatus om ens barn påverkas av SMA eller genom att ha SMN1 -genen sekvenserad.
Berörda syskon har vanligtvis en mycket liknande form av SMA. Emellertid förekommer förekomst av olika SMA -typer bland syskon - även om det är sällsynt kan dessa fall bero på ytterligare de novo -raderingar av SMN -genen, utan att NAIP -genen involveras , eller skillnaderna i SMN2 -kopiantal .
Diagnos
SMA diagnostiseras med hjälp av genetisk testning som detekterar homozygot radering av SMN1 -genen i över 95% av fallen och en sammansatt SMN1 -mutation hos de återstående patienterna. Genetiska tester utförs vanligtvis med hjälp av ett blodprov, och MLPA är en av de vanligare genetiska testteknikerna, eftersom det också gör det möjligt att fastställa antalet SMN2 -genkopior , vilket har klinisk betydelse.
Symptomatiskt kan SMA diagnostiseras med viss grad endast hos barn med akut form som uppvisar en progressiv sjukdom med paradoxal andning , bilateral låg muskelton och frånvarande senreflexer.
Tidig diagnos
Tidig diagnos av SMA, i det asymptomatiska stadiet av sjukdomen, möjliggör
Preimplantationstest
Preimplantation genetisk diagnos kan användas för att screena för SMA-drabbade embryon under in vitro-fertilisering .
Prenatal testning
Prenatal testning för SMA är möjlig genom provtagning av korionisk villus , cellfri foster-DNA- analys och andra metoder.
Nyfödd screening
Rutinmässig nyfödd screening för SMA blir allt vanligare i utvecklade länder, med tanke på tillgängligheten av orsakande behandlingar som är mest effektiva i det asymptomatiska stadiet av sjukdomen. År 2018 lades nyfödd screening för SMA till den amerikanska listan över rekommenderade tester för nyfödda screening och från och med april 2020 har den antagits i 39 amerikanska stater. Från och med maj 2021 har SMA -screening för nyfödda implementerats i Taiwan och genomförs i Australien, Belgien, Kanada, Frankrike, Tyskland, Nederländerna, Polen, Serbien och Slovenien. Dessutom genomförs pilotprojekt i Australien, Kina, Italien och Japan.
Bärarprovning
De som riskerar att vara bärare av SMN1 -borttagning och därmed riskerar att få avkomma drabbade av SMA kan genomgå bäraranalys med hjälp av ett blod- eller salivprov. Den American College of obstetriker och gynekologer rekommenderar alla människor funderar på att bli gravid testas för att se om de är bärare. Bärfrekvensen för SMA är jämförbar med andra sjukdomar som talassemi och i en nordindisk kohort har visat sig vara 1 av 38. Genetisk testning kommer dock inte att kunna identifiera alla individer i riskzonen eftersom cirka 2% av fallen orsakas av de novo -mutationer och 5% av normalpopulationerna har två kopior av SMN1 på samma kromosom, vilket gör det möjligt att vara bärare genom att ha en kromosom med två kopior och en andra kromosom med nollkopior. Denna situation kommer att leda till ett falskt negativt resultat, eftersom bärarstatus inte kommer att detekteras korrekt av ett traditionellt genetiskt test.
Förvaltning
Hanteringen av SMA varierar beroende på svårighetsgrad och typ. I de allvarligaste formerna (typ 0/1) har individer den största muskelsvagheten som kräver snabba ingripanden. Medan den minst allvarliga formen (typ 4/vuxen debut) kan individer inte söka vissa aspekter av vård förrän senare (decennier) i livet. Medan typer av SMA och individer mellan varje typ kan skilja sig åt kan därför specifika aspekter av individens vård skilja sig åt.
Medicin
Nusinersen (marknadsförs som Spinraza) används för att behandla ryggradsmuskulatur. Det är en antisensnukleotid som modifierar den alternativa splitsningen av SMN2 -genen. Det ges direkt till centrala nervsystemet med hjälp av en intratekal injektion . Nusinersen förlänger överlevnaden och förbättrar motorisk funktion hos spädbarn med SMA. Den godkändes för användning i USA 2016 och för användning i EU 2017.
Onasemnogen abeparvovec (marknadsförs som Zolgensma) är en genterapibehandling som använder självkompletterande adenoassocierat virus typ 9 (scAAV-9) som en vektor för att leverera SMN1- transgenen. Behandlingen godkändes först i USA i maj 2019 som en intravenös formulering för barn under 24 månader. Godkännande i Europeiska unionen, Japan och andra länder följde, om än ofta med olika godkännandeomfattningar.
Risdiplam (marknadsförs som Evrysdi) är ett läkemedel som tas i munnen i flytande form. Det är ett pyridazinderivat som fungerar genom att öka mängden funktionellt överlevande motorneuronprotein som produceras av SMN2 -genen genom att modifiera dess skarvningsmönster . Risdiplam godkändes först för medicinskt bruk i USA i augusti 2020 och har sedan dess godkänts i över 30 länder.
Andas
Andningssystemet är det vanligaste systemet som påverkas och komplikationerna är den vanligaste dödsorsaken i SMA -typerna 0/1 och 2. SMA typ 3 kan ha liknande andningsproblem, men det är mer sällsynt. De komplikationer som uppstår på grund av försvagade interkostala muskler på grund av bristen på stimulering från nerven. Membranet påverkas mindre än de interkostala musklerna. När de försvagats återhämtar musklerna aldrig helt samma funktionella förmåga att hjälpa till med andning och hosta samt andra funktioner. Därför är andningen svårare och utgör en risk för att inte få tillräckligt med syre/ytlig andning och otillräckligt frigörande av luftvägsutsöndringar. Dessa problem uppstår vanligare när du sover, när musklerna är mer avslappnade. Sväljande muskler i svalget kan påverkas, vilket leder till aspiration i kombination med en dålig hostmekanism ökar sannolikheten för infektion/ lunginflammation . Mobilisering och rensning av sekret innebär manuell eller mekanisk bröstfysioterapi med postural dränering och manuell eller mekanisk hosthjälpanordning. För att hjälpa till med andningen används icke-invasiv ventilation ( BiPAP ) ofta och trakeostomi kan ibland utföras i svårare fall. båda ventilationsmetoderna förlänger överlevnaden i jämförbar grad, även om trakeostomi förhindrar talutveckling.
Näring
Ju allvarligare typen av SMA, desto mer sannolikt kommer det att ha näringsrelaterade hälsoproblem. Hälsoproblem kan innefatta svårigheter att mata, käkeöppning, tugga och svälja. Individer med sådana svårigheter kan ha ökad risk för över- eller undernäring, misslyckande med att trivas och aspiration. Andra näringsfrågor, särskilt hos individer som inte är ambulatoriska (mer allvarliga typer av SMA), inkluderar mat som inte passerar tillräckligt snabbt i magen, gastrisk återflöde, förstoppning, kräkningar och uppblåsthet. Däri kan det vara nödvändigt för SMA typ I och personer med svårare typ II att ha matningsrör eller gastrostomi . Dessutom försämrar metaboliska abnormiteter som härrör från SMA β-oxidation av fettsyror i muskler och kan leda till organisk acidemi och därmed muskelskada, särskilt vid fasta. Det föreslås att personer med SMA, särskilt de med svårare former av sjukdomen, minskar intaget av fett och undviker långvarig fasta (dvs. äter oftare än friska människor) samt väljer mjukare mat för att undvika aspiration. Under en akut sjukdom, särskilt hos barn, kan näringsproblem först uppstå eller kan förvärra ett befintligt problem (exempelvis aspiration) samt orsaka andra hälsoproblem som elektrolyt och blodsockerstörningar.
Ortopedi
Skelettproblem i samband med svaga muskler i SMA inkluderar trånga leder med begränsat rörelseomfång, höftförskjutningar, ryggmärgsdeformitet, osteopeni, ökad risk för frakturer och smärta. Svaga muskler som normalt stabiliserar leder som ryggraden leder till utveckling av kyfos och/eller skolios och ledkontraktur. Ryggradsfusion utförs ibland hos personer med SMA I/II när de når 8–10 år för att lindra trycket från en deformerad ryggrad på lungorna. Dessutom kan orörliga individer, hållning och position på mobila enheter samt rörelseövningar och benförstärkning vara viktiga för att förhindra komplikationer. Personer med SMA kan också ha stor nytta av olika former av sjukgymnastik , arbetsterapi och sjukgymnastik.
Ortotiska anordningar kan användas för att stödja kroppen och för att underlätta promenader. Till exempel används ortoser som AFO (fotled ortoser) för att stabilisera foten och för att underlätta gång, TLSO (thorax ländryg sakral ortoser) används för att stabilisera bålen. Hjälpmedel kan hjälpa till att hantera rörelser och daglig aktivitet och kraftigt öka livskvaliteten.
Övrig
Även om hjärtat inte är en fråga om rutinmässig oro, har en koppling mellan SMA och vissa hjärtsjukdomar föreslagits.
Barn med SMA skiljer sig inte från den allmänna befolkningen i sitt beteende; deras kognitiva utveckling kan vara något snabbare, och vissa aspekter av deras intelligens ligger över genomsnittet. Trots sin funktionsnedsättning rapporterar SMA-drabbade personer om hög tillfredsställelse från livet.
Palliativ vård inom SMA har standardiserats i Consensus Statement for Standard of Care in Spinal Muscular Atrophy som har rekommenderats för standardadoption över hela världen.
Prognos
I brist på farmakologisk behandling tenderar personer med SMA att försämras med tiden. Nyligen har överlevnaden ökat hos svåra SMA -patienter med aggressivt och proaktivt stödjande andnings- och näringsstöd.
Om de inte behandlas når majoriteten av barn som diagnostiserats med SMA typ 0 och 1 inte 4 år, återkommande andningsproblem är den främsta dödsorsaken. Med rätt vård lever mildare SMA typ I -fall (som står för cirka 10% av alla SMA1 -fall) in i vuxen ålder. Långsiktig överlevnad i SMA typ I är inte tillräckligt bevisad; Från och med 2007 tycks dock framstegen inom andningsstöd ha minskat dödligheten.
I obehandlad SMA typ II går sjukdomsförloppet långsammare och livslängden är mindre än den friska befolkningen. Död före 20 års ålder är vanligt, även om många människor med SMA lever för att bli föräldrar och morföräldrar. SMA typ III har normal eller nästan normal livslängd om vårdstandarder följs. Typ IV, vuxenstartad SMA innebär vanligtvis endast rörelsehinder och påverkar inte livslängden.
Forskningsriktningar
Sedan den bakomliggande genetiska orsaken till SMA identifierades 1995 har flera terapeutiska tillvägagångssätt föreslagits och undersökts som främst fokuserar på att öka tillgängligheten av SMN -protein i motorneuroner. De viktigaste forskningsinriktningarna har varit följande:
SMN1 genersättning
Genterapi i SMA syftar till att återställa den SMN1 genfunktion genom insättning av speciellt utformad nukleotid -sekvens (en SMN1 transgen ) in i cellkärnan med hjälp av en viral vektor . Detta tillvägagångssätt har utnyttjats av den första godkända genterapin för SMA, scAAV -9 -baserad behandling onasemnogen abeparvovec.
SMN2 alternativ splitsningsmodulering
Detta tillvägagångssätt syftar till att modifiera den alternativa splitsningen av SMN2- genen för att tvinga den att koda för högre andel av SMN-protein i full längd. Ibland kallas det också genomvandling, eftersom det försöker omvandla SMN2 -genen funktionellt till SMN1 -genen. Det är den terapeutiska mekanismen för de godkända medicinerna nusinersen och risdiplam.
Branaplam är en annan SMN2 -skarvningsmodulator som har nått det kliniska utvecklingsstadiet.
Historiskt sett undersökte denna forskningsriktning även andra molekyler. RG3039, även känt som Quinazoline495, var ett proprietärt kinazolinderivat utvecklat av Repligen och licensierat till Pfizer i mars 2014 som avbröts strax efter att bara ha avslutat fas I -försök. PTK-SMA1 var en patenterad småmolekylerad splitsningsmodulator från tetracyklingruppen som utvecklats av Paratek Pharmaceuticals och skulle gå in i klinisk utveckling 2010, men det hände dock aldrig. RG7800, utvecklat av Hoffmann-La Roche, var en molekyl liknande risdiplam som har genomgått fas I-testning men avbröts på grund av djurtoxicitet. Tidiga ledningar inkluderade också natriumortovanadat och aclarubicin .
Morpholino -typ antisense -oligonukleotider, med samma cellulära mål som nusinersen, förblir föremål för forskning vid behandling av SMA och andra singelgensjukdomar, inklusive vid University College London och vid University of Oxford .
SMN2 genaktivering
Detta tillvägagångssätt syftar till att öka uttrycket (aktiviteten) för SMN2- genen, vilket ökar mängden fullt tillgängligt SMN-protein.
- Oral salbutamol (albuterol), ett populärt astmamedicin , visade terapeutisk potential vid SMA både in vitro och i tre småskaliga kliniska prövningar med patienter med SMA typ 2 och 3, förutom att erbjuda andningsförmåner.
Några föreningar visade initialt lovande men misslyckades med att visa effekt i kliniska prövningar. Butyrater ( natriumbutyrat och natriumfenylbutyrat ) innehöll ett visst löfte i in vitro -studier men en klinisk prövning med symtomatiska personer bekräftade inte deras effekt. Ytterligare en klinisk prövning med pre-symptomatiska typer av 1-2 spädbarn slutfördes 2015 men inga resultat har publicerats.
- Valproinsyra (VPA) användes i SMA på experimentell basis under 1990- och 2000 -talen eftersom forskning in vitro föreslog dess måttliga effektivitet. Det visade dock ingen effekt i uppnåbara koncentrationer när det utsattes för en stor klinisk prövning. Det har också föreslagits att det kan vara effektivt hos en delmängd av personer med SMA men dess verkan kan undertryckas av fettsyratranslokas hos andra. Andra hävdar att det faktiskt kan förvärra SMA -symtom. Det används för närvarande inte på grund av risken för allvarliga biverkningar relaterade till långvarig användning. En metaanalys från 2019 föreslog att VPA kan erbjuda fördelar, även utan att förbättra funktionell poäng.
- Hydroxikarbamid (hydroxyurea) visade sig vara effektivt i musmodeller och därefter kommersiellt undersökt av Novo Nordisk , Danmark, men visade ingen effekt på personer med SMA i efterföljande kliniska prövningar.
Föreningar som ökade SMN2 -aktivitet in vitro men som inte tog sig till det kliniska stadiet inkluderar tillväxthormon , olika histondeacetylashämmare , bensamid M344, hydroxaminsyror (CBHA, SBHA, entinostat , panobinostat , trichostatin A , vorinostat ), prolaktin samt naturliga polyfenolföreningar som resveratrol och curcumin . Celecoxib , en p38 pathway- aktivator, används ibland off-label av personer med SMA baserat på en enda djurstudie men sådan användning stöds inte av klinisk forskning.
SMN -stabilisering
SMN-stabilisering syftar till att stabilisera SMNΔ7-proteinet, det kortlivade defekta proteinet som kodas av SMN2- genen, så att det kan upprätthålla neuronala celler.
Inga föreningar har förts vidare till det kliniska stadiet. Aminoglykosider visade förmåga att öka tillgängligheten av SMN -protein i två studier. Indoprofen gav ett löfte in vitro .
Neuroprotektion
Neuroskyddande läkemedel syftar till att möjliggöra överlevnad av motorneuroner även med låga nivåer av SMN -protein.
- Olesoxime var en proprietär neuroprotektiv förening som utvecklats av det franska företaget Trophos , som senare förvärvades av Hoffmann-La Roche , som visade stabiliserande effekt i en fas II-klinisk studie med personer med SMA typ 2 och 3. Dess utveckling avbröts 2018 med tanke på konkurrens med nusinersen och sämre än väntat data från en öppen försöksversion.
Av kliniskt studerade föreningar som inte visade effekt innehöll tyrotropinfrisättande hormon (TRH) något löfte i en öppen, okontrollerad klinisk prövning men visade sig inte vara effektiv i en efterföljande dubbelblind placebokontrollerad studie. Riluzole , ett läkemedel som har en mild klinisk fördel vid amyotrofisk lateral skleros , föreslogs testas på liknande sätt i SMA; en studie 2008–2010 på SMA typ 2 och 3 stoppades dock tidigt på grund av bristande tillfredsställande resultat. Andra föreningar som hade någon neuroprotektiv effekt i in vitro- forskning men som aldrig flyttade till in vivo- studier inkluderar β-laktamantibiotika (t.ex. ceftriaxon ) och follistatin .
Muskel restaurering
Detta tillvägagångssätt syftar till att motverka effekten av SMA genom att rikta in muskelvävnaden istället för neuroner.
- Reldesemtiv (CK-2127107, CK-107) är en skelett- troponinaktivator utvecklad av Cytokinetics i samarbete med Astellas . Läkemedlet syftar till att öka muskelreaktiviteten trots minskad neural signal. Molekylen visade viss framgång i kliniska fas II -studier på ungdomar och vuxna med SMA -typ 2, 3 och 4.
- Apitegromab (SRK-015) är monoklonal antikropp som fungerar för att blockera aktiveringen av ett skelettmuskelprotein myostatin , vilket främjar muskelvävnadstillväxt. Från och med 2021 visade molekylen framgång som en experimentell tilläggsbehandling hos barn och vuxna patienter som behandlats med nusinersen.
Stamceller
Även om stamceller aldrig utgör en del av någon erkänd terapi för SMA, utnyttjar ett antal privata företag, vanligtvis i länder med slapp myndighetstillsyn, mediernas hype och marknadsför stamcellsinjektioner som ett "botemedel" för ett stort antal sjukdomar , inklusive SMA. Den medicinska konsensusen är att sådana förfaranden inte ger någon klinisk nytta samtidigt som de medför betydande risker, därför avråds personer med SMA från dem. Under 2013–2014 fick ett litet antal SMA1-barn i Italien domstolstillsatta stamcellsinjektioner efter uthållighetsbedrägeriet , men behandlingen rapporterades ha ingen effekt
Register
Personer med SMA i Europeiska unionen kan delta i klinisk forskning genom att skriva in sina uppgifter i register som hanteras av TREAT-NMD .
Se även
Referenser
Vidare läsning
- Parano E, Pavone L, Falsaperla R, Trifiletti R, Wang C (augusti 1996). "Molekylär grund för fenotypisk heterogenitet hos syskon med ryggradsmuskulär atrofi". Annals of Neurology . 40 (2): 247–51. doi : 10.1002/ana.410400219 . PMID 8773609 . S2CID 42514712 .
- Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (augusti 2007). "Konsensusuttalande för vårdstandard vid spinal muskelatrofi". Journal of Child Neurology . 22 (8): 1027–49. doi : 10.1177/0883073807305788 . PMID 17761659 . S2CID 6478040 .
externa länkar
| Klassificering | |
|---|---|
| Externa resurser |
- Spinal muskelatrofi vid Curlie
- SMA på NINDS


