Pre-Bötzinger komplex - Pre-Bötzinger complex
| Pre-Bötzinger komplex | |
|---|---|
| Identifierare | |
| NeuroLex ID | nlx_152600 |
| Anatomiska termer för neuroanatomi | |
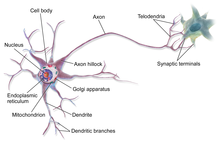
Den pre-Bötzinger komplex (preBötC) är ett kluster av intemeuroner i det ventrala andnings grupp av medulla av hjärnstammen . Detta komplex har visat sig vara väsentligt för genereringen av andningsrytmen hos däggdjur. Den exakta mekanismen för rytmgenerering och överföring till motorkärnor är fortfarande kontroversiell och ämnet för mycket forskning.
Flera syntetiska föreningar har visat sig verka på neuroner som är specifika för preBötC, de flesta är selektiva agonister eller antagonister mot receptorsubtyper på neuroner i närheten. Eftersom många av dessa neuroner uttrycker GABA- , glutamat- , serotonin- och adenosinreceptorer , är kemikalier som är skräddarsydda för att binda på dessa platser mest effektiva för att förändra andningsrytmen.
Adenosin modulerar den preBötC output via aktivering av de A 1 och A 2A -receptorundertyper. En adenosin A 1 -receptoragonist har visat sig försämra preBötC-rytmogenes oberoende av neurotransmittorerna GABA och glycin in vitro-preparat från 0-7 dagar gamla möss. Annan syntetisk läkemedels specifika för adenosin A 2A -receptorsubtyp är CGS-21680 , som har visat sig orsaka apnéer i 14- till 21-dagar gamla råttungar in vivo . Av denna anledning har den använts som en modell för att studera patologiska tillstånd som apné av prematuritet och plötsligt spädbarnsdödssyndrom .
Regionen är uppkallad efter Silvaner (Boetzinger) vin som serveras vid den konferens där regionen fick namnet.
Beskrivning
Pre-Bötzinger-komplexet (pre-BötC), en projektion av Botzinger-komplexet , spelar en viktig roll för att reglera andningen hos däggdjur . Det är en av de fyra cellgrupperna i Ventral Respiratory Group (VRG). Det antas att pre-Bötzinger-komplexet är huvudplatsen för de rytmiska mönstergenereringskretsarna som är involverade i andningen. Den innehåller också celler som initierar spontan andning. Forskning bedrivs om de mekanismer som är inblandade, men det är för närvarande oklart hur detta internuronsystem regleras.
Rhythmogenesis, generering av rytm, moduleras av membranegenskaper och synaptiska interaktioner som inträffar i intemeuroner, inneboende-spricker pacemaker neuroner och follower neuroner inom pre-Bötzinger komplex. Tillsammans utgör dessa neuroner ett inneboende nätverk som kan regleras av ett stort antal neurotransmittorer , aminosyror och kemiska signaler, såsom adenosin , GABA och glycin .
Pre-Bötzinger-komplexet producerar två typer av andningsrytmer under normala syrenivåer. Vid eupné eller normal andning genererar pre-BötC en rytm som är snabb och låg i amplitud. Suckar, å andra sidan, består av en långsam och stor amplitudrytm. Varje typ av rytm genereras av samma nervceller i pre-Bötzinger-komplexet, men genom olika mekanismer, receptorer och jonströmmar som styrs av förändringar i organismens beteende eller miljö. Under låga syrenivåer måste pre-Bötzinger-komplexet ordna om neuronernas aktivitet och kräver hjälp av andra hjärnstrukturer, som pons , för att generera gasning. Gasning kännetecknas av en rytm som har snabbare stigning, kortare skurar och lägre frekvens.
Pre-BötC kan generera stabila andningsrytmer med varierande grader av syresättning och under olika förhållanden i sin miljö med hjälp av nätverkskonfiguration och neuromodulering . Strukturen innehåller ett kärnnätverk inom ett större nätverk av sammankopplade kärnor som fungerar för att upprätthålla andningsrytmer och andningens neuroplasticitet och tillståndsberoende. Två viktiga funktioner i pre-BötC är dess stabilitet och dess förmåga att anpassa sig till förändrade miljö- och beteendevillkor.
Strukturera
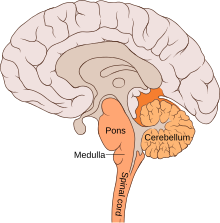
Beläget i den ventrolaterala medulla , innehåller pre-Bötzinger-komplexet undernätverk som har distinkta synapser och inneboende membranegenskaper. Hos däggdjur finns andningsnätverket och kärnorna som kontrollerar andningsmodulering längs neuronalaxeln. De neuronala nätverken som är inblandade i andningsfunktionen finns i den ventrala andningskolonnen (VRC). Från rostral till kaudal inkluderar dessa nätverk retrotrapezoidkärnan / parafacial andningsgruppskomplex (RTN / pFRG), Bötzinger-komplexet, pre-Bötzinger-komplexet (pre-BötC), den rostrala ventrala andningsgruppen (rVRG) och den kaudala VRG (cVRG). Dorsala pons, inklusive Kolliker-Fuse-kärnan och parabrakialkomplexet , spelar en viktig roll vid andningskontroll och rytmgenerering. Andra områden som hjälper till med andningskontroll är cerebellum , neocortex och periaqueductal grey (tal och andning). Generering och modulering av eupné och övergången mellan inandnings- och andningsfaserna har också varit inblandade i andningsrytmgenerering.
Viktiga kopplingar
Pre-BötC-komplexet fungerar i djur som en del av ett större nätverk som tar emot kritisk information och signalingångar från andra delar av hjärnan, inklusive pons och parafacial kärna. En isolerad del av komplexet kan fortsätta att generera andningsrytmisk aktivitet och kan registreras från den hypoglossala motoriska kärnan , som får inmatning genom en extern internuronal befolkning.
Fungera
Typer av andningsrytmer kontrollerade

Rytmisk andningsandning anpassar sig kontinuerligt till organismens hållning, aktivitetsnivå, tal och kan avslöja om någon är lugn, upprörd eller rädd. Plasticiteten hos de mekanismer som är involverade i andningsbeteendet moduleras delvis av pre-Bötzinger-komplexet. Störning orsakar irreversibel förlust eller större andningsstörning in vivo . Frekvensen och amplituden förändras i enlighet med beteendemässiga och metaboliska krav hos organismen den kontrollerar. Andningen är således extremt känslig för organismens inre tillstånd. Pre-Bötzinger-komplexet är ett rytmgenererande nätverk, som består av mikronätverk som fungerar i större nätverk för att skapa karakteristiska rytmer och andningsmönster, inklusive eupneiska, suckande och gasande aktiviteter. Detta enda neuronala nätverk kan skapa flera andningsrytmiska mönster och är i sig både nödvändigt och tillräckligt för att generera andningsrytmer.
Dess huvudsakliga funktion är att generera och samordna andningsrytmen och andningsstopp. Komplexet bidrar också till att integrera modulerande och sensoriska ingångar som matar dess större nätverk med kapacitet att anpassa sig till förändringar i organismens beteendemässiga, metaboliska och utvecklingsmässiga egenskaper. Störningar i neuromodulatoriska processer som verkar på jonkanaler , receptorer och andra budbärare har associerats med många patofysiologiska tillstånd, såsom Rett-syndrom och plötsligt spädbarnsdödssyndrom .
Både eupneiska och suckrytmer involverar aktivering av majoriteten av nervceller. Varje typ av rytmisk aktivitet är dock beroende av olika mekanismer. Fiktiv suck beror kritiskt på synaptiska mekanismer som involverar P / Q-kalciumkanaler, vilket tyder på en delmängd neuroner med specialiserade synapser för denna typ av rytmgenerering, eftersom endast ett mycket litet antal andningsneuroner får glutamatergiska ingångar som beror på P / Q typ kalciumströmmar. Den fiktiva siktrytmiska typen beror också på mGluR8-receptoraktivering. Eupneisk rytmisk aktivitet är beroende av NMDA-beroende mekanismer.
När det är lågt syresatt tillstånd (hypoxi) reagerar andningsnätet genom att övergå till en förstoring följt av en fördjupningsfas, kontrollerad i pre-BötC. Under fördjupningsfasen ändras den inspirerande skuren från en förstärkande klockformad skur till en minskande skur, ett primärt drag i gasningen. Neuronala urladdningsmönster förändras under den deprimerade synaptiska hämningen , vilket bidrar till reformeringen av nätverket. Många av andningsneuronerna i den ventrolaterala medulla inaktiveras innan phrenic och / eller hypoglossal (XII) upphör. Dessa nervceller är inkonsekventa i sitt svar med rytmiska utbrott och blir antingen de- eller hyperpolariserade . En minskning av synaptisk överföring ses också med hypoxi.
Joniska strömmar
Det finns flera inre strömmar som föreslås för att producera åtgärdspotentialer och skurar i pacemakerneuroner. Det finns två huvudspänningsberoende natriumströmmar som bidrar till depolarisering och avfyrning av åtgärdspotentialer i nervceller. Den snabba och övergående natriumströmmen producerar en stor depolarisering som avfyrar den initiala åtgärdspotentialen i neuroner, men denna ström inaktiveras snabbt och hjälper inte till att upprätthålla sprängaktivitet i neuroner. För att uppnå skurar ger en ihållande natriumström tillräckligt med depolarisering för att underlätta avfyrning av åtgärdspotentialer under en skur. Till skillnad från den snabba och övergående natriumströmmen aktiveras den ihållande natriumströmmen (I NaP ) vid mycket låga membranpotentialer och har en mycket långsammare inaktivering, vilket gör det möjligt för neuroner att inneboende avfyra aktionspotentialer vid subtröskelmembranpotentialer. Studier har visat att inaktivering av denna ihållande natriumström hjälper till att stoppa sprickor i pacemakerneuroner. Den tid det tar för I NaP att aktiveras igen fastställer tidsramen mellan varje burst. Neuronet kan ta emot synaptiska ingångar och olika mängder inåtgående och utåtgående strömmar för att reglera tiden mellan varje burst, vilket i slutändan hjälper till att generera ett specifikt andningsmönster.
NALCN-natriumläckagekanaler har antagits för att ge upphov till en inre ström som kan spela en viktig roll i moduleringen av spräng- och spikaktivitet. Dessa icke-selektiva katjonkanaler kan ge en spänningsoberoende natriumström som också hjälper till att avpolarisera neuroner något. Kanalerna regleras av G-proteinkopplade receptorer som kan aktivera eller hämma NALCN-kanalerna beroende på den neurotransmittor som binder receptorn och den specifika signalvägen som är inblandad. Aktivering av M3 muskarinreceptorer med acetylkolin och NK1 genom substans P ökar signifikant NALCN-strömmar, medan aktivering av CaSR med kalcium stoppar strömmen av strömmar. Eftersom NALCN-natriumläckage kanaler kan bidra till depolarisering av nervceller, kan deras reglering av G-proteinkopplade receptorer vara avgörande för förändring av sprickande och andningsrytmer.
Andra inre strömmar som hjälper till att generera inneboende spikning och sprängning i pacemakerneuroner är kalciumströmmen och kalciumaktiverade ospecifika strömmar (I CAN ). När en neuron blir depolariserad aktiveras spänningsstyrda kalciumkanaler och kalcium kan strömma in i cellen vilket vanligtvis leder till frisättning av neurotransmittorer. Kalciumkänsliga färgämnen har visat att interna koncentrationer av kalcium ökar under skurar. Aktivering av olika kalciumkanaler har tydliga effekter på neuronernas aktivitet i pre-Bötzinger-komplexet. L-typ kalciumkanaler är kända för att öka frekvensen av åtgärdspotentialer i vissa nervceller, vilket kan vara anledningen till att kalciuminflöde genom dessa kanaler har observerats under förstärkningen när vävnader har låga syrenivåer. P / Q-kalciumkanaler är främst ansvariga för frisättningen av neurotransmittorer som exciterar eller aktiverar postsynaptiska nervceller. Studier har visat att blockering av dessa kanaler leder till hämning av suckar, vilket indikerar att kalciumflöde genom dessa kanaler är nödvändigt för suckar. Annan forskning har också föreslagit att kalciumflöde genom kalciumkanaler av N-typ är viktigt för normal andning och ansvarar för aktivering av kalciumberoende kaliumkanaler. Kalciumaktiverade icke-selektiva katjonströmmar är viktiga för den inneboende spikningen och sprängningsaktiviteten i CS-pacemakerneuroner. Metabotropa glutamat 1/5 receptorer verkar vara viktiga för ökningen av intracellulärt kalcium som aktiverar I CAN . Den initiala sprängningen i en neuron leder vanligtvis till aktivering av den övergående natriumströmmen och de olika typerna av kalciumströmmar. Dessa strömmar depolariserar cellen tillräckligt för att aktivera NMDA-receptorer och jag KAN , vilket hjälper celler att regenerera sina skurar.
Förhållandet mellan inre och yttre strömmar hjälper till att bestämma aktiviteten hos pacemakerneuroner i pre-Bötzinger-komplexet. De viktigaste yttre strömmarna som är involverade i regleringen av neuronaktivitet är kaliumströmmar. Även om kaliumströmmarnas exakta roll fortfarande undersöks verkar det som om kalium- och natriumläckströmmar är avgörande för rytmiciteten hos pre-Bötzinger-komplexet. Övergående A-typ kaliumströmmar är vanligare i nervceller som är involverade i inspirationsprocessen. När A-typ kaliumströmmar blockerades med 4-AP i skivor av pre-Bötzinger-komplexet påverkades synkroniserade skurar i inspirerande neuroner samt kommunikation med hypoglossala motorpooler som hjälper till att reglera andningen. Detta tyder på att transienta A-typ kaliumströmmar behövs för de synkroniserade skurarna i inspiratoriska nervceller och för effektiv andningskontroll. Andra kaliumkanaler som kaliumberoende kaliumkanaler med hög konduktans och natriumkloridberoende kaliumkanaler verkar sluta sprängpotentialer i nervceller. Dessutom hjälper ATP-beroende kaliumkanaler neuroner att upptäcka förändringar i energi- eller syrenivåer för att ändra andningsmönster. Dessa kanaler aktiveras av minskningar i ATP, vilket antyder att de ger den nödvändiga hyperpolarisationen under hypoxi .
Typer av nervceller
Det finns två typer av neuroner i pre-BötC: nonpacemaker- och pacemakerneuroner. Icke-pacemaker-nervceller går in i antingen ett tonic eller ett vilande avfyrande tillstånd, medan pacemaker-neuronerna har en spontan sprängningspotential. Pacemakerneuroner kan vidare delas in i kadmiumkänsliga (CS) och kadmiumkänsliga (CI) pacemakerneuroner. Sprängning i CS-neuroner förmedlas av I CAN , en icke-specifik katjonström, medan CI är beroende av den ihållande natriumströmmen, (I NAP ). Att hämma dessa strömmar i pacemakerundertyperna upphör med deras förmåga att spontant spricka i synaptisk isolering. Även om de är en stor bidragsgivare till inre ström, är dessa två strömmar inte de enda som förmedlar pacemakare. De bidrar också till icke-pacemaker neuronala egenskaper.
De sprängande egenskaperna hos pacemaker- och nonpacemaker-neuronet går på ett spektrum och har olika grader av sprängpotentialer. Neuromodulatorer , såsom NE , SP eller 5-HT för att nämna några, kan inducera sprängning av icke-pacemaker. Även om bidrag från nonpacemaker- och pacemakerneuroner är en gradient, skiljer de sig i deras bidrag när de byter från eupneisk till gasande aktivitet. Eupneisk aktivitet kräver aktivering av I CAN- och I NaP-beroende sprängmekanismer, pacemaker-nervceller som på I CAN- strömmar selektivt hyperpolariseras under tillstånd med låga syresätt, vilket innebär att systemet beror mer på I NaP- strömmar under gasningen. Genereringen av suckar är mer känslig för I NaP- förändringar, därför kan den förlita sig något på pacemakerns neuronbidrag. Dessutom är det komplexa andningsnätet beroende av olika bidrag från olika typer av sprängmekanismer.
Neuromodulation
Den komplexa regleringen av andningsrytmen involverar integrering av multipla signalmolekyler och aktivering av många olika metabotropa och jonotropa receptorer . Dessa inkluderar noradrenalin, serotonin, acetylkolin , substans P, ATP , TRH , somatostatin , dopamin , endorfiner och adenosin , som i sin tur aktiverar g-proteinkopplade receptorer för att producera de olika responserna som förmedlas av pre-Bötzinger-komplexet.
Nonpacemaker- och pacemakerneuroner som är involverade i inspiration stimuleras av NE. De finns i pre-BötC och verkar via alfa-1 , alfa-2 och beta-noradrenerga mekanismer. NE inducerar I CAN- beroende sprängning i aktiva icke-pacemakare och depolariserar CI-pacemakers, vilket ökar frekvensen för deras sprickbildning. I CS-pacemakers ökar NE endast amplituden för den depolariserande drivpotentialen och antalet åtgärdspotentialer under burst, men påverkar inte burst-frekvensen i CS-pacemakers, till skillnad från i CI-pacemakers.
Serotonerga nervceller är också involverade i andningssystem. Deras handlingar är olika och beror på djurets aktivitetsnivå och art. Serotonin spelar en kritisk roll för att förändra pacemakerneuronerna som är involverade i gasning och normal andningsaktivitet. Blockering av 5-HT2-receptorn eliminerar de skurar som uppträder i pacemakerneuronerna och leder till att gasningar avskaffas. Blockeringen av denna receptor är därför problematisk, särskilt vid SIDS, eftersom gasning är en viktig mekanism involverad i autoresuscitation. Brist på serotoninbindning till serotoninreceptorn 2 leder till oförmåga att autoresuscitera på grund av bristande drivkraft.
Substans P , en peptiderg modulator, spelar också en roll i neuromodulering av pre-BötC. Det släpps ofta ut med andra neurotransmittorer. Substance P aktiverar inspirationsfrekvensen på nätverks- och beteendessystemen. Cellulärt är substans P involverad i depolarisering av icke-pacemakerneuroner långsamt, vilket orsakar en ökning av åtgärdspotentialen. Den neuropeptid kan också aktivera CS pacemakers och mindre dramatiskt, CI pacemakers. Detta leder till en ökning av burst-amplitud, frekvens och varaktighet. När substans P frigörs med serotonin spelar det en avgörande roll i hypoxiskt svar. Detta inträffar eftersom substans P stabiliserar andningsrytmen genom depolarisering av neuroner och aktivering av Pacemaker-neuroner.
Acetylkolin spelar en viktig modulerande roll i andningsorganen genom att ändra nikotin- och muskarinreceptorer. Suppression av muskarinreceptorer och aktivering av nikotinreceptorer på grund av prenatal exponering för nikotin har kopplats till SIDS. Detta beror på minskningen av excitatorisk synaptisk transmission i en kärna och ökad excitabilitet i motorneuroner orsakade av nikotinaktivering.
Många andra neuromodulatorer har roller i andningen. Ovan nämnda är helt enkelt tre exempel.
Homeostatiska förändringar
Undersökning av andningssvaret mot akut intermittent hypoxi (AIH), upprepade episoder av hypoxi , avslöjar koppling till olika andningssjukdomar, såsom Rett syndrom och obstruktiv sömnapné . AIH leder till ihållande ökningar av andningsfrekvensen och amplituden av integrerade motorneuronala skurar in vivo. Dessa förändringar som varar i 90 minuter eller längre benämns långvarig förenkling (LTF). AIH orsakar homeostatiska förändringar på flera platser i andningsorganen; pre-BötC är troligen platsen för LTF, eftersom intermittent hypoxi orsakar en ökning av ihållande frekvens efter pågående hypoxi. Andningsorganen regleras av flera former av långvarig synaptisk plasticitet. Rollen av synaptisk hämning har visat sig utbredd och kritisk inom det respiratoriska Botzinger-komplexets andningsnätverk genom korskorrelation och antidromisk kartläggningsteknik. De upptäckta hämmande anslutningarna indikerar deras förmåga att ansluta olika klasser av neuroner, deras betydelse för att reglera intervallet av inspiration och deras förmåga att kontrollera drivande potential hos andningsneuroner. Dessa egenskaper visar interaktionen mellan den parafaciala andningsgruppen och pre-Bötzinger-komplexet, vilket möjliggör att aktiv utandning produceras genom synaptisk hämning i andningsnätet. Synaptisk hämning är avgörande för att tillåta pre-Bötzinger-komplexet att kommunicera med andra andningscentra för att generera andningsaktivitet.
Glycinerga och GABAergiska hämmande nervceller utgör hälften av alla inspirerande neuroner. Exponering av pre-Bötzinger-komplexet för dessa hämmande neurotransmittorer resulterar i den rytmiska naturen som är associerad med andningen. Att blockera denna hämning från glycin eller GABA gör att dess nervceller inte är i stånd att byta från den aktiva fasen till inspirationsfasen, vilket visas av kortare inspiratorisk aktivitet (sett in vivo ). Frånvaron av hämmande synapser resulterade emellertid fortfarande i rytmisk andningsaktivitet in vitro och in situ . Detta beror till stor del på det faktum att andningsrytmen beror på många aspekter, med synaptisk hämning som bara spelar en enda roll.
Förutom den hämmande synaptiska regleringen av andningsrytmen i pre-Bötzinger-komplexet finns det också en excitatorisk komponent som använder mestadels AMPA-receptorer . Generationen av inspiration beror på en signalkaskad som involverar övergående Ca2 + -inflöde som ett resultat av att glutamat aktiverar en postsynaptisk receptor. Förutom glutamates roll för att aktivera den synaptiska drivkraften till inspiration, är det också underförstått att pacemakerneuroner, med autonoma spänningsberoende egenskaper, också är ansvariga för genereringen av andningsrytmen. Bevis på detta ses när man isolerar nervceller i pre-Bötzinger-komplexet, vilket resulterar i rytmiska skurar på grund av synaptiskt kopplade mikronätverk.
Genereringen av andningsrytmen kräver dock andra exciterande komponenter, såsom glutamat, för att producera ett brett spektrum av beteendefunktioner inklusive eupneisk och suckaktivitet. Pre-Bötzinger-komplexet ansvarar för att generera ett brett utbud av komponenter som utgör andningsrytmen. Uppnåendet av dessa exakta aktiviteter kräver distinkta neuronpopulationer som överlappar varandra för att möjliggöra generering av olika andningsåtgärder. Eupneisk aktivitet genereras med hjälp av den excitatoriska mekanismen genom NMDA-glutamatreceptorn. Suckar har en differentiell generation som härrör från pacemakerneuroner. Pre-Bötzinger-komplexet kan generera differentiella rytmiska aktiviteter på grund av den invecklade integrationen av modulerande, synaptiska och inneboende egenskaper hos de involverade neuronerna.
Syreavkänning
Förutom sitt engagemang i att generera andningsrytmen kan pre-Bötzinger-komplexet också integrera sensorisk information från förändringar i den biokemiska miljön, särskilt syre. Förmågan att detektera fokal hypoxi orsakar ett excitatoriskt svar i motorutgången som är ansvarig för andningen, vilket orsakar förändringar i neurons avfyringsmönster i pre-Bötzinger-komplexet. Bland dessa förändringar är övergången till ett helt integrerat nätverk som involverar komplexa nätverk och autonoma mekanismer, till ett system som är beroende av aktiviteten hos pacemakerneuroner genom aktivering av natriumström. Hypoxi resulterar i gasning på grund av det ökade beroendet av natriumströmmen och överlappningen i nätverk mellan generering av andningsrytm och inneboende syresensibilisering.