Feokromocytom - Pheochromocytoma
| Feokromocytom | |
|---|---|
| Andra namn | Feokromocytom, adrenal medullär tumör, kromaffintel tumörer, paragangliom |
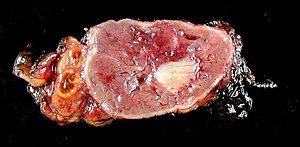 | |
| Normal rest av binjurarna (vänster) med feokromocytom (till höger) som involverar binjuret | |
| Uttal | |
| Specialitet | Endokrinologi , onkologi |
| Symtom | Hypertoni , takykardi , svettningar, huvudvärk , blekhet |
| Komplikationer | Hypertensiv kris |
| Diagnostisk metod | Förhöjda plasmafria metanephrines , plasmakatekolaminer , eller urinkatekolaminer |
| Behandling | Kirurgi, kemoterapi, strålning och farmakologiska medel |
| Frekvens | 0,8 per 100 000 personår |
Feokromocytom ( PHEO eller PCC ) är en sällsynt tumör i binjuremuskeln som består av kromaffinceller , även kända som feokromocyter. När en tumör som består av samma celler som ett feokromocytom utvecklas utanför binjurarna kallas det ett paragangliom . Dessa neuroendokrina tumörer kan producera och frigöra massiva mängder katekolaminer , metanefrin eller metoxytyramin, vilket resulterar i de vanligaste symptomen, inklusive högt blodtryck (högt blodtryck), takykardi (snabb puls) och diafores (svettning). Emellertid kommer inte alla dessa tumörer att utsöndra katekolaminer. De som inte kallas biokemiskt tysta och är övervägande belägna i huvud och nacke . Även om patienter med biokemiskt tyst sjukdom inte kommer att drabbas av de typiska sjukdomsmanifestationer som beskrivs ovan, växer tumörerna och komprimerar de omgivande strukturerna i huvud och nacke, och kan resultera i pulserande tinnitus (ringning i örat), hörselnedsättning, hörselnedsättning, dyspné (andningssvårigheter) och heshet. Medan tumörer i huvud och nacke är parasympatiska, är deras sympatiska motsvarigheter övervägande belägna i buken och bäckenet, särskilt koncentrerade till Zuckerkandls organ .
tecken och symtom
De tecken och symtom på en feokromocytom är de som rör sympatiska nervsystemet hyperaktivitet . Den klassiska triaden inkluderar huvudvärk (troligtvis relaterat till förhöjt blodtryck eller högt blodtryck ), takykardi /förhöjd hjärtfrekvens och diafores (överdriven svettning, särskilt på natten, även känd som hyperhidros ). Det är dock osannolikt att patienter upplever kontinuerliga symptom. På grund av den paroxysmala karaktären av katekolaminsyntes och -frisättning kan patienter uppleva "attacker" eller "trollformler" där de plötsligt överväldigas av tecken och symptom på sin tumör. Angrepp kan ske spontant (utan förvarning) eller kan utlösas av en mängd olika läkemedel, livsmedel, intraoperativ tumörmanipulation, intubation eller under anestesiinduktion.

| Livsstil | Mediciner | Diet |
|---|---|---|
| Fysisk ansträngning | Histamin | Ost |
| Ångest/stress | Metoklopramid | Jäst vin/öl |
| Trauma/smärta | Glukagon | Tomater |
| Miktion | ACTH | Kaffebönor |
Även om ovanstående symptom är klassiska har andra vanliga kliniska manifestationer rapporterats och inkluderar (i ingen särskild ordning)
- Blekhet
- Värmeintolerans
- Viktminskning
- Bröst och/eller magbesvär
- Illamående / kräkningar
- Förstoppning
-
Ortostatisk hypotension
- Medicinskt definierad som en minskning av systoliskt blodtryck (högsta antal) med 20 mm Hg eller diastoliskt blodtryck (nedre antal) med 10 mm Hg efter en förändring i position från att ligga eller sitta till en stående position
- Känsla av att bli lätt eller yr efter att snabbt ha bytt position
- Psykiatriska manifestationer
- Ångest , panikattacker , nervositet, fruktansvärdhet
- Hyperglykemi (högt blodsocker)
Komplikationer
Medan symptomen på ett feokromocytom är ganska vanliga, har sjukdomen kallats "den stora efterliknaren". Litteraturen rapporterar att bara 0,1% av patienterna med högt blodtryck diagnostiseras med denna sällsynta endokrina sjukdom och symtomatiska patienter misstas ofta med mycket vanligare sjukdomar. Eftersom symtomen ofta är paroxysmala (episodiska/sporadiska) kan patienter inte omedelbart söka behandling eftersom problemet "försvinner av sig självt". Dessutom, när bilden i det ideala kliniska scenariot (en äldre kvinna i mitten av 50-talet), kan de spontana attacker av rodnad, svettningar och en racing hjärta misstas för pre-menopausala relaterade hot-blinkar . Ohanterat feokromocytom är farligt och kan leda till allvarliga komplikationer, inklusive dödsfall. Det kardiovaskulära systemet är det vanligaste.
Kardiovaskulära systemet
- Hypertensiv kris : Feokromocytomrelaterade hypertensiva nödsituationer är en av de mest fruktade kliniska manifestationerna. Attacker är slumpmässiga och kan förekomma sekundärt till en utlösare (se tecken och symtom ovan) eller spontant efter en katekolaminstigning. Det rådande symptomet är förhöjt systoliskt blodtryck (> 200 mmHg) som inte reagerar på traditionella behandlingsregimer och hotar organskador . Patienter kräver omedelbar, livräddande behandling för att förhindra ytterligare skada på andra organ och/eller död.
- Myokardisk iskemi /infarkt: En hjärtinfarkt orsakas ofta av en betydande ansamling av plack ( ateroskleros ) i kranskärlen . Patienter med feokromocytom har hjärtinfarkt trots en total brist på plackuppbyggnad, vilket indikerar en annan mekanism för hjärtinfarktet. Nuvarande forskning hypoteser att tumören utsöndrar massiva mängder katekolaminer, som direkt interagerar med myokardvävnad (hjärta) och påverkar negativa effekter, inklusive syrebrist, vilket leder till accelererad ärrbildning och celldöd.
- Giftig myokardit : Även hos patienter utan hjärtinfarkt kan överdriven katekolaminer resultera i onormala ST -förändringar på ett EKG . Norepinefrin (en katekolamin) antas resultera i skadad hjärtvävnad genom att hämma koronar blodflöde och beröva cellerna syre, vilket resulterar i ischemisk vävnad. Lyckligtvis, efter tumörutskärning och efterföljande kvävning av katekolaminer, har skadan visat sig vara reversibel.
- Kardiomyopati : Feokromocytom har varit inblandade i olika typer av kardiomyopati, inklusive (myokardit, se ovan), vidgad kardiomyopati och stressinducerad eller Takotsubo kardiomyopati . Som med de andra kardiovaskulära relaterade komplikationerna är överskott av katekolaminer ansvariga för den ökade hjärtinfarktbördan och den betydande fysiologiska stressen. Nuvarande litteratur indikerar att det mesta av den katekolamininducerade skadan är reversibel och därigenom stärker argumentet för tidig och korrekt diagnos för att möjliggöra hjärtombyggnad och förhindra ytterligare förstörelse.
- Arytmier : Sinustakykardi är den vanligaste onormala hjärtrytmen i samband med feokromocytom och upplevs av patienterna som känslan av ett "fladdrande hjärta" eller hjärtklappning . Många andra takyarytmier (snabb puls) har också rapporterats.
Nervsystem
- Cerebrovaskulär olycka (stroke): Flera rapporter har detaljerade övergående ischemiska attacker eller stroke hos patienter med feokromocytom. I en studie med 130 patienter med feokromocytom diagnostiserades 7 patienter med en övergående ischemisk attack (det neurologiska underskottet försvann helt) och 3 patienter fick en stroke med ihållande symtom.
- Huvudvärk : Huvudvärk är en av de huvudsakliga kliniska manifestationerna av ett feokromocytom och kan resultera i försvagande smärta. Majoriteten av de studerade patienterna rapporterar att deras smärta började och slutade abrupt utan förvarning och beskrev smärtan som en allvarlig, bilateral dunkande (även om svårighetsgraden inte publicerades). Medan 71% av de studerade patienterna rapporterade huvudvärk, godkände drygt 20% av de drabbade patienterna associerade illamående , kräkningar, fotofobi eller fonofobi , som vanligtvis är associerade med migrän .
Urinvägarna
- Akut njursvikt : Flera rapporter har detaljerad rabdomyolys (snabb nedbrytning av skelettmuskler) som leder till akut njurskada och behovet av övergående dialys hos den odiagnostiserade feokromocytompatienten som deras primära symptom. Njursvikt orsakas av katekolamininducerad muskelskada. Noradrenalin får kärlen att smala, vilket begränsar blodflödet och inducerar ischemi.
Multipel organs dysfunktionssyndrom (MODS) : Orsakas av ett förhöjt inflammatoriskt svar, multipel organdysfunktion är en allvarlig, livshotande nödsituation med ökande dödlighet baserat på antalet inblandade system. Feokromocytom-relaterade MODS är associerat med multipel organsvikt, hypertermi > 40 grader Celsius, neurologiska manifestationer och kardiovaskulär instabilitet som resulterar i antingen hypo eller hypertoni. Till skillnad från en hypertensiv kris kanske feokromocytomassocierade MODS inte svarar på traditionella alfa-receptormedel och kan kräva framväxande kirurgisk excision om klinisk stabilitet inte uppnås.
Genetik
Nuvarande uppskattningar förutspår att uppemot 40% av alla feokromocytom är relaterade till en ärftlig mutation i könsceller . Av de återstående 60% av tumörerna är mer än 30% associerade med en somatisk mutation . Med tanke på den höga föreningen med genetiskt arv rekommenderar United States Endocrine Society att alla patienter som diagnostiserats med feokromocytom genomgår en utvärdering hos en genetisk rådgivare för att överväga genetisk testning . De senaste uppgifterna indikerar att det finns 25 feokromocytom -mottaglighetsgener; dock är bara 12 erkända som en del av ett välkänt syndrom. Att bestämma den genetiska statusen för en feokromocytompatient är avgörande - varje gen ärvs i ett annat mönster, associerat med specifika sjukdomskarakteristika, och kan svara mer positivt på vissa behandlingsalternativ. Vidare kan tidig identifiering vägleda läkare om screeningrekommendationer för första gradens släktingar till patienter med feokromocytom. Det finns ingen aktuell konsensus för hur och när asymptomatiska bärare (individ som har en genetisk variant associerad med feokromocytom, men inga aktuella tecken på sjukdom) ska utvärderas. Konversationer bör ske på individuell nivå med patienten och deras leverantör för att utveckla en personlig screeningsplan som växlar mellan en biokemisk (blodarbete) utvärdering och helkroppsbildning för att övervaka sjukdomsprogression.
Pediatriska överväganden
Ytterligare metoder kan hjälpa till att upprätthålla den minderåriges emotionella och psykologiska välbefinnande. Screening inkluderar ett tvärvetenskapligt team ( endokrinolog , onkolog , psykolog , genetiker , förälder och barn) där det primära fokuset är att stödja barnet.
- Ett positivt resultat från testning under familjen observerade högtider kan dölja lyckan i samband med dessa händelser i framtiden.
- Genom att testa ett barns syskon åt gången kan familjen begränsa fokus när resultaten återkommer och stödja varje syskon individuellt.
- Ett negativt resultat kan vara upprörande för ett barn om deras syskon var positiva. ett tillfälle att ställa frågor och bearbeta resultat kan vara till hjälp.
Ärftliga syndrom
Följande tabell (er) beskriver de kliniska egenskaperna hos de välkända ärftliga feokromocytomgenvarianterna
| Gen | Arv | Penetrance | Metastatisk potential | 1 o Sjukdomsegenskaper | |
|---|---|---|---|---|---|
| MEN2 | RÖTA | Autosomal dominerande | 40–50% | <5% | Medullärt sköldkörtelcancer , hyperparatyreoidism , marfanoid habitus, feokromocytom |
| VHL | VHL | 10-30% | 5% | Njurcellscancer , bukspottskörtelnät , retinal och CNS hemangioblastom , feokromocytom | |
| NF1 | NF1 | 1–5% | 12% | Neurofibrom , cafe-au-lait macules , lisch nodules , kognitiv försämring, feokromocytom |
MEN2 (Multiple Endocrine Neoplasia-2); VHL (von-Hippel Lindau); NF1 (Neurofibromatosis-1); NET (neuroendokrin tumör); Centrala nervsystemet ( CNS )
| Gen | Arv | Penetrance | Metastatisk potential | 1 o Sjukdomsegenskaper | |
|---|---|---|---|---|---|
| PGL1 | SDHD | Autosomal dominerande | 90% | <5% | Paragangliom i huvud och nacke, feokromocytom, gastrointestinal stromaltumör |
| PGL2 | SDHAF2 | 100% | Låg | Huvud och hals paragangliom | |
| PGL3 | SDHC | Autosomal dominerande | Inkonsekvent | Inkonsekvent | Feokromocytom, huvud och hals paragangliom, gastrointestinal stromaltumör |
| PGL4 | SDHB | 30–50% | 30–70% | Paragangliom i huvud och nacke, feokromocytom, gastrointestinal stromaltumör | |
| PGL5 | SDHA | 10–15% | Låg | Feokromocytom, huvud och hals paragangliom, gastrointestinal stromaltumör |
SDHx (succinatdehydrogenasunderenhet x)
| Arv | Penetrance | Metastatisk potential | 1 o Sjukdomsegenskaper | |
|---|---|---|---|---|
| MAX | Autosomal dominerande | Inkonsekvent | <5% | Bilateralt feokromocytom |
| TMEM127 | Inkonsekvent | Låg | Feokromocytom, huvud och hals paragangliom |
MAX (MYC Associated Factor X); TMEM127 (Transmembrane Protein 127)
Andra genvarianter
Det har förekommit flera publicerade fallrapporter om andra, sällsynta feokromocytomassocierade mottaglighetsgener:
-
Pacak-Zhuang syndrom
- Hypoxia-inducerbar faktor 2 alfa ( HIF2A )
- Polycytemi
- Duodenal somatostatinom
- Retinala och koroidala kärlförändringar
- Paragangliom/feokromocytom
- Feokromocytom och Giant Cell Tumor of Bone
- H3 histon, familj 3A ( H3F3A ), post-zygotisk G34W
- Feokromocytom/Paragangliom
-
Carney Triad
- Gastrointestinal stromaltumör
- Lungkondrom
- Paragangliom
- Carney-Stratakis syndrom
- Gastrointestinal stromaltumör
- Paragangliom
Flera ytterligare genvarianter har beskrivits, men den tillhandahållna informationen är inkonsekvent och konsensus har inte nåtts i samhället om dessa mutationer verkligen är feokromocytom -känslighetsgener.
Diagnos
Differentiell
Om en patient har de karakteristiska tecknen och symtomen på ett feokromocytom och beslutet fattas att utföra ytterligare biokemisk (blodarbete) utvärdering, är differentialdiagnosen viktig eftersom det är mer troligt att det är något annat än ett feokromocytom med tanke på den relativa frekvensen på 0,8 per 100 000 personår.
| Endokrin | Kardiovaskulär | Neurologiskt | Psykiatrisk | Övrig |
|---|---|---|---|---|
| Hypertyreos | Hjärtsvikt | Migrän | Ångest | Porfyri |
| Carcinoids syndrom | Arytmier | Stroke | Panikångest | Mediciner |
| Hypoglykemi | Ischemisk hjärtsjukdom | Epilepsi | Ämnesanvändning | |
| Menopausalt syndrom | Baroreflex misslyckande | Meningiom | Faktiös störning | |
| Medullär sköldkörtelcancer | - | Krukor | - |
Anteckningar
Biokemisk utvärdering
Guldstandard
Förhöjda plasmafria metanefrin anses vara guldstandarddiagnosen för feokromocytom. Över 10 studier har bekräftat att känsligheten och specificiteten för detta test är 97% respektive 93%; Det finns dock fortfarande oro för falskt positiva resultat i det korrekta kliniska scenariot. När en biokemisk analys av feokromocytom tolkas måste leverantören vara mycket uppmärksam på (1) villkoren för insamlingen, (2) alla mediciner som patienten tar och (3) deras kost.
- Insamlingsvillkor: Till skillnad från många rutinmässiga laboratorietester som kan göras med ett ögonblick, finns det flera rekommendationer som bör följas för att säkerställa de perfekta förhållandena och ett exakt prov. Aktuell forskning tyder på att blodarbete endast bör dras efter att en patient har vilat liggande (platt på ryggen) i 30 minuter före insamling. Specifika liggande referensvärden bör användas i detta scenario. Att se till att dessa villkor är svåra och kan vara kostnadsöverskridande på de flesta institutioner. I dessa fall kan en vilad, liggande dragning upprepas efter ett positivt resultat i en sittande position för att eliminera falskt positiva resultat.
- Farmaceutisk interferens: Många receptbelagda, receptfria och olagliga ämnen kan störa korrekt insamling av plasmametanefiner och leda till falskt positiva resultat. Leverantörer bör granska en patients medicinlista i detalj och föra en diskussion om det är möjligt att tillfälligt avbryta någon av de störande medicinerna. De mest rapporterade medicinerna som leder till falskt förhöjda metanefrin inkluderar: β-adrenoceptorblockerare , fenoxibensamin , tricykliska antidepressiva medel , monoaminoxidashämmare , serotonin noradrenalinåterupptagshämmare ( SNRI ) och metyldopa . Eftersom majoriteten av dessa läkemedel vanligtvis ordineras för psykiatriska tillstånd, kan ett samtal med förskrivaren vara nödvändigt för att underlätta alternativa terapeutiska alternativ medan patienten genomgår utvärdering av ett feokromocytom. Efter att eventuella receptbelagda läkemedel har hållits är det viktigt att granska eventuella receptfria läkemedel/kosttillskott samt att vanliga acetaminofen och pseudoefedrin orsakar falska förhöjningar i metanefrinhalten. Slutligen är det viktigt att ha öppna, icke-dömande diskussioner om patientens rekreationsmissbruk. Amfetamin , nikotin och kokain kan resultera i markanta plasmanivåer av noradrenalin.
- Livsstil och kost: Som med de flesta laboratoriearbeten ska patienten avstå från att äta (fasta) efter midnatt natten innan de samlas in. Det finns dock ytterligare rekommendationer specifika för en metanefrininsamling, inklusive att avstå från nikotin, alkohol och träning i minst 12 timmar före deras lottdragning. Patientens bör också undvika mat som innehåller katekolamin (frukt, fruktdrycker, choklad, koffein, tomater, bönor, nötter och potatis) i minst 24 timmar före insamling.
Även om ovanstående (3) förhållanden sannolikt kommer att bidra till falskt positiva resultat om de inte kontrolleras, bör ett värde som är större än 3 till 4 gånger den övre referensgränsen för det normala anses vara diagnostiskt för ett feokromocytom.
Alternativa tester
Tjugofyra timmars urinmetanefrin är ett acceptabelt alternativ om plasmatestet inte är tillgängligt. Andra ytterligare biomarkörer kan vara till hjälp för att underlätta diagnos av feokromocytom också, är mest anmärkningsvärda Kromogranin A . I jämförelse med specificiteten hos förhöjda katekolaminer hos feokromocytompatienten är kromogranin A en ospecifik polypeptid som är hög i en mängd olika neuroendokrina tumörer. En rapport från Italien från 2006 visade dock att över 90% av de studerade feokromocytompatienterna visade förhöjda nivåer av kromogranin A. Om metanefrinvärden är otvetydiga kan kromogranin A användas som en tilläggsmarkör för att förutsäga närvaron av en tumör.
Borderline förhöjda metanefiner utgör en diagnostisk utmaning för läkaren - det första steget är att upprepa laboratorierna och vidta extra försiktighetsåtgärder för att följa den guldstandarddiagnos som beskrivs ovan, inklusive insamlingsvillkor, läkemedelsstörningar och eventuella kost- och livsstilsvanor som kan ändra resultaten. Om de kränkande medicinerna inte kan avbrytas eller upprepade laboratorier förblir desamma, överväg att administrera ett klonidinsuppressionstest . På 1970 -talet svepte läkemedlet klonidinhydroklorid marknaden som ett nytt medel för högt blodtryck ; de rapporterade biverkningarna ( illamående , kräkningar , dåsighet , torrhet i ögon och mun, förstoppning och generaliserad svaghet) begränsar följsamheten och har kraftigt minskade recept. Medan de negativa biverkningarna med klonidin är obekväma, är den farligaste aspekten av klonidin abstinenshypertension - det vill säga när medicinen plötsligt avbryts kan blodtrycket snabbt återvända eller överstiga det ursprungliga värdet. En engångs, viktbaserad dos kan dock användas i begränsade inställningar för att avgöra sjukdomsstatus. Efter att ha fastat över natten kommer patienten att presentera sig på sin testplats för metanefriners blodprov och administrering av klonidin vid baslinjen. De kommer att ligga liggande i (3) timmar och en upprepad blodprov tas. Ett positivt resultat (indikerar ett feokromocytom) kommer att inträffa om plasmanivåerna av metanefrin förblir förhöjda efter att klonidin ges. Om resultaten är desamma eller faller, är testet negativt och patienten har inte ett feokromocytom. Det är viktigt att notera att om en patient inte har ett feokromocytom kan de bli extremt hypotensiva efter klonidin. Patientens bör inte vara beroende av sig själv för transport efter detta test.
Plasmametoxytyramin är en nedbrytningsprodukt av katekolaminen, dopamin . Paragangliom i huvud och nacke utsöndrar vanligen dopamin, men kallas "biokemiskt tysta" eftersom de inte orsakar de karakteristiska symptomen som är associerade med ett feokromocytom. Metoxytyramin kan dock användas för att detektera tumörer i huvud och nacke. Ytterligare forskning tyder på att biomarkören också är en användbar indikator på metastatisk sjukdom - vilket är det enda aktuella biokemiska beviset på metastaser hittills.
Biokemiska fenotyper
Även diagnostik kan laboratorievärden också läkarens med viktig information om typ, plats, storlek och tillhörande tumör genotyp . Det finns (3) stora, välkända biokemiska fenotyper som kan användas av vårdgivare för att styra patientvård.
-
Adrenerg ( epinefrin och metanefrin )
- Mer sannolikt att indikera en adrenal tumör
- När plasmanivåerna av metanefrin höjdes till mer än 15% av de kombinerade nivåerna av normetanefrin och metanefrin, kan en adrenal tumör eller ett återkommande av en binjurstumör som redan hade utsatts förutspås
- Patienter är mer benägna att uppleva de klassiska, paroxysmala (episodiska) symptomen som beskrivs ovan
-
Noradrengeric ( noradrenalin och normetanefrin )
- Mer sannolikt att indikera en extra adrenal tumör
- Patienter är mer benägna att uppvisa kontinuerliga, ihållande feokromocytomrelaterade symtom ( hypertoni och takykardi ) jämfört med de som klassiskt uppträder med en adrenerg fenotyp
- Vanligt hos patienter med von-Hippel Lindau och succinat dehydrogenas subenhet X genetiska varianter
-
Dopaminerg ( dopamin och 3-metoxytyramin)
- Mer sannolikt att indikera en extra adrenal tumör i huvud och nacke
- Patienter är mer benägna att vara asymptomatiska; de kan dock uppvisa icke-specifika tecken på illamående , kräkningar , buksmärtor, diarré och viktminskning sekundärt till stimulering av dopaminreceptorer i hela mag-tarmkanalen
- Särskilt vanligt förekommande hos patienter med succinat dehydrogenas subenhet B genetiska varianter
Över både en adrenerg och en noradrenerg fenotyp, ju större summa av plasma- eller urinkoncentrationer av metanefrin och normetanefrin, desto större är den förväntade tumördiametern.
Tumörlokalisering
Anatomisk avbildning
Anatomisk avbildning avser datortomografi (CT) [CAT -skanning] eller magnetisk resonansavbildning (MR). Dessa avbildningsmetoder tjänar till att initialt lokalisera tumören och tillhandahålla detaljerad information om storlek, morfologi och strukturell relation till intilliggande inre strukturer. Traditionellt presenterar en patient för sin läkare symptom på ett feokromocytom, vilket kräver en biokemisk utvärdering. Om resultaten är positiva hänvisas patienten för anatomisk avbildning med en CT- eller MR -skanning. Men eftersom anatomisk avbildning blir lättare tillgänglig hänvisas patienter till en endokrinolog efter att en tillfällig (oväntad upptäckt) adrenal knöl har hittats vid en skanning beställd av annan anledning. Till exempel presenterar "Patient M" för sin lokala akutmottagning för buksmärtor och en CT beordras för att utesluta blindtarmsinflammation; dock Radiologist anteckningar finns en 3,5 centimeter rätt adrenal massa.
Även om det inte har funnits enighet om CT eller MR är den föredragna avbildningsmetoden vid feokromocytom, har varje metod sina associerade styrkor och svagheter. Eftersom CT utsätter patienten för joniserande strålning föredras MR hos barn och gravida kvinnor. Dessutom kan den intravenösa kontrasten som används vid CT orsaka njurskada och bör därför undvikas hos patienter med redan befintlig skada. Dock kan patienter som kämpar med att vistas i trånga utrymmen under längre perioder ( klaustrofobi ) inte ofta tolerera en MR eftersom maskinen är nära än jämfört med den öppna designen av en CT. När patienter blir oroliga och börjar röra sig i maskinen orsakar detta rörelseartefakt, vilket förekommer mindre i CT-baserade bilder.
Jämfört med CT och MR är ultraljud inte en föredragen bildmodalitet och bör undvikas hos feokromocytompatienten. Men i specifika patientgrupper där undvikande av joniserande strålning är högsta prioritet (barn, gravida kvinnor) kan ultraljud användas som tilläggsmetod när MR kan vara otillgänglig eller patienten inte kan slutföra skanningen. Vidare, om en misstänkt akut binjureblödning misstänks hos en feokromocytompatient, är ultraljud en snabb, smärtfri, strålningslös och billig metod för ett "första pass" innan ovanstående avbildningsmetoder eller kirurgi används för att bekräfta diagnosen.
Funktionell avbildning
De avbildningsmetoder som diskuteras nedan är för tumörkarakterisering, bekräftelse av metastatisk sjukdom och behandlingsplanering - de används inte för att urskilja tumörplats eller hjälpa det kirurgiska teamet att förbereda sig för excision. För de flesta feokromocytompatienter kommer funktionell avbildning att följa en CT eller MR. Om anatomisk avbildning endast visar en binjurstumör utan tecken på sjukdom någon annanstans i kroppen och metanefrinhalterna är öppet förhöjda, kan funktionell avbildning avstå från förmån för snabb kirurgisk excision. Under det senaste decenniet har det funnits fem funktionella tekniker som används för att utvärdera feokromocytompatienten (1) 18F- fluorodeoxiglukospositronemissionstomografi ( 18 F-FDG PET ), vanligen kallad PET-skanning, (2) jod-123 meta- jodbensylguanadin ( 123 I-MIBG), (3) 18F-flurodihydroxifenylalanin ( 18 F- FDOPA ), (4) 68Ga-DOTA-kopplade somatostatinanaloger ( 68 Ga- DOTA ), (5) 11C-Hydroxy efedrin (HED-PET). Från och med nu kommer dessa avbildningsmetoder att hänvisas till i deras förkortade namn som finns inom parentes.

Den första funktionella avbildningstekniken som användes vid feokromocytompatienter var 123 I- MIBG- scintigrafi (höger bild). Med tanke på att föreningarna liknar strukturen som katekolamin noradrenalin (utsöndras av feokromocytom) var MIBG väl lämpad för upptag av de flesta neuroendokrina tumörer . Om en patient visade sig vara positiv på en MIBG -skanning, var de dessutom berättigade till MIBG -behandling, vilket erbjuder ytterligare vägar för dem som lider av utbredd metastatisk sjukdom. Ytterligare undersökning visade emellertid att medan MIBG utmärkte sig med binjurskador, var det mycket mindre överlägset hos patienter med extra adrenala paragangliom, särskilt med specifika genetiska varianter som succinatdehydrogenas-subenhet X ( SDHx). När positronemissionstomografiska skanningar utvecklades har MIBG långsamt förlorat sin fördel för feokromocytompatienten.

Av de fyra ovan nämnda metoderna är 18 F- FDG PET den vanligaste och lättillgängliga funktionella bildtekniken på de flesta sjukhussystem, men den minst specifika för neuroendokrina tumörer (Bild vänster). År 2012 deltog över 200 patienter i en studie som jämförde dagens guldstandard (MIBG/CT/MRI) med det nya FDG PET. Jämfört med dess funktionella motsvarighet överträffade FDG MIBG för att detektera mjukvävnads- och benmetastaser med högre specificitet hos patienter med biokemiskt aktiva tumörer.
Efter utvecklingen av FDG-PET började neuroendokrinspecifika PET-skanningar dyka upp. En av de första gynnsamma avbildningsmetoderna var 18 F- FDOPA , som visade en hög känslighet för att detektera huvud- och halsparagangliom samt icke-metastatisk sjukdom utanför huvudet och nacken. Tyvärr, i fall av metastatisk sjukdom, särskilt relaterad till succinat dehydrogenas subenhet B ( SDHB ) mutationer, föll 18 F- FDOPA sämre än det traditionella FDG-PET. För patienter med genetiska varianter i andra feokromocytom-känslighetsgener ( NF1 , VHL , RET ) har 18 F- FDOPA blivit det föredragna radiofarmaceutiska medlet.
Den nyaste PET-metoden innefattar somatostatinreceptor typ två receptoravbildning med 68 Ga- DOTA- analoger. Under det senaste decenniet fortsätter ytterligare forskning att indikera överlägsenheten hos denna funktionella avbildningsmodalitet i ett stort antal kliniska scenarier, till och med överträffa anatomisk avbildning ( CT / MR ) hos pediatriska patienter med succinatdehydrogenas ( SDHx) mutationer. Medan FDOPA inkonsekvent detekterade metastatisk sjukdom, har 68 Ga- DOTA- analoger visat överlägsen lokalisering av metastatiskt feokromocytom. Vid direkt jämförelse i en head-to-head-studie år 2019 överträffade 68 Ga- DOTA- analoger FDOPA, särskilt vid upptäckt av metastatiska benskador. En ytterligare fördel med DOTA -analogerna är förmågan för behandling med peptidreceptorradionuklidterapi, som kommer att diskuteras i behandlingsavsnittet nedan.
HED-PET har också visat sig vara ett korrekt verktyg för att diagnostisera och utesluta feokromocytom i komplexa kliniska scenarier och för att karakterisera otvetydiga binjurstumörer.
Förvaltning
Kirurgi
Kirurgisk resektion är det enda botande alternativet för feokromocytom från och med 2019. En framgångsrik excision är en tvärvetenskaplig insats som involverar endokrinologen och patienten pre-operativt (diskuteras nedan) och det kirurgiska teamet och anestesiologen intraoperativt. Utan frekvent och adekvat kommunikation mellan alla ovan nämnda lag är ett gynnsamt resultat mycket svårare. The United States Endocrine Society 2014 Clinical Practice Guideline for feochromocytoma rekommenderar en laparoskopisk adrenalektomi (minimalt invasiv teknik) för de flesta binjurstumörer, såvida de inte är invasiva eller är större än 6,0 centimeter. Det är viktigt att notera att större tumörer kan försökas med ett minimalt invasivt tillvägagångssätt, men teamet bör vara berett att omvandla till ett öppet förfarande om det behövs. Ett öppet förfarande (traditionell kirurgisk teknik) är för närvarande att föredra för extra-binjurssjukdom, såvida inte tumören är liten, icke-invasiv och på en lättmanövrerad plats. Medan tidigare data indikerade behovet av ett minimalt invasivt tillvägagångssätt med malign och/eller metastatisk sjukdom, visar aktuell forskning att en framgångsrik operation är genomförbar och resulterar i en kortare sjukhusvistelse. Litteratur under det senaste decenniet har också visat att robottekniken framgångsrikt kan användas för binjurstumörer .
Vanligtvis utförs fullständig eller total adrenalektomi; emellertid kan en teknik som kallas "kortikalsparande" lämna kvar en del av binjurarna i hopp om att undvika livslång steroidersättning om vänster och höger binjurar måste avlägsnas. Frågan är särskilt viktigt i patienter med MÄN och VHL - relaterad sjukdom, som har en större chans att bilaterala feokromocytom. Risken att lämna binjurarna är återkommande sjukdom (tumör kommer tillbaka). En kohortstudie från 2019 rapporterade att trots en 13% återkommande frekvens hos patienter som genomgick en kortikalsparande adrenalektomi för feokromocytom, fanns det ingen minskad överlevnad jämfört med deras totala adrenalektomi-motsvarigheter.
Preoperativ ledning
Förmodligen är den viktigaste delen av ett feokromocytom kirurgiskt plan en adekvat föreoperativ blockad. Överskott av katekolaminer har beskrivits som en vilande vulkan, redo att bryta ut när som helst, vilket orsakar katastrofala förödelser på kroppen. Medan ett utbrott kan inträffa när som helst, är två av de vanligaste utlösarna anestesi och direkt tumörmanipulation, vilket gör kirurgi till en av de farligaste tiderna för en feokromocytompatient om den inte är ordentligt förberedd. För att hjälpa till att kringgå en katekolaminkris rekommenderar United States Endocrine Society att alla patienter med funktionella (hormonellt aktiva) tumörer startas på en pre-operativ alfa-adrenoceptorblockad minst sju dagar före operationen. Det finns flera medicineringsalternativ beroende på det kliniska scenariot, var och en med sina egna associerade styrkor och svagheter.
Alfa blockad
Om patientens blodtryck är måttligt förhöjt är en selektiv, kortverkande alfa-1 adrenoceptorantagonist ( doxazosin , prazosin , terazosin ) det föredragna medlet. Patienten bör dock varnas för den potentiella bieffekten som kallas " första dosfenomenet ". När patienter initialt utsätts för en av ovanstående medel, kan de blir yr , yr , och illamående , speciellt vid överföring från sittande till stående läge på grund av en snabb minskning i blodtryck . Dessa effekter kommer att minska med tiden, men leverantörer kan försöka undvika dem genom att börja med en låg dos och långsamt öka tills de når önskad mängd. Hos patienter med okontrollerad hypertoni bör den icke-selektiva alfa-1 och 2 adrenoceptorantagonisten ( fenoxibensamin ) användas. Tyvärr är fenoxibensamin jämfört med de selektiva medlen som anges ovan mycket dyrare och kanske inte lätt tillgänglig för vissa patienter. Vanliga biverkningar inkluderar muntorrhet , nästäppa och försämrad manlig utlösning , som alla inte upphör med tiden och kan begränsa patientens efterlevnad . Även om det är ovanligt kan patienter ha ett hormonellt aktivt feokromocytom och ett normalt blodtryck. En jämförelse från 2014 visade att en liten dos av en kalciumkanalblockerare (t.ex. amlodipin ) kan användas före operation hos vissa människor. Detta kommer inte att sänka patienternas blodtryck drastiskt och göra dem hypotensiva , men det kommer att hjälpa kirurgiska och anestetiska team om det finns hemodynamisk instabilitet under operationen.
Betablockad
En förhöjd puls ( takykardi ) och känslan av ett tävlande hjärta ( hjärtklappning ) kan följa efter att en alfa-adrenoceptorantagonist startats . Om så är fallet föreskrivs sedan en beta-adrenoceptorantagonist för att kontrollera pulsen. Precis som med alfa-antagonisterna finns det selektiva (beta-1) och icke-selektiva (beta-1 och beta-2) adrenoceptorantagonister. De selektiva medlen ( atenolol , metoprolol ) föredras framför de icke-selektiva medlen ( propranolol ). Det finns flera ( labetalol , karvedilol ) kombinerade alfa-beta-adrenoceptorantagonister. Dessa medel bör undvikas när det är möjligt eftersom det finns upp till sju gånger mer beta-adrenoceptorantagonism än alfa, vilket kan förvärra högt blodtryck och leda till katekolaminkris.
Komplikationer
Beta -adrenoceptorantagonister ska inte ges ensamma till en feokromocytompatient - detta kan leda till allvarliga konsekvenser. År 1995 beskrev ett team av läkare från London döden av en person som nyligen hade diagnostiserats feokromocytom efter start av propranolol , en icke-selektiv betablockerare . Hon utvecklade snabbt en hypertensiv kris som ledde till chock , hjärtinfarkt , hjärtsvikt och tät höger hemiplegi . Trots försök till återupplivning dog personen flera dagar senare. Denna komplikation är relaterad till den effekt som alfa- och beta-adrenoceptorantagonister har på blodkärlen i kombination med katekolamins verkan . Det normala blodkärlet är öppet, vilket möjliggör adekvat blodflöde. När katekolaminer aktiverar alfa -receptorn, drar kärlet ihop sig (blir mindre), vilket resulterar i högt blodtryck . Men när katekolaminer aktiverar beta -receptorn vidgas blodkärlet (blir större) och möjliggör ökat blodflöde, vilket minskar blodtrycket. Om en feokromocytompatient bara startas på en beta-adrenoceptorantagonist, vänder detta den skyddande vasodilatationen och förvärrar hypertoni hos patienterna.
Kontrovers
Även om den föreoperativa alfa- och betablockaden som diskuterats ovan är överväldigande erkänd som vårdstandard, särskilt i USA, har det diskuterats på internationell nivå om en blockad är nödvändig. År 2017 publicerade ett team av forskare från Tyskland en observationsfallsserie som ifrågasatte de nuvarande rekommendationerna för en blockad. Studien undersökte det intraoperativa maximala systoliska arteriella trycket hos personer med och utan alfa-adrenoceptorblockad och fann ingen skillnad i komplikationer mellan de två grupperna. Året därpå publicerade en grupp från Frankrike en liknande artikel med en varning för att vänta en hel vecka med att börja alfa-blockad. De franska forskarna efterlyste omedelbart kirurgiskt ingrepp och övervägande av åtgärder för att mildra eventuell intraoperativ katekolaminkris. Dessa artiklar resulterade i motbevisningar från forskargrupper i USA, men ett internationellt samförstånd har ännu inte nåtts.
Perioperativ vätskestatus
Överskott av katekolaminer orsakar en minskning av den totala blodvolymen , vilket gör en patient sårbar för hypotoni under operationen. Därför bör en högnatriumdiet med tillräckligt vätskeintag uppmuntras före operationen. Vissa institutioner i USA kommer till och med att ta in patienter natten före operationen för intravenös vätskeersättning som börjar vid midnatt till tiden för operationen. En liten studie från 2009 rapporterade dock ingen skillnad i dödlighet hos patienter som behandlats med pre -operativa intravenösa vätskor jämfört med dem som inte gjorde det.
I en undersökning från 2010 av 40 endokrinologer av forskare vid Cedars-Sinai Medical Center i Los Angeles, Kalifornien, indikerade nästan alla vikten av preoperativ volymräddning (genom att patienten tar in mycket vätska före operationen). Efter att ha granskat sina patientdata misslyckades dock över 60% av samma läkare med att diskutera saltbelastning och adekvat hydrering. När patienterna stratifierades efter ålder fick de som var yngre rådet att hydrera , men äldre patienter inte. Det hypotes att leverantörer valde att avstå volym repletion i den äldre patientpopulationen av rädsla för deras potentiella sjukdomstillstånd ( hjärtsvikt ) där överskottsvätska är farligt. Även om det fortfarande inte finns någon erkänd konsensus eller guldstandard, bör leverantörer individualisera beslutet baserat på patientens upplevda näringsmässiga status , volymstatus , följdsjukdomar och förmåga att självhydrera.
Postoperativ ledning
De vanligaste postoperativa komplikationerna, sannolika orsaker och behandlingsalternativ är:
- Hypertoni : Hos feokromocytompatienten kan postoperativ hypertoni indikera ofullständig tumörresektion eller annan tumör med okänd plats. De traditionella, ospecifika orsakerna till postoperativ hypertoni inklusive smärta, vätskeöverbelastning och essentiell hypertoni måste också övervägas. En perioperativ hypertensiv kris behandlas först med en 5,0 milligram (mg) intravenös bolus av fentolamin , med ytterligare 5,0 mg dos var tionde minut tills blodtrycket faller inom ett acceptabelt intervall. Om blodtrycket bara är minimalt förhöjt kan patienten återuppta sin alfa- och beta-adrenoceptorantagonist från före operationen.
- Hypotoni : Det finns flera anledningar till att en patient kan ha lågt blodtryck under den postoperativa perioden. Först och främst har tumören (och dess överflöd av katekolaminer som orsakar högt blodtryck) tagits bort. Dessutom kan patienten fortfarande uppleva effekterna av sin alfa-adrenoceptorantagonist , vilket orsakar lägre blodtryck. Första linjens behandling för postoperativ hypotoni är aggressiv vätskeupplivning , varför det är så viktigt att säkerställa att patienten är välhydrerad (se ovan) före operationen. Vasopressorer kan behövas om blodtrycket inte reagerar på vätskor.
- Hyperglykemi : Katekolaminer förhindrar utsöndring av insulin - ett hormon som ansvarar för att sänka kroppens blodsocker (socker). Blodsockernivåerna bör kontrolleras ofta under den perioperativa perioden och insulin ska ges efter behov om nivåerna är förhöjda. Efter resektion kommer tumörrelaterad hyperglykemi sannolikt att lösa sig.
- Hypoglykemi : Efter att tumören har tagits bort, hämmas inte insulin längre, vilket kan leda till att blodsockret farligt lågt. Symtomen inkluderar tremor , ångest , hjärtklappning , svettningar , förändrad mental status (förvirring), yrsel och dimsyn . En retrospektiv analys av betablockerare fann att viss användning av betablockerare kan få människor att bli mer benägna att hypoglykemi och inte uppleva dessa symtom, vilket kan fördröja diagnosen.
-
Adrenal insufficiens: Efter en bilateral adrenalektomi (vänster och höger) kan patienten inte längre utsöndra de hormoner som behövs för att kroppen ska fungera. Livslång steroid ( hydrokortison och fludrokortison ) oralt tillskott kan krävas för att säkerställa att de inte utvecklar binjurebot. När kroppen är stressad (under operation) producerar binjurarna naturligtvis fler steroider; men om körtlarna har tagits bort kan de inte göra det. Därför krävs "stressdoserande" steroider och bör startas intraopertivt för att efterlikna binjurens naturliga fysiologi. Den typiska behandlingen när postoperativ binjurebortfall anses vara sannolik:
- 50 milligram (mg) intravenöst hydrokortison i operationssalen före anestesi
- Upprepa administrering av 25–50 mg intravenöst hydrokortison var åttonde timme i högst 72 timmar (3 dagar) efter operationen. Omvandla till oral ersättningsterapi så snart patienten kan ta medicin via munnen
- Patienterna bör övergå till en normal underhållsdos (vanlig, daglig) dos steroider före urladdning och hänvisas till endokrinologi för korrekt titrering och hantering. Beroende på patientens totala kroppsyta är den totala dagliga dosen av hydrokortison mellan 15 och 25 mg dagligen (uppdelat i morgon- och eftermiddagspiller).
- De som har tappat båda sina binjurar kommer också att behöva en annan steroid ( mineralkortikoidersättning ). Den typiska dagliga dosen är mellan 50 och 200 mikrogram fludrokortison
Det har rapporterats många andra komplikationer ( njursvikt , hjärtsvikt , tarmpseudoobstruktion ) efter tumörresektion. Ovanstående är dock mer sannolikt att stöta på, varför deras hantering har beskrivits specifikt här i denna artikel.
Metastatisk sjukdom
Diagnos och plats
Metastatiskt feokromocytom definieras som närvaron av tumörceller ( kromaffinvävnad ) där de normalt inte finns. Patienter med paragangliom är mer benägna att utveckla metastaser än de med feokromocytom. De vanligaste extra-adrenala ställena för metastaser är lymfkörtlar , lungor , lever och ben . Det har funnits flera studerade riskfaktorer associerade med utvecklingen av metastatisk sjukdom - medan patienternas genetiska bakgrund spelar en viktig roll, den initiala åldern för presentation och tumörens storlek leder till negativa resultat. Av alla de genetiska varianterna har succinatdehydrogenas -subenhet B (SDHB) -mutationer de högsta frekvenserna av att utveckla metastatisk sjukdom. En annan studie har rapporterat ökad dödlighet i samband med manligt kön och synkrona metastaser. Metastaser är indelade i synkrona och metakrona; de som är synkrona har utvecklats inom flera månader efter den primära tumören, medan metakrona metastaser inte visas under en signifikant tidsperiod.
Laparoskopisk metod för den ursprungliga sjukdomen, särskilt i stora tumörer, har utsetts som en viktig riskfaktor för tumörsådd.
Trots alla nedanstående möjliga behandlingsalternativ belyser ny litteratur att (för de flesta patienter) metastatiskt feokromocytom växer långsamt. Hos patienter med minimal sjukdomsbörda är en " titta och vänta " -metod med frekvent avbildning för att övervaka sjukdomen gynnsam, och avbryter behandlingen tills bevis på progression visualiseras.
Behandling
Metastatiskt feokromocytom hanteras bäst med ett tvärvetenskapligt team av onkologer , kirurger , radiologer , kärnmedicinska läkare och endokrinologer . Det finns flera behandlingsalternativ tillgängliga för patienter beroende på sjukdomsmängd och plats:
Kirurgi - Normalt är målet med operationen fullständig cytoreduktiv kirurgi ; lämna inga sjukdomar kvar. Men med utbredd metastatisk sjukdom är detta inte alltid möjligt. Därför utförs en kirurgisk debulking -procedur (avlägsnande av så mycket av cancervävnaden som möjligt) för att minska patientens symtom genom att ta bort källan till katekolaminer, förbättra svaret på kemo- eller radionuklidterapi eller helt enkelt minska tumörens storlek. Tyvärr är den avsedda lättnaden från proceduren ofta kortlivad, särskilt om patienten har sjukdom utanför buken. En studie från 2013 från National Institutes of Health rapporterade att en majoritet av patienterna drabbades av återkommande biokemiska bevis på sjukdom inom ett år efter operationen och mindre än 30% fortsatte att vara biokemiskt fria från sjukdom efter fem år.
Till skillnad från en operation för icke-metastatisk sjukdom kan ett öppet förfarande föredras framför en minimalt invasiv teknik för att kringgå potentiell tumörspridning. Detta underlättar också kirurgisk visualisering och erbjuder den bästa möjligheten att identifiera och ta bort metastatiska lymfkörtlar. Rapporter har också visat nyttan av att administrera ett radionuklidmedel som jod-123 meta-jodbensylguanadin ( 123 I-MIBG) före operationen och sedan skanna patienten intraoperativt med en sond för att upptäcka sjukdom som kan missas med blotta ögat.
Strålbehandling - Med avseende på feokromocytom används strålningstekniker främst för smärtkontroll, särskilt med avseende på benmetastaser , lokal kontroll av sjukdomen och för att begränsa ryggmärgskomprimering . Ett tvärvetenskapligt team från Mayo Clinic granskade retrospektivt alla sina patienter som genomgick strålbehandling med extern strålning 1973-2015 och rapporterade att 94% av patienterna erkände symtomatisk förbättring och över 80% av patienterna visade inga tecken på återkommande sjukdom 5 år efter terapi. En annan rapport från samma institution tittade på nästan två decennier av patienter som genomgick radiofrekvensablation , kryoablation eller perkutan etanolinjektion för metastatiskt feokromocytom och rapporterade att lokal kontroll uppnåddes i över 85% av riktade lesioner och att 92% av procedurerna var associerade med minskad smärta och/eller symptom på katekolaminöverskott .
Kemoterapi - Den vanligaste kemoterapiregimen för metastatiskt feokromocytom är cyklofosfamid , vincristin och dacarbazine , gemensamt känt som CVD. Svar på behandlingen mäts genom en minskning av den totala tumörvolymen samt symtomatisk lindring, rapporterad av patienten. En systematisk genomgång och metaanalys av ostratifierade feokromocytompatienter som genomgick CVD-behandling visade att 37% av patienterna hade en signifikant minskning av tumörvolymen, medan 40% av patienterna upplevde en lägre katekolaminbörda. Även om det inte var någon skillnad i total överlevnad mellan patienter vars tumörer krympt jämfört med dem utan svar (ingen minskning av tumörbördan via bildbehandling), rapporterade patienterna även om de inte svarade, blodtrycket var lägre och vissa patienter kunde till och med att opereras efter sjukdomstabilisering med CVD. När patienter studeras av olika kategorier har forskning föreslagit att kvinnor är mindre benägna att ha förlängd överlevnad med CVD -kemoterapi jämfört med sina manliga motsvarigheter. Genetisk status har visat stor inverkan på responsen på CVD. Ett team av forskare från National Institutes of Health rapporterade att patientens mutationer med succinatdehydrogenas -subenhet B (SDHB) inte bara är mer benägna att initialt svara på CVD, utan att de också upplevde över 30 månaders progressionsfri överlevnad (tid tills tumören återvände ) med fortsatt administration.
CVD är emellertid inte den enda beprövade kemoterapeutiska behandlingen hos feokromocytompatienten. En rapport från 2018 visade det anmärkningsvärda svaret hos två SDHB -patienter som misslyckades med CVD -kemoterapi (sjukdomen utvecklades trots medicinering), men behandlades sedan med temozolomid (TMZ) och hade en progressionsfri överlevnad på 13 och 27 månader, vilket indikerar att TMZ kan betraktas som en alternativ behandling hos dem som har utvecklats med CVD. Flera studier har sedan rapporterat framgångsrika svar med TMZ, särskilt i SDHB - underpopulationen .
Radionuklidterapi
- Jod-131 meta-jodbensylguanadin (MIBG)
- Som nämnts i avsnittet om funktionell avbildning ovan är MIBG inte bara användbart för att lokalisera förekomsten av metastatisk sjukdom, utan också som en tillgänglig behandlingsmetod. År 2019 tittade en multi-center fas 2-studie på säkerheten och effekten av MIBG-terapi hos metastaserade eller oresekterbara (inte bidrar till kirurgiska) feokromocytompatienter och resultaten var lovande. Median överlevnad var 36,7 månader och 92% av patienterna hade åtminstone ett delvis positivt svar (tumorkrympning) eller stabil sjukdom utan progression inom det första året av studien. Dessutom kunde över en fjärdedel av patienterna minska sina antihypertensiva läkemedel och rapporterade symtomatisk förbättring. Det finns flera patienter som inte är berättigade till MIBG-behandling, inklusive gravida kvinnor (exponering för strålning är skadligt för fostret ), kvinnor som aktivt ammar , patienter med njursvikt och de som inte förväntas leva längre än 3 månader. Eftersom MIBG -terapi kan förstöra sköldkörteln startas skyddande läkemedel ( kaliumjodid ) före behandlingen och måste fortsätta i minst 3 veckor efter avslutad behandling. Tillhörande biverkningar ( muskelsvaghet , illamående , kräkningar och hematologiska (blod) toxiciteter är vanliga, men ofta minimala, och kan lindras med långsam, stadig dosering.
-
Peptidreceptor Radionuklidterapi (PRRT)
- Det nyaste av behandlingsalternativen, PRRT använder 68-Ga DOTA- analogerna som nämns ovan i avsnittet om funktionell bildbehandling. Behandling med 177 Lu-DOTATATE visade först framgång hos patienter med odifferentierade neuroendokrina tumörer och sedan började studier med metastatiska feokromocytompatienter. År 2019 publicerade Vyakaranam et al gynnsamma resultat för sina 22 patienter som genomgick PRRT, med partiellt svar hos 2 patienter och stabil sjukdom (ingen progression) hos de återstående 20 patienterna. Övergripande toxicitet var låg, utan rapporterade högkvalitativa hematologiska (blod) eller njurskador. I slutet av samma år tittade en systemisk granskning på alla publicerade artiklar (12) där metastatiska feokromocytompatienter genomgick PRRT och fann att behandlingsrelaterade biverkningar är minimala, med endast 5 av 102 patienter som valde att frivilligt sätta in behandlingen. Nyare rapporter har beskrivit nyttan av att kombinera 90 Y- DOTATATE med den traditionellt studerade 177 Lu-analogen och de olika möjligheterna och nya behandlingsalternativen som dessa kombinationer kommer att ge till fältet. Även om de övergripande rapporterade biverkningarna har varit lovande, är det viktigt Medan de övergripande rapporterade biverkningarna har varit lovande är det viktigt att notera att ett samarbete mellan National Institutes of Health och Radboud University Medical Center rapporterade två olyckliga fall av snabb sjukdomsprogression efter ett anmärkningsvärt, nästan fullständigt svar på PRRT. Även om etiologin för deras återkommande är okänd, spekulerade laget i att en förhöjd tumörmarkör ( Ki-67 ) kan vara en indikation på ett dåligt svar på PRRT och krävde bedömningar före PRRT för att inkludera Ki-67-värden för att hjälpa till att individualisera patientbehandling planer.
Prognos
Enligt National Cancer Institute , prognosen definieras som det troliga resultatet av en sjukdom eller, risken för återvinning eller ett återfall. Detta är en extremt svår fråga när det gäller feokromcytom, och svaret beror på patienternas genetiska status, förekomst av metastatisk sjukdom och placeringen av deras primära tumör. En artikel om prognos som publicerades 2000 rapporterade en 91% 5-årig överlevnad i deras patientpopulation; Det är dock viktigt att notera att över 86% av deras patienter hade sporadiska tumörer (ingen känd genetisk mutation), som vanligtvis har låg malign potential. År 2019 tittade ett konsortium på nästan tjugo europeiska vårdcentraler på prognosen för malignt feokromocytom och uppgifterna varierar starkt från rapporten om sporadiska, enstaka tumörer, med en medianöverlevnad på 6,7 år. Den övergripande överlevnaden förbättrades om patienten hade (1) sjukdom i huvud och nacke jämfört med buken, (2) under 40 år, (3) och om deras biokemi var mindre än fem gånger den övre referensgränsen för normalvärdet.
Ny litteratur har detaljerat flera faktorer som förutspår accelererad sjukdomsprogression och högre dödlighet, inklusive patienter som väljer att avstå från kirurgisk resektion av sin primära tumör, större tumörer vid initial presentation, äldre ålder vid initial diagnos och en kortare tid från primär tumör till förekomst av metastaser. Metastasernas faktiska läge kan också indikera prognos, med osseösa lesioner (ben) som klarar sig bättre än deras mjukvävnad ( lungor , lever ).
Epidemiologi
Enligt North American Neuroendocrine Tumor Society är förekomsten av feokromocytom mellan 1: 2500 och 1: 6500, vilket betyder att för varje 2 500 - 6 500 personer finns det (i genomsnitt) en person med feokromocytom. I USA motsvarar detta en årlig incidens (nya fall per år) på 500 till 1600 fall. Emellertid rapporterade approximationer i början av 2000 -talet att uppemot 50% av feokromocytom -diagnoserna är vid obduktion ; därför kan ovanstående uppskattningar vara lägre än väntat. I en 50-årig obduktionsserie granskade Mayo Clinic 54 feokromocytomfall mellan 1928–1977 och upptäckte att bara 24% av patienterna diagnostiserades korrekt före deras död. Utanför USA har flera länder dokumenterat sina egna epidemiologiska studier och jämfört dem med vad som är känt i Nordamerika . I den första nationella, epidemiologiska befolkningsbaserade studien i Asien med data från Korean National Health Insurance Service rapporterades förekomsten av ett feokromocytom 2,13 per 100 000 personer med en incidens på 0,18 per 100 000 personår. Detta är lägre än förekomsten som rapporterats från Rochester, Minnesota (0,8 per 100 000 personår) i en studie utförd från 1950-1979. Men Nederländerna genomförde också en studie med ett rikstäckande register och rapporterade förekomsten resultaten från 0,57 per 100.000 årsverken från 2011-2015, vilket var en betydande ökning från sina 0,37 fall per 100.000 årsverken rapporteras 1995-1999. Nuvarande hypoteser om varför förekomsten av feokromocytom växer i den nederländska befolkningen pekar på tillkomsten av modern bildbedömning och förmågan att upptäcka dessa tumörer före döden. Medan var och en av ovanstående studier rapporterade varierande incidens- och prevalensvärden, har alla indikerat att medelåldern vid initial diagnos är mellan det tredje till femte decenniet av livet. När yngre patienter diagnostiseras med ett feokromocytom bör det finnas en hög misstanke om ärftlig sjukdom, eftersom genetisk förväntan (tidigare sjukdomsdebut med varje generation) är associerad med vissa mutationer.
Klassiskt har feokromocytom "regler om 10" lärt sig, särskilt till medicinska studenter:
- 10% av patienterna har malign sjukdom
- 10% av patienterna har bilateral (både vänster och höger binjur) sjukdom
- 10% av patienterna har extra adrenal (paragangliom) sjukdom
- 10% av patienterna har ärvt (familjesjukdom)
Trots framträdandet i många respekterade läroböcker har dessa riktlinjer sedan fastställts som felaktiga och används inte i nuvarande epidemiologiska diskussioner.
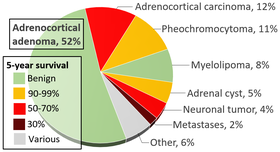
Som föreslagits ovan har tillfällig bildbehandling blivit en viktig aktör i diagnosen av patienter med feokromocytom, med nuvarande uppskattningar mellan 10–49% av alla fall som diagnostiserats efter att avbildning erhölls av en annan anledning. När en binjursknupp (potentiell tumör) upptäcks vid datortomografi eller magnetisk resonansavbildning finns det mellan 5 och 10% chans att lesionen är ett feokromocytom. Förekomsten av binjurstumörer finns i infografiken ovan, med feokromocytom noterat i gult i det övre högra hörnet.
Historia
År 1800 skrev en irländsk läkare (Charles Sugrue) en fallrapport till London Medical and Physical Journal som beskriver det märkliga fallet med en 8-årig manlig patient som hade drabbats av till synes slumpmässiga smärtanfall koncentrerade i buken tillsammans med "en hektisk spolning tydligt markerad på varje kind "med en" konstant riklig och universell svettning . " Efter hans död utförde en grupp läkare en obduktion för att fastställa dödsorsaken och upptäckte en sex tum lång avlång tumör som består av en okänd "gulaktig färgad substans" som kommer från capsula renalis (det som nu kallas binjurarna) . Detta skulle bli den första kända kliniska beskrivningen av ett feokromocytom, men eftersom inga egenskaper hos själva tumören beskrevs, ges fullständig kredit till tysken Felix Fraenkel, som gav en klinisk och morfologisk bild av denna tumör. Medan olika läkare kände igen symptom och behandlade patienter rapporterade den tjeckiska biologen Alfred Kohn att han upptäckte paraganglia -systemet, vilket senare skulle bli avgörande för diagnosen av dessa tumörer. Dessutom introducerade han också termen " kromaffin ", så att patologer kunde känna igen tumörer som uppstod från binjurarna .
År 1908 introducerade två patologer , Henri Alezais och Felix Peyron, det vetenskapliga samfundet för " paragangliom " efter att de upptäckte extra adrenal vävnad som reagerade på kromsalter, vilket efterliknade reaktionen av binjuret. Bara fyra år senare myntade den tyska patologen Ludwig Pick termen "feokromocytom" efter att han observerat den konsekventa färgförändringen i tumörer som är associerade med binjurens medulla . Många kirurger försökte ta bort dessa tumörer under det kommande decenniet, men deras patienter dog intraoperativt av chock. År 1926 blev Charles Mayo (en av grundarna av Mayo Clinic ) den första läkaren som lyckades skära ut ett feokromocytom. Men Mayo var troligtvis inte medveten om diagnosen före operationen. Först 1929 erkändes ett feokromocytom preoperativt. Under början av 1900-talet varierade den operativa dödligheten för ett feokromocytom från 30-45%. Retrospektiva serier har antagit att dessa oroväckande höga dödsfall berodde på bristen på en pre-operativ blockad med alfa- och beta-adrenoceptorantagonist och behovet av moderna anestesimetoder. Från och med nu har läkare-forskare identifierat mönster hos patienter med feokromocytom och identifierat genetiska föreningar och olika syndrom.
Samhälle och kultur
Även om det är en sällsynt sjukdom har det funnits flera referenser till feokromocytom i populärkultur och media, särskilt medicinska tv -dramer . Dessutom finns det ett starkt online patientförespråkande samhälle som arbetar för att ansluta patienter med sällsynta sjukdomar och låter dem träffa andra individer som upplever liknande diagnoser och behandlingsstrategier.
Zebra kultur
I det medicinska samhället lärs eleverna ofta "när du hör hovslag i Texas, tänk hästar, inte zebror." Med andra ord är vanliga diagnoser vanliga, så vårdpersonal bör först utesluta vad som förväntas mest (hästarna) innan de dyker in i de sällsynta etiologier som är mycket mindre sannolika att vara korrekta (zebrorna). Men en symbol för zebra har blivit allt kraftfullare för sällsynta sjukdomar samhället och resulterade i flera organisationer, föreningar, och speciella evenemang ( Rare Disease Day ) för att fästa uppmärksamheten på den minsta gemensamma alternativet ibland vara rätt diagnos.
Den nationella organisationen för sällsynta sjukdomar är en USA-baserad opinionsbildning moderorganisation med målet att främja medvetenheten och forskningsmöjligheter för att bota sällsynta sjukdomar. Grupper som dessa uppmuntrar patienter att bli sina egna förespråkare och förändringsagenter i sina beslutsprocesser inom vården.
Media
I juli 2012 presenterades en verklig feokromocytompatient, Tannis Brown, tidigare vice ordförande för PheoPara Troopers, i programmet Discovery Fit & Health Network Diagnosis: Dead or Alive. Showen belyste hennes personliga kamp med feldiagnostiserad sjukdom eftersom många läkare kände att hennes episodiska huvudvärk och högt blodtryck (högt blodtryck) var relaterat till stress.
Under den sjunde och åttonde säsongen av Grays Anatomy har seriens regelbundna Henry en Von Hippel-Lindau (VHL) mutation som har resulterat i ett feokromocytom. Den berättelse båge möttes med blandade åsikter från sällsynta sjukdomar samhälle. Då var verkställande direktören för VHL -alliansen nöjd med skildringen av en VHL -patient i vanliga medier, men påpekade att av de fyra manus hon kände till med en VHL -patient var tre involverade ett feokromocytom, som faktiskt förekommer hos mindre än en femtedel av alla VHL -patienter.
Referenser
externa länkar
- " Allmän information om feokromocytom och Paraganglioma " från National Cancer Institute
- Feokromocytom och Paraganglioma från American Society of Clinical Oncology
- Feokromocytom ; Sällsynta sjukdomsdatabas från National Organization for Rare Disorders
- Vad du behöver veta om feokromocytom från Medical News Today
- MedlinePlus Översikt feokromocytom
- GeneReviews inlägg om " ärftliga paragangliom-feokromocytomsyndrom "
| Klassificering | |
|---|---|
| Externa resurser |