Neuroimmunt system - Neuroimmune system
| Neuroimmunt system | |
|---|---|
 Detta diagram visar de neuroimmuna mekanismerna som förmedlar metamfetamininducerad neurodegeneration i den mänskliga hjärnan. Det NF-KB- medierade neuroimmuna svaret på metamfetaminanvändning som resulterar i ökad permeabilitet av blod-hjärnbarriären uppstår genom dess bindning vid och aktivering av sigma-1-receptorer , den ökade produktionen av reaktiva syrearter (ROS), reaktiva kvävearter (RNS), och skadeassocierade molekylära mönstermolekyler (dämpas), i dysreglering av glutamat transportörer (specifikt EAAT1 och EAAT2 ) och glukosmetabolism , och överdriven kalciuminflöde i gliaceller och dopamin neuroner .
| |
| Detaljer | |
| Systemet | Neuroimmun |
| Identifierare | |
| Maska | D015213 |
| Anatomisk terminologi | |
Det neuroimmuna systemet är ett system av strukturer och processer som involverar de biokemiska och elektrofysiologiska interaktionerna mellan nervsystemet och immunsystemet som skyddar neuroner från patogener . Det tjänar till att skydda neuroner mot sjukdomar genom att upprätthålla selektivt permeabla barriärer (t.ex. blod -hjärnbarriären och blod -cerebrospinalvätskebarriären ), förmedla neuroinflammation och sårläkning i skadade neuroner och mobilisera värdförsvar mot patogener.
Det neuroimmuna systemet och det perifera immunsystemet skiljer sig strukturellt. Till skillnad från det perifera systemet består det neuroimmuna systemet främst av glialceller ; bland alla hematopoetiska celler i immunsystemet finns normalt bara mastceller i det neuroimmuna systemet. Under ett neuroimmunt svar kan emellertid vissa perifera immunceller passera olika blod- eller vätske -hjärnbarriärer för att reagera på patogener som har trängt in i hjärnan. Till exempel finns det bevis på att makrofager och T -celler i immunsystemet efter skada migrerar in i ryggmärgen. Produktion av immunceller i komplementsystemet har också dokumenterats skapas direkt i centrala nervsystemet.
Strukturera
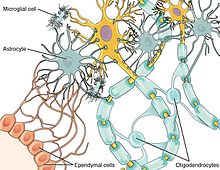
De viktigaste cellulära komponenterna i det neuroimmuna systemet är glialceller , inklusive astrocyter , mikroglia och oligodendrocyter . Till skillnad från andra hematopoetiska celler i det perifera immunsystemet förekommer mastceller naturligt i hjärnan där de förmedlar interaktioner mellan tarmmikrober, immunsystemet och centrala nervsystemet som en del av mikrobiota -tarm -hjärnaxeln .
G-proteinkopplade receptorer som finns i både CNS och immuncelltyper och som är ansvariga för en neuroimmun signalprocess inkluderar:
- Kemokinreceptorer : CXCR4
- Cannabinoidreceptorer : CB1 , CB2 , GPR55
- Spåra aminassocierade receptorer : TAAR1
- μ-opioidreceptorer- alla undertyper
Cellfysiologi
Neuroimmunsystemet, och studier av, omfattar förståelse för immun- och neurologiska system och de tvärreglerande effekterna av deras funktioner. Cytokiner reglerar immunsvar, möjligen genom aktivering av hypothalamus-hypofys-binjur (HPA) axel. Cytokiner har också varit inblandade i samordningen mellan nervsystemet och immunsystemet. Instanser av cytokinbindning till neurala receptorer har dokumenterats mellan den cytokinfrisättande immuncellen IL-1 β och den neurala receptorn IL-1R . Denna bindning resulterar i en elektrisk impuls som skapar känslan av smärta. Växande bevis tyder på att autoimmuna T-celler är inblandade i neurogenes. Studier har visat att under tider med adaptivt immunsystemsvar ökar hippocampus neurogenes och omvänt att autoimmuna T-celler och mikroglia är viktiga för neurogenes (och så minne och lärande) hos friska vuxna.
Det neuroimmuna systemet använder kompletterande processer av både sensoriska neuroner och immunceller för att upptäcka och reagera på skadliga eller skadliga stimuli. Till exempel kan invaderande bakterier samtidigt aktivera inflammasomer , som behandlar interleukiner ( IL-1 β ), och depolariserar sensoriska neuroner genom utsöndring av hemolysiner . Hemolysiner skapar porer som orsakar en depolariserande frisättning av kaliumjoner inuti den eukaryota cellen och en tillströmning av kalciumjoner. Tillsammans resulterar detta i en aktionspotential i sensoriska neuroner och aktivering av inflammasomer.
Skada och nekros orsakar också ett neuroimmunt svar. Frisättningen av adenosintrifosfat (ATP) från skadade celler binder till och aktiverar både P2X7 -receptorer på makrofager i immunsystemet och P2X3 -receptorer för nociceptorer i nervsystemet. Detta orsakar det kombinerade svaret av både en resulterande åtgärdspotential på grund av depolarisationen som skapas av tillströmningen av kalcium och kaliumjoner, och aktiveringen av inflammasomer. Den producerade åtgärdspotentialen är också ansvarig för känslan av smärta, och immunsystemet producerar IL-1 β som ett resultat av ATP P2X7-receptorbindningen.
Även om inflammation vanligtvis betraktas som ett immunsvar, finns det en orkestrering av neurala processer som är involverade i immunsystemets inflammatoriska process. Efter skada eller infektion finns det en kaskad av inflammatoriska svar, såsom utsöndring av cytokiner och kemokiner som kopplar ihop med utsöndringen av neuropeptider (t.ex. substans P ) och signalsubstanser (t.ex. serotonin ). Tillsammans har detta kopplade neuroimmuna svar en förstärkande effekt på inflammation.
Neuroimmuna svar
Neuron-glialcellsinteraktion
Neuroner och glialceller arbetar tillsammans för att bekämpa inträngande patogener och skador. Kemokiner spelar en framträdande roll som medlare mellan neuron-glial cellkommunikation eftersom båda celltyperna uttrycker kemokinreceptorer. Till exempel har kemokinfraktalkinet varit inblandat i kommunikation mellan mikroglia och dorsal root ganglion (DRG) neuroner i ryggmärgen. Fraktalkin har associerats med överkänslighet mot smärta vid injektion in vivo och har visat sig uppreglera inflammatoriska medierande molekyler. Glialceller kan effektivt känna igen patogener i både centrala nervsystemet och i perifera vävnader. När glialceller känner igen främmande patogener genom användning av cytokin och kemokinesignalering kan de vidarebefordra denna information till CNS. Resultatet är en ökning av depressiva symtom. Kronisk aktivering av glialceller leder dock till neurodegeneration och neuroinflammation .
Mikroglialceller är av de mest framträdande typerna av glialceller i hjärnan. En av deras huvudfunktioner är fagocytosering av cellulärt skräp efter neuronal apoptos . Efter apoptos utsöndrar döda neuroner kemiska signaler som binder till mikroglialceller och får dem att sluka skadligt skräp från den omgivande nervvävnaden. Microglia och komplementsystemet är också associerade med synaptisk beskärning eftersom deras utsöndring av cytokiner, tillväxtfaktorer och andra komplement hjälper till att avlägsna föråldrade synapser.
Astrocyter är en annan typ av glialceller som bland andra funktioner modulerar inträdet av immunceller i CNS via blod -hjärnbarriären (BBB). Astrocyter frigör också olika cytokiner och neurotrofiner som tillåter immunceller att komma in i CNS; dessa rekryterade immunceller riktar sig både mot patogener och skadad nervvävnad.
Reflexer
Uttagsreflex
Det tillbakadragande reflex är en reflex som skyddar en organism från skadliga stimuli. Denna reflex uppstår när skadliga stimuli aktiverar nociceptorer som skickar en åtgärdspotential till nerver i ryggraden, som sedan innerverar effektormusklerna och får ett plötsligt ryck att flytta organismen bort från de farliga stimuli. Tillbakadragningsreflexen involverar både nervsystemet och immunsystemet. När aktionspotentialen färdas tillbaka ner spinalnervnätet, färdas en annan impuls att perifer sensorisk neuroner som utsöndrar aminosyror och neuropeptider såsom kalcitonin-gen-relaterad peptid (CGRP) och substans P . Dessa kemikalier verkar genom att öka rodnad, svullnad av skadade vävnader och fästning av immunceller till endotelvävnad , och därigenom öka permeabiliteten hos immunceller över kapillärer .
Reflexrespons mot patogener och toxiner
Neuroimmuna interaktioner uppstår också när patogener , allergener eller toxiner invaderar en organism. De vagusnerven ansluter till tarmen och luftvägarna och framkallar nervimpulser till hjärnstammen som svar på detekteringen av toxiner och patogener. Denna elektriska impuls som rör sig ner från hjärnstammen reser till slemhinneceller och stimulerar utsöndringen av slem; denna impuls kan också orsaka utsläpp av toxinet genom muskelsammandragningar som orsakar kräkningar eller diarré.
Reflexrespons mot parasiter
Det neuroimmuna systemet är inblandat i reflexer associerade med parasitiska invasioner av värdar. Nociceptorer är också associerade med kroppens reflexer mot patogener som de är på strategiska platser, såsom luftvägar och tarmvävnader, för att inducera muskelsammandragningar som orsakar repor, kräkningar och hosta. Dessa reflexer är alla utformade för att mata ut patogener från kroppen. Till exempel induceras repor av pruritogener som stimulerar nociceptorer på epidermala vävnader. Dessa pruritogener, liksom histamin , får också andra immunceller att utsöndra ytterligare pruritogener i ett försök att orsaka mer klåda för att fysiskt avlägsna parasitiska inkräktare. När det gäller tarm- och bronkialparasiter kan kräkningar, hosta och diarré också orsakas av nociceptorstimulering i infekterade vävnader och nervimpulser från hjärnstammen som innerverar respektive glatta muskler .
Eosinofiler som svar på capsaicin kan utlösa ytterligare sensorisk sensibilisering för molekylen. Patienter med kronisk hosta har också en förbättrad hostreflex mot patogener även om patogenen har utvisats. I båda fallen orsakar frisättningen av eosinofiler och andra immunmolekyler en överkänslighet av sensoriska neuroner i bronkiala luftvägar som ger förbättrade symtom. Det har också rapporterats att ökade immuncellsutsöndringar av neurotrofiner som svar på föroreningar och irriterande ämnen kan omstrukturera det perifera nervnätet i luftvägarna för att möjliggöra ett mer grundat tillstånd för sensoriska neuroner.
Klinisk signifikans
Det har visats att långvarig psykologisk stress kan kopplas till ökad infektionsrisk via viral luftvägsinfektion. Studier på djur indikerar att psykologisk stress höjer glukokortikoidnivåerna och så småningom en ökning av mottagligheten för streptokocker hudinfektioner.
Det neuroimmuna systemet spelar en roll vid Alzheimers sjukdom . I synnerhet kan mikroglia vara skyddande genom att främja fagocytos och avlägsnande av amyloid-β (Aβ) avlagringar, men också bli dysfunktionell när sjukdomen utvecklas, producera neurotoxiner , sluta rensa Aβ-avlagringar och producera cytokiner som ytterligare främjar Aβ-avsättning. Det har visat sig att vid Alzheimers sjukdom aktiverar amyloid-p direkt mikroglia och andra monocyter för att producera neurotoxiner .
Astrocyter har också varit inblandade i multipel skleros (MS). Astrocyter är ansvariga för demyelinisering och förstörelse av oligodendrocyter som är associerad med sjukdomen. Denna demyeliniserande effekt är ett resultat av utsöndringen av cytokiner och matrismetalloproteinaser (MMP) från aktiverade astrocytceller till angränsande neuroner. Astrocyter som förblir i ett aktiverat tillstånd bildar glialärr som också förhindrar återmyelinisering av neuroner, eftersom de är ett fysiskt hinder för oligodendrocyttfaderceller (OPC).
Det neuroimmuna systemet är också inblandat i astma och kronisk hosta , eftersom båda är ett resultat av det överkänsliga tillståndet i sensoriska neuroner på grund av frisättning av immunmolekyler och positiva återkopplingsmekanismer.
Prekliniska och kliniska studier har visat att cellulära (mikroglia/makrofager, leukocyter, astrocyter och mastceller etc.) och molekylära neuroimmuna svar bidrar till sekundär hjärnskada efter intracerebral blödning.
Se även
Referenser
Vidare läsning
- Ikezu, Tsuneya; Gendelman, Howard E. (2008-03-21). Neuroimmun farmakologi . Springer Science & Business Media. ISBN 9780387725734.