Katekolaminerg polymorf kammartakykardi - Catecholaminergic polymorphic ventricular tachycardia
| Katekolaminerg polymorf kammartakykardi | |
|---|---|
| Andra namn | CPVT |
 | |
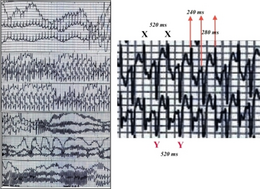
| Dubbelriktad ventrikulär takykardi hos en patient med CPVT | |
| Specialitet | Kardiologi |
| Symtom | Blackouts , plötslig hjärtdöd |
| Vanlig debut | Barndom / tonåren |
| Orsaker | Genetisk |
| Riskfaktorer | Familjehistoria |
| Diagnostisk metod | Elektrokardiogram (EKG), genetisk testning , provokation av adrenalin, träningstest |
| Differentiell diagnos | Långt QT-syndrom , Brugadas syndrom , Andersen-Tawil-syndrom , Tidig repolarisationssyndrom |
| Behandling | Undvikande av ansträngande träning, medicinering, implanterbar defibrillator för hjärtomvandlare |
| Medicin | Beta-adrenoceptorblockerare , Verapamil , Flecainide |
| Prognos | 13–20% livshotande arytmier över 7–8 år |
| Frekvens | 1: 10.000 |
Katekolaminerg polymorf ventrikulär takykardi ( CPVT ) är en ärftlig genetisk sjukdom som predisponerar de drabbade för potentiellt livshotande onormala hjärtrytmer eller arytmier . De arytmier som ses i CPVT uppträder vanligtvis under träning eller vid tider av känslomässig stress och tar klassiskt formen av dubbelriktad ventrikulär takykardi eller ventrikelflimmer . De drabbade kan vara asymptomatiska, men de kan också uppleva blackouts eller till och med plötslig hjärtdöd .
CPVT orsakas av genetiska mutationer som påverkar proteiner som reglerar koncentrationerna av kalcium inom hjärtmuskelceller . Den vanligast identifierade genen är RYR2 , som kodar för ett protein som ingår i en jonkanal känd som ryanodinreceptorn ; denna kanal släpper ut kalcium från en cells interna kalciumlager, det sarkoplasmiska nätverket , under varje hjärtslag.
CPVT diagnostiseras ofta från ett EKG som registrerats under ett träningstoleransprov , men det kan också diagnostiseras med ett genetiskt test . Tillståndet behandlas med läkemedel inklusive beta-adrenoceptorblockerare eller flekainid , eller med kirurgiska ingrepp inklusive sympatisk denervering och implantering av en defibrillator . Det tros påverka så många som en av tio tusen personer och beräknas orsaka 15% av alla oförklarliga plötsliga hjärtdöd hos unga människor. Tillståndet erkändes först 1960 och den underliggande genetiken beskrevs 2001.
tecken och symtom
Även om individer med CPVT kanske inte upplever några symtom är de vanligaste rapporterade symtomen blackouts eller plötslig medvetslöshet, kallad synkope . Dessa blackouts inträffar ofta under träning eller som ett svar på emotionell stress - situationer där kemiska budbärare som kallas katekolaminer , såsom adrenalin , släpps ut i kroppen. Blackouts kan tolkas felaktigt som orsakade av enkla svimningar eller epilepsi , vilket ofta leder till förseningar i att nå rätt diagnos. Hos en tredjedel av de drabbade kan den första manifestationen av sjukdomen vara hjärtstopp, vilket kan leda till plötslig död. Detta kan förekomma hos mycket små barn, som uppträder som plötsligt spädbarnsdödssyndrom eller "barnsäng". Cirka 30% av dem med CPVT kommer att ha en familjemedlem som har upplevt blackouts, anfall eller plötslig död som svar på motion eller stress.
Hos personer med CPVT kan katekolaminfrisättning leda till onormal hjärtrytm eller arytmi som kallas ventrikulär takykardi . Ventrikulär takykardi kan ha en karakteristisk form som kallas dubbelriktad ventrikulär takykardi. Denna form av ventrikulär takykardi förekommer relativt sällan, men om det ses tyder på en underliggande diagnos av CPVT eller det relaterade tillståndet Andersen-Tawil syndrom . Dessa ventrikulära arytmier upphör i vissa fall av sig själva och orsakar en mörkläggning från vilken personen sedan återhämtar sig. Men om den onormala hjärtrytmen fortsätter kan den degenerera till en farligare arytmi som kallas ventrikelflimmer som orsakar hjärtstillestånd och, om den inte behandlas, plötslig död.
Det finns vanligtvis mycket få onormala tecken på klinisk undersökning hos personer med CPVT. De med CPVT kan emellertid utveckla en mindre allvarlig hjärtrytmstörning som kallas förmaksflimmer , vilket kan detekteras vid undersökning som en oregelbunden puls. Dessutom har cirka 20% av dem med CPVT en långsam vilopuls som kallas sinusbradykardi .
Mekanism
Excitation-contraction coupling
De arytmier som de med CPVT upplever orsakas av abnormiteter i det sätt som hjärtmuskelceller kontrollerar deras kalciumnivåer . Kalcium samverkar med proteinfibrerna eller myofibrillerna inuti cellen som gör att cellen kan dra ihop sig, och koncentrationen av kalcium i varje cell måste regleras noggrant. Under varje hjärtslag måste koncentrationen av kalcium stiga för att låta muskeln dra ihop sig och sedan falla för att låta musklerna slappna av, en process som uppnås genom att använda en butik i cellen som kallas sarkoplasmatisk retikulum .
I början av varje hjärtslag frigörs kalcium från det sarkoplasmiska retikulumet genom specialiserade kanaler som kallas ryanodinreceptorer . Ryanodinreceptorer öppnas när koncentrationen av kalcium nära kanalen ökar. Detta händer när, som svar på en elektrisk signal från cellmembranet som kallas en åtgärdspotential , en liten mängd kalcium strömmar över cellmembranet in i cellen genom kalciumkanaler av L-typ , varav många är belägna på specialutrymmen i kallade T-tubuli som är utformade för att föra dessa ytjonkanaler nära det sarkoplasmiska nätverket.
Ökningen av kalciumkoncentration utlöser ryanodinreceptorer på det sarkoplasmatiska retikulumet för att frigöra en puff av kalcium som kallas kalciumgnista . Varje gnista utlöser frisättningen av ytterligare gnistor från angränsande ryanodinreceptorer för att skapa en organiserad ökning av kalcium i hela cellen som kallas en kalciumtransient. I slutet av varje hjärtslag pumpas kalcium tillbaka av ett protein som kallas SERCA tillsammans med dess reglerande protein fosfolamban . Kalciumet hålls sedan i det sarkoplasmatiska retikulumet av ett protein som kallas calsequestrin .
Finjustering av denna process kan uppnås genom fosforylering av dessa proteiner. Som ett exempel aktiverar katekolaminer under träning beta-adrenoceptorer på cellytan, vilket utlöser proteinkinas A för att fosforylera kalciumkanalen av L-typ, vilket ökar flödet av kalcium in i cellen. Samtidigt orsakar fosforylering av det reglerande proteinet fosfolamban att mer kalcium dras upp i det sarkoplasmiska nätverket. Den totala effekten av detta är att generera en större kalciumtransient med varje takt, vilket leder till en kraftigare sammandragning.
Kalciumberoende arytmier
Förändringar av proteinerna som är involverade i excitation-kontraktionskoppling kan störa denna noggrant reglerade process. Hos dem med CPVT kan den normala täta regleringen av kalcium bli störd, vilket leder till arytmier. Medan kalcium generellt frigörs från det sarkoplasmiska retikulumet som svar på en åtgärdspotential, kan kalciumgnistor också uppstå spontant. I ett friskt hjärta är en spontan kalciumgnista i allmänhet en isolerad händelse och går inte längre, men om ryanodinreceptorer eller proteinerna som reglerar dem är onormala, kan dessa gnistor utlösa frisättningar från angränsande ryanodinreceptorer som sprids genom cellen som en kalciumvåg . Dessa kalciumvågor är mycket mer benägna att uppträda när hjärtmuskelceller stimuleras av katekolaminer såsom adrenalin, vilket ökar koncentrationen av kalcium i det sarkoplasmatiska nätverket och sensibiliserar ryanodinreceptorerna. Den okontrollerade kalciumvågen kan tvingas ut genom cellmembranet via natrium-kalciumväxlaren , vilket orsakar en elektrisk ström som kallas en fördröjd efterdepolarisering . Efterdepariseringar, om de är tillräckligt stora, kan utlösa ytterligare åtgärdspotentialer, för tidiga ventrikulära sammandragningar eller ihållande arytmier.
Orsaker
| Typ | OMIM | Gen | Ställe | Arv | Anteckningar |
|---|---|---|---|---|---|
| CPVT1 | 604772 | RYR2 | 1q42.1-q43 | AD | Ryanodinreceptor - frigör kalcium från det sarkoplasmatiska retikulumet |
| CPVT2 | 611938 | CASQ2 | 1p13.3-p11 | AR | Calsequestrin - kalciumbuffert i sarkoplasmatisk retikulum |
| CPVT3 | 614021 | TECRL | 7p22-p14 | AR | Trans-2,3-enoyl-CoA-reduktasliknande protein - interagerar med ryanodinreceptorer och kalsequestrin |
| CPVT4 | 614916 | KALM1 | 14q32.11 | AD | Kalmodulin - stabiliserar ryanodinreceptorer |
| CPVT5 | 615441 | TRDN | 6q22,31 | AR | Triadin - bildar komplex med calsequestrin för att interagera med ryanodinreceptorer |
CPVT kan orsakas av mutationer i flera gener, som alla är ansvariga för att reglera kalciumkoncentrationerna i hjärtmuskelceller. Den vanligast identifierade genetiska mutationen i CPVT är en mutation i RYR2- genen som kodar för hjärt-ryanodinreceptorn, som är ansvarig för att frigöra kalcium från det sarkoplasmatiska retikulumet. Mutationer associerade med CPVT har också identifierats i CASQ2- genen som kodar för calsequestrin, ett protein som binder kalcium i det sarkoplasmatiska retikulumet. Andra gener associerade med CPVT inkluderar TECRL-kodande Trans-2,3-enoyl-CoA-reduktasliknande protein, CALM1- kodande Calmodulin och TRDN- kodande Triadin.
CPVT1: RYR2-mutationer
De vanligast identifierade genetiska mutationerna hos de som lider av CPVT förekommer i RYR2-genen som kodar för hjärtryanodinreceptorn. Mutationer i denna gen leder till en autosomal dominerande form av CPVT känd som CPVT1. Medan den exakta effekten skiljer sig mellan specifika mutationer i denna gen, orsakar många RYR2-mutationer att ryanodinreceptorn öppnas som svar på lägre kalciumkoncentrationer - tröskeln för kalciumfrisättning är lägre. Som ett resultat släpper det sarkoplasmiska retikulumet spontant kalcium genom dessa onormala ryanodinreceptorer när koncentrationen av kalcium i det sarkoplasmiska retikulumet stiger, en process som kallas butik-överbelastningsinducerad kalciumfrisättning. Sarkoplasmatiskt innehåll av kalcium i retikulum ökar som svar på stimulering från katekolaminer, vilket förklarar varför arytmier hos personer med CPVT uppträder vid tidpunkter när katekolaminnivåerna är förhöjda. Vissa föreslår att den ökade känsligheten för kalcium endast uppträder när ryanodinreceptorn fosforyleras av proteinkinas A, medan andra föreslår att den ökade känsligheten också uppträder under vilotillstånd.
Två teorier har föreslagits för den underliggande mekanismen genom vilken mutationer i RYR2 främjar butik-överbelastning inducerad kalciumfrisättning: domänuppackning och FKBP12.6- bindning. Domänuppackning avser separationen av två viktiga regioner i ryanodinreceptorn, N-terminalen och den centrala domänen. Genom denna mekanism kan en mutation destabilisera ryanodinreceptorns stängda tillstånd och öka dess känslighet för kalcium. En andra potentiell mekanism involverar det reglerande proteinet FKBP12.6, ett protein som binder till och stabiliserar ryanodinreceptorn. Bindningen av FKBP12.6 till ryanodinreceptorn regleras av fosforylering. Fosforylering med proteinkinas A leder till dissociation av FKBP12.6, vilket gör ryanodinreceptorn känsligare för cytosoliskt kalcium. RYR2-mutationer kan störa bindningen av FKB12.6 till ryanodinreceptorn och därigenom öka känsligheten för kalcium. Det är troligt att FKBP12.6 spelar en roll i vissa CPVT-mutationer men inte andra.
RYR2-mutationer som ansvarar för CPVT finns huvudsakligen i fyra huvuddomäner i genen. Mutationer som påverkar domänerna III och IV i genen (motsvarande den N-terminala regionen i proteinet respektive cytosolisk linker) förekommer i 46% av fallen. Mutationer ses mindre ofta som påverkar domänerna I och II, vilka båda kodar sektioner av proteinets N-terminala region. RYR2-mutationer associerade med CPVT som förekommer utanför dessa fyra domäner är mycket sällsynta och ansvarar för så få som 10% av rapporterade fall. RYR2-mutationer är oftast missens-mutationer , såsom enstaka nukleotidsubstitutioner som orsakar att en aminosyra ersätts med en annan, även om substitutioner och duplikationer inom ramen har beskrivits. Mer skadliga nonsensmutationer har inte rapporterats i samband med CPVT, potentiellt för att dessa varianter kan leda till olika hjärtsjukdomar som kardiomyopatier .
CPVT2: CASQ2-mutationer
Mutationer i CASQ2-genen är associerade med en autosomal recessiv form av CPVT, känd som CPVT2. Denna gen kodar för calsequestrin, det huvudsakliga kalciumbindande proteinet och kalciumbufferten i det sarkoplasmiska retikulumet. Mutationer i CASQ2 står endast för 3-5% av fallen med CPVT. Fjorton mutationer i CASQ2 har identifierats i samband med CPVT. Två av dessa är nonsensmutationer som orsakar att proteinet är onormalt kort, och två är strykningsmutationer, medan tio är missense-mutationer som ersätter en aminosyra mot en annan i kedjan som bildar proteinet.
Mutationer i CASQ2 orsakar en minskning av sarkoplasmatiskt kalciumbuffringskapacitet. Detta innebär att abrupta förändringar i sarkoplasmatiskt totalt kalcium kommer att buffras mindre och därför översättas till större förändringar i fritt kalcium. De högre topparna i fritt kalcium har större potential att orsaka frisättning av kalcium från sarkoplasmatisk retikulum, vilket leder till efterdepolarisationer.
Förutom sin roll som kalciumbuffert reglerar calsequestrin också frisättningen av kalcium från det sarkoplasmatiska retikulumet genom direkt modulering av ryanodinreceptorer. När kalciumkoncentrationen är låg bildar calsequestrinmonomerer ett komplex med proteinerna triadin och junctin , som hämmar ryanodinreceptorer. Men vid höga kalciumkoncentrationer bildar calsequestrin polymerer som dissocierar från ryanodinreceptorkanalkomplexet, vilket tar bort det hämmande svaret och ökar känsligheten hos ryanodinreceptorn för spontant frisättning av kalcium.
Minskad CASQ2 är också associerad med höga nivåer av kalretikulin , ett protein som bland annat reglerar återupptag av kalcium i det sarkoplasmatiska nätverket av SERCA. I frånvaro av CASQ2 ökar kalretikulinnivåerna och ger viss kompenserande kalciumbindning i det sarkoplasmatiska retikulumet. Det är möjligt att kalretikulin kan bidra till genereringen av arytmier som ses i samband med CASQ2-mutationer.
Diagnos
CPVT kan vara en utmaning att diagnostisera eftersom hjärtstrukturen verkar normal hos de som drabbas av tillståndet när de bedöms med hjälp av ett ekokardiogram , hjärt- MR-skanning eller hjärt- CT-skanning , medan hjärtets elektriska funktion också verkar normal i vila vid bedömning med hjälp av en standard 12-avlednings-EKG . Som svar på träning eller katekolaminer, såsom adrenalin, kan onormala hjärtrytmer såsom dubbelriktad ventrikulär takykardi eller frekventa polymorfa ventrikulära ektopiska slag ses.
12-avlednings-EKG
Det vilande 12-avlednings-EKG är ett användbart test för att skilja CPVT från andra elektriska hjärtsjukdomar som kan orsaka liknande onormala hjärtrytmer. Till skillnad från tillstånd som långt QT-syndrom och Brugadas syndrom är vilande 12-bly-EKG i de med CPVT i allmänhet normalt. Cirka 20% av de drabbade har emellertid en långsam vilopuls eller sinusbradykardi .
Träning och andra provocerande tester
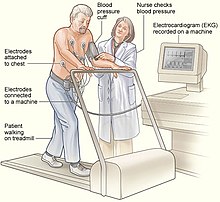
Träningstestning , som vanligtvis utförs på ett löpband eller en stationär cykel , kan hjälpa till att diagnostisera CPVT. Under testet upplever de med CPVT ofta ektopiska slag, vilket kan utvecklas till dubbelriktad och därefter polymorf ventrikulär takykardi när träningsintensiteten ökar. Några av dem som misstänks ha CPVT, till exempel små barn, kanske inte kan utföra ett träningstoleranstest. I dessa fall inkluderar alternativa former av testning adrenalinprovokeringstest, under vilken adrenalin infunderas i en ven vid gradvis ökande doser under noggrann övervakning och EKG-övervakning. Dessutom kan långtids- eller Holter-EKG-övervakning utföras, även om denna typ av test är mindre benägna att upptäcka arytmi. Invasiva elektrofysiologiska studier ger inte användbar information för att hjälpa till att diagnostisera CPVT eller för att bedöma risken för livshotande arytmier.
Genetisk testning
CPVT kan också diagnostiseras genom att identifiera en sjukdomsframkallande mutation i en gen associerad med CPVT med hjälp av genetisk testning . Denna teknik kan vara det enda sättet att identifiera tillståndet hos någon som misstänks ha CPVT som har dött, och i detta fall kan det kallas en molekylär obduktion .
Behandling
Behandlingar för CPVT syftar till att förhindra dödliga onormala hjärtrytmer och att snabbt återställa en normal rytm om de inträffar. Eftersom arytmierna i CPVT vanligtvis förekommer vid tidpunkter då hjärtat utsätts för höga nivåer av adrenalin eller andra liknande kemiska budbärare (katekolaminer) syftar många behandlingar för CPVT till att sänka nivåerna av katekolaminer som hjärtat utsätts för eller blockerar deras effekter hjärta.
Första linjens behandling för personer med CPVT innebär livsstilsråd. Detta inkluderar att undvika tävlingssporter, mycket ansträngande träning och mycket stressande miljöer, eftersom höga nivåer av adrenalin kan förekomma i dessa inställningar, vilket kan framkalla arytmier.
Medicin
Flera mediciner kan vara användbara för dem med CPVT. Grundstenarna i behandlingen är betablockerare , som blockerar effekterna av adrenalin och andra katekolaminer på hjärtat, vilket minskar risken för onormal hjärtrytm. Av alla betablockerare kan Nadolol vara den mest effektiva för behandling av CPVT. Detta läkemedel sänker hjärtfrekvensen i större utsträckning än andra betablockerare och behöver bara tas en gång dagligen, vilket minskar risken för missade doser. Nadolol kan vara svårt att få och är inte tillgängligt i alla länder, och en alternativ betablockerare lämplig för användning i CPVT är Propranolol .
Flecainide är ett klass 1c antiarytmiskt läkemedel som rekommenderas för dem med CPVT som upplever onormala hjärtrytmar trots att de tar en betablockerare. Flecainide minskar risken för arytmier hos personer med CPVT, men det är fortfarande osäkert hur Flecainide uppnår detta. Vissa har föreslagit att Flecainide interagerar direkt med hjärt-ryanodinreceptorn, vilket ofta är onormalt hos dem med CPVT, medan andra föreslår att de antiarytmiska effekterna av Flecainide är helt beroende av dess natriumkanalblockerande effekter.
Verapamil är en kalciumkanalantagonist som, i kombination med en betablockerare, kan minska risken för arytmier hos patienter med CPVT. Propafenon är en annan antiarytmika som kan minska risken för arytmier, potentiellt genom direkta effekter på ryanodinreceptorn.
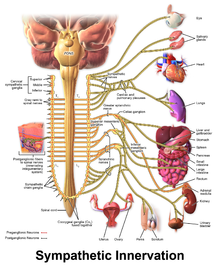
Sympatisk denervering
Vissa personer med CPVT fortsätter att uppleva livshotande arytmier trots läkemedelsbehandling. I detta fall kan ett kirurgiskt ingrepp användas för att påverka nerver som levererar hjärtat som kommunicerar med katekolaminer. En samling nerver som kallas det sympatiska nervsystemet försörjer hjärtat såväl som andra organ. När dessa nerver aktiveras uppmuntrar de hjärtat att slå hårdare och snabbare. Det sympatiska nervsystemet använder noradrenalin , en katekolamin, som en kemisk budbärare eller neurotransmittor , vilket kan främja arytmier hos personer med CPVT.
För att förhindra detta kan en region i det sympatiska nervsystemet avsiktligt skadas vid en operation som kallas hjärt sympatisk denervering eller sympatektomi. Medan det sympatiska nervsystemet matas in i hjärtat från båda sidor, riktas ofta bara de vänstra sidorna ner under sympatektomi, även om förstörelse av nerverna på båda sidor kan krävas. Genom denna process är sympatektomi effektivt för att minska risken för ytterligare livshotande arytmier.
Implanterbar kardioverter-defibrillator
Medan medicinering och sympatektomi syftar till att förhindra onormala hjärtrytmer från att börja med, kan en implanterbar defibrillator (ICD) användas för att behandla arytmier som läkemedel har misslyckats med att förhindra och återställa en normal hjärtrytm. Dessa enheter, vanligtvis implanterade under huden längst fram på bröstet under axeln, kan kontinuerligt övervaka hjärtat för onormala hjärtrytmer. Om en livshotande arytmi upptäcks kan enheten leverera en liten elektrisk chock för att avsluta den onormala rytmen och starta om hjärtat.
Implantabla defibrillatorer rekommenderas ofta för personer med CPVT som har upplevt mörkläggningar, ventrikulära arytmier eller hjärtstillestånd trots att de tar lämplig medicinering. Dessa enheter kan vara livräddande, även om den resulterande ökningen av adrenalin orsakad av smärtan av en elektrisk stöt från enheten ibland kan medföra en cykel av återkommande arytmier och stötar som kallas en elektrisk storm. På grund av detta rekommenderas det starkt att de med en ICD implanterad för CPVT tar en betablockerare för att dämpa effekterna av adrenalin.
Prognos
En betydande andel av dem med CPVT kommer att uppleva en livshotande onormal hjärtrytm, med uppskattningar av denna risk som sträcker sig från 13-20% under loppet av 7-8 år. Livshotande arytmier är mer benägna att uppstå om CPVT har diagnostiserats i barndomen, om en person med CPVT inte tar betablockerare och om arytmier uppträder vid träningstest trots att de tar betablockerare.
Epidemiologi
CPVT beräknas drabba 1 av 10 000 personer. Symtom från CPVT ses vanligtvis först under det första eller andra decenniet av livet, och mer än 60% av de drabbade individerna upplever sin första episod av synkope eller hjärtstillestånd vid 20 års ålder. Ett litet antal patienter kan dock vara närvarande senare i livet, och gentestning hos dessa patienter misslyckas ofta med att identifiera en orsakande gen.
Historia
År 1960 publicerade den norska kardiologen Knut Berg en rapport om tre systrar som drabbades av blackouts under träning eller emotionell stress i det som nu erkänns som den första beskrivningen av CPVT. Den dubbelriktade ventrikulära takykardin som är associerad med detta tillstånd beskrivs 1975. Termen "katekolaminerg polymorf ventrikulär takykardi" användes först 1978. År 1999 lokaliserades den första genetiska mutationen som orsakade CPVT att lokaliseras till kromosom 1q42-q43, som hittades att vara en variant i RYR2-genen 2001. Pågående forskning syftar till att identifiera bättre behandlingar för CPVT, att öka förståelsen för mekanismerna för arytmi och att identifiera andra gener som orsakar tillståndet.
Referenser
externa länkar
| Klassificering | |
|---|---|
| Externa resurser |